尿视黄醇结合蛋白(uRBP)测定试剂盒(胶乳免疫比浊法)产品技术要求北京赛诺浦
- 格式:docx
- 大小:15.71 KB
- 文档页数:3

视黄醇结合蛋白(RBP)测定试剂盒(胶乳免疫比浊法)性能指标1.性能指标1.1外观外观应符合以下要求:a)试剂盒各组分应齐全、完整,液体无渗漏;b)包装标签文字符号应清晰;c)R1:澄清无色至淡黄色液体;d)R2:白色胶乳状溶液,无异物和凝集物;e)校准品/质控品:无色至淡黄色液体。
1.2装量不同规格装量要求不低于标示量。
1.3试剂空白吸光度空白吸光度不高于1.2000。
1.4分析灵敏度测试浓度为50.0mg/L的样本时,吸光度差值(△A)应不小于0.07。
1.5线性范围1.5.1试剂盒在[3.5,200.0] mg/L范围内,线性相关系数r≥0.990。
1.5.2在[3.5,20.0] mg/L范围内,线性绝对偏差应不超过±2.0 mg/L;在(20.0,200.0] mg/L范围内,线性相对偏差应不超过±10%。
1.6重复性变异系数(CV)应不大于10%。
1.7批间差批间相对极差(R)应不大于10%。
1.8准确度相对偏差应不超过±10%。
1.9分析特异性当抗坏血酸≤50mg/dL、胆红素≤20mg/dL、血红蛋白≤500mg/dL、脂肪乳≤0.5%时,对试剂检测结果的偏差影响应在±10%以内。
1.10量值溯源应明确分析物的量值溯源。
1.11校准品赋值结果及其不确定度的表示方式应使用规范的表示方式,主要表示方式可选择:a)赋值结果±扩展不确定度;b)赋值结果,扩展不确定度。
1.12校准品正确度量值传递的正确度应符合E≤1。
n1.13质控品赋值准确度在用校准品校准后的生化分析仪上测试定值质控品,结果应在制造商指定的赋值范围内。
1.14校准品均匀性1.14.1瓶内均匀性:CV瓶内应不大于10%。
1.14.2瓶间均匀性:CV瓶间应不大于10%。
1.15质控品均匀性1.15.1瓶内均匀性:CV瓶内应不大于10%。
1.15.2瓶间均匀性:CV瓶间应不大于10%。

视黄醇结合蛋白测定试剂盒(免疫比浊法)适用范围:用于体外定量测定人血清中视黄醇结合蛋白的含量。
1.1包装规格试剂1:1×15mL,试剂2:1×5mL;试剂1:1×30mL,试剂2:1×10mL;试剂1:3×30mL,试剂2:1×30mL;试剂1:1×45mL,试剂2:1×15mL;试剂1:1×60mL,试剂2:1×20mL;试剂1:2×60mL,试剂2:2×20mL;试剂1:3×60mL,试剂2:1×60mL;试剂1:28×4mL,试剂2:14×2.8mL。
产品组成:试剂1:Tris缓冲液(pH7.0),浓度15 mmol/L;试剂2:包被羊抗人视黄醇结合蛋白多抗的胶乳颗粒液,浓度≥2.0 mg/L。
2.1 外观2.1.1 试剂1为无色透明液体,无混浊,无可见不溶物。
2.1.2 试剂2为白色或微黄色胶乳液体。
2.1.3 标签内容清晰,字迹不易脱落。
2.2 试剂装量液体试剂的净含量不少于标示值。
2.3 试剂空白吸光度A≤1.0(波长600nm,光径1cm)。
2.4 分析灵敏度10mg/L的视黄醇结合蛋白血清样本,吸光度变化在0.050~0.150范围内。
2.5 线性范围2.5.1[1,140]mg/L。
在规定的线性范围内,测定值与样本浓度值的相关系数(r)不低于0.990。
2.5.2[1,20]mg/L区间内,绝对偏差不超过±3mg/L;(20,140]mg/L区间内,相对偏差不超过±15%。
2.6 测量精密度2.6.1 批内精密度变异系数CV≤10%。
2.6.2 批间差批间相对极差≤10%。
2.7 准确度与已上市产品进行对比试验,相关系数r≥0.975。
[1,20]mg/L区间内,绝对偏差介于±3mg/L之间;(20,140]mg/L区间内,相对偏差介于±15%之间。

视黄醇结合蛋白测定试剂盒(免疫比浊法)适用范围:本产品用于体外定量测定人血清中视黄醇结合蛋白的含量。
1.1 规格具体产品规格见下表:1.2 组成成分1.2.1 试剂的组成试剂1:磷酸缓冲液 40mmol/L聚乙二醇6000 83g/L 试剂2:磷酸缓冲液 40mmol/L羊抗人RBP抗血清≥10%1.2.2 校准品的组成(选配)在牛血清白蛋白中添加视黄醇结合蛋白水平1:视黄醇结合蛋白(10.0~20.0)mg/L水平2:视黄醇结合蛋白(20.0~40.0)mg/L水平3:视黄醇结合蛋白(40.0~80.0)mg/L水平4:视黄醇结合蛋白(80.0~130.0)mg/L1.2.3 质控品的组成(选配)水平1:视黄醇结合蛋白(5.0~70.0)mg/L该质控品为血清基质质控品水平2:视黄醇结合蛋白(70.1~126.0)mg/L该质控品为血清基质质控品校准品、质控品有批特异性,具体靶值见靶值表。
2.1 外观2.1.1 外包装完整无破损;2.1.2 试剂1:无色透明无杂质液体;2.1.3 试剂2:无色或淡黄色澄清或微浊无絮状物液体;2.1.4 校准品:无色或淡黄色液体;2.1.5 质控品:无色或淡黄色液体。
2.2 净含量净含量不低于标示值。
2.3 试剂空白吸光度在主波长340nm、副波长700nm、37℃条件下,试剂空白吸光度不大于0.5。
2.4 线性2.4.1 线性范围[10.0,126.0]mg/L,相关系数r>0.990。
2.4.2 线性偏差(30.0,126.0]mg/L线性范围内,相对偏差不超过±15%;[10.0,30.0]mg/L线性范围内,绝对偏差不超过±4.5mg/L。
2.5 分析灵敏度检测浓度为92.0mg/L的样本时,吸光度变化不小于0.013。
2.6 重复性2.6.1 试剂重复性测试高、中、低浓度的血清样本或质控品,重复测试10次,CV≤10%;2.6.2 校准品重复性用试剂测定1瓶校准品,重复测定10次,CV≤10%;2.6.3 质控品重复性用试剂测定1瓶质控品,重复测定10次,CV≤10%。
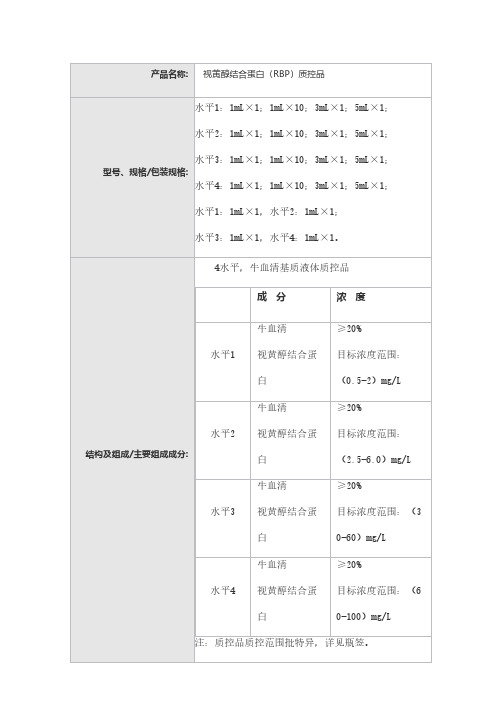
水平1:1mL×1;1mL×10;3mL×1;5mL×1;
水平2:1mL×1;1mL×10;3mL×1;5mL×1;
水平3:1mL×1;1mL×10;3mL×1;5mL×1;
水平4:1mL×1;1mL×10;3mL×1;5mL×1;
水平1:1mL×1,水平2:1mL×1;
水平3:1mL×1,水平4:1mL×1。
1.2主要组成成分
4水平,牛血清基质液体质控品
注:质控品质控范围批特异,详见瓶签。
2.1性状
质控品为无色至淡黄色液体。
2.2装量
液体质控品的装量不少于标示值。
2.3可接受区间
质控品测定值应在靶值范围内。
2.4瓶间均匀性
赋值结果的瓶间均匀性变异系数(CV)≤8%。
2.5稳定性
2.5.1效期稳定性
质控品原包装在2℃~8℃避光保存,有效期为18个月,在稳定期内赋值结果的变化趋势不显著。
2.5.2开瓶稳定性
质控品开瓶后,在2℃~8℃下避光密封保存,可保存14天,在稳定期内赋值结果的变化趋势不显著。

视黄醇结合蛋白(RBP)测定试剂盒(免疫比浊法)适用范围:本产品用于体外定量测定人血清中视黄醇结合蛋白的含量。
1.1 规格试剂1(R1):2×45mL、试剂2(R2): 2×15mL;校准品(选配):单水平1×1mL。
质控品(选配):高、中、低水平分别为1×3mL、1×1mL。
1.2 组成试剂盒由试剂、校准品(选配)和质控品(选配)组成。
试剂1(R1):磷酸盐缓冲液(PH=7.4)50mmol/L,稳定剂(牛血清白蛋白) 0.5 %,防腐剂(叠氮钠) 0.09 %;试剂2(R2):抗RBP抗体0.05%,稳定剂(牛血清白蛋白) 0.5 %,防腐剂(叠氮钠) 0.09 %。
校准品组成:单水平的液体校准品,在50mmol/L( pH=7.4)的磷酸盐缓冲液中添加视黄醇结合白蛋白纯品,稳定剂<0.5%;定值范围:(100~150)µg/ml。
质控品的组成:三个水平的液体质控品,在人血清基质中加入视黄醇结合蛋白纯品,添加人血清的比例为5%~10%,稳定剂<0.5%;目标浓度范围:低水平(15~40)µg/ml,中水平(40~70)µg/ml,高水平(70~120)µg/m l。
2.1 外观液体双试剂:R1:无色澄清液体;R2:无色至淡黄色澄清液体。
校准品:无色液体。
质控品:无色至浅黄色澄清液体。
2.2 净含量液体试剂净含量不得低于标示体积。
2.3 溯源性根据GB/T 21415及有关规定提供校准品的来源、赋值过程及测量不确定度等内容,该校准品溯源至视黄醇结合蛋白纯品(SCIPAC)。
2.4 空白吸光度在37℃、340nm波长、1cm光径条件下,试剂空白吸光度应<0.5ABS。
2.5 分析灵敏度浓度为50μg/ml时,吸光度差值的绝对值范围在>0.01ABS。
2.6 线性范围在[10,100]μg/ml线性范围内,线性相关系数r≥0.995;测定结果大于20μg/ml 时,相对偏差应≤15%,测定结果小于20μg/ml时,绝对偏差应<5μg/ml。

视黄醇结合蛋白测定试剂盒(免疫比浊法)适用范围:本试剂盒用于体外定量测定人血清中视黄醇结合蛋白的含量。
1.1产品规格1.2产品组成试剂1:氨基乙酸缓冲液 170mM。
试剂2:包被有抗人RBP兔抗体的乳胶颗粒0.4%(w/v%)。
2.1 外观试剂1为无色透明溶液,试剂2为乳白色液体;试剂盒各组分齐全、完整,液体无渗漏,包装标签文字符号清晰牢固不易脱落,外包装完整无破损。
2.2 装量液体试剂的净含量应不少于标示量。
2.3 试剂空白吸光度在570nm波长、1cm光径条件下,试剂空白吸光度应不大于1.20。
2.4分析灵敏度测定50mg/L视黄醇结合蛋白时,吸光度变化在(0.18±0.05)范围内。
2.5 准确度采用比对试验,相关系数r≥0.98;[3.5,30]mg/L区间内,线性绝对偏差不超过±3mg/L;(30,250]mg/L区间内,线性相对偏差不超过±10% 。
2.6 精密度2.6.1 重复性用血清样品或质控样品重复测试所得的变异系数(CV)应不大于5.0%。
2.6.2 批间差试剂(盒)批间相对极差应不大于6.0%。
2.7 线性区间试剂线性在[3.5,250]mg/L区间内:a) 线性相关系数|r|应不小于0.990;b) [3.5,30]mg/L区间内,线性绝对偏差应不超过±3mg/L;(30,250]mg/L 区间内,线性相对偏差应不超过±10%。
2.8稳定性原包装试剂2~8℃避光保存有效期12个月,到效期后的样品检测试剂空白、分析灵敏度、准确度、重复性、线性区间应符合2.3、2.4、2.5、2.6.1、2.7的要求。
视黄醇结合蛋白测定试剂盒(胶乳免疫比浊法)适用范围:用于体外定量测定人血清或尿液中视黄醇结合蛋白的含量。
1.1包装规格1)试剂1:45mL×1、试剂2:15mL×1;2)试剂1:45mL×3、试剂2:15mL×3;3)试剂1:48mL×1、试剂2:12mL×1;4)试剂1: 48mL×3、试剂2:12mL×3;校准品(血):0.5mL×5(选配);校准品(尿):0.5mL×5(选配);质控品水平1(血):0.5mL×1(选配);质控品水平2(血):0.5mL×1(选配);质控品水平1(尿):0.5mL×1(选配);质控品水平2(尿):0.5mL×1(选配)。
1.2组成成分试剂1:磷酸缓冲液 100mmol/L聚乙二醇 2.00%吐温-20 0.05%试剂2:磷酸缓冲液 100mmol/L抗人视黄醇结合蛋白抗体包裹的聚苯乙烯颗粒按效价确定校准品(血):磷酸缓冲液、人血清(≥5%)、视黄醇结合蛋白,校准品目标浓度:水平1:0.0mg/L,水平2:17.5mg/L,水平3:35.0mg/L,水平4:70.0mg/L,水平5:140.0mg/L,批特异,具体浓度见瓶签;校准品(尿):磷酸缓冲液、视黄醇结合蛋白,校准品目标浓度:水平1:0.00mg/L,水平2:0.50mg/L,水平3:2.00mg/L,水平4:5.00mg/L,水平5:10.00mg/L,批特异,具体浓度见瓶签;质控品(血):磷酸缓冲液、人血清(≥5%)、视黄醇结合蛋白,质控品靶值范围:水平1:23.0mg/L~33.0mg/L;水平2:47.0mg/L~ 67.0mg/L,批特异,具体浓度见瓶签;质控品(尿):磷酸缓冲液、视黄醇结合蛋白,质控品靶值范围:水平1:0.40mg/L ~ 0.60mg/L;水平2:1.60mg/L~2.40mg/L,批特异,具体浓度见瓶签。
视黄醇结合蛋白校准品适用范围:本校准品与本公司视黄醇结合蛋白测定试剂盒配套使用,用于临床检验实验室视黄醇结合蛋白项目定量检测的系统校准。
1.1规格1mL×5(5个浓度)1.2主要组成成分本产品以人血清为基质,并添加了视黄醇结合蛋白、10mmol/L pH7.0的磷酸盐缓冲液和防腐剂。
校准品定值范围:浓度①:0mg/L;浓度②:12mg/L~24mg/L;浓度③:25mg/L~45mg/L;浓度④:50mg/L~90mg/L;浓度⑤:100mg/L~150mg/L。
(每批定值,详见值单)2.1外观本校准品应为无色至浅黄色溶液,无混浊,无未溶解物。
2.2准确度中生试剂(中生校准品定标)和已上市同类试剂(已上市同类试剂校准品定标),分别测定40个在测定范围内不同浓度的血清样本,计算两组数据的相关系数(r)及测值的偏差,要求r≥0.975;在(40,150]mg/L范围内,相对偏差应不超过±10%;在[10,40]mg/L范围内,绝对偏差应不超过±4mg/L。
2.3重复性重复测定结果的变异系数(CV)应≤5%。
2.4稳定性2.4.1效期稳定性原包装校准品在2℃~8℃条件下贮存,有效期为12个月。
在有效期满后3个月内,校准品性能应符合2.1、2.2、2.3要求。
2.4.2开瓶稳定性开瓶后校准品在2℃~8℃条件下密闭保存,稳定期为7天;在稳定期满后1天内,校准品性能应符合2.1、2.2、2.3要要求。
2.5溯源性校准品溯源性应符合GB/T 21415-2008的要求,并提供相关溯源过程,本校准品溯源至工作校准品并经与已上市产品比对定值。
医疗器械产品技术要求编号:视黄醇结合蛋白(RBP)测定试剂盒(胶乳增强免疫比浊法)2.性能指标2.1试剂盒性能指标2.1.1外观试剂盒各组分应齐全、完整、无液体渗漏;液体试剂应为澄清透明、无絮状物、无肉眼可见颗粒及沉淀的液体;包装标签应清晰,准确、牢固。
2.1.2装量液体试剂的装量应不小于标示量。
2.1.3试剂空白吸光度在温度37℃、波长600nm条件下检测,试剂空白吸光度应≤1.50(比色杯光径0.6cm)。
2.1.4分析灵敏度a)血清或血浆样本:测定视黄醇结合蛋白浓度为50.0mg/L的样品时,其吸光度差值(△A)应≥0.05。
b)尿液样本:测定视黄醇结合蛋白浓度为1.0mg/L的样品时,其吸光度差值(△A)应≥0.01。
2.1.5准确度以企业参考品为检测样本,测定结果与企业参考品靶值浓度的相对偏差应在±15%范围内。
2.1.6线性2.1.6.1血清或血浆样本线性区间a)线性区间[10.0,120.0]mg/L,相关系数r应≥0.9900;b)[10.0,30.0]mg/L区间内绝对偏差应不超过±3.0mg/L;(30.0,120.0]mg/L 区间内相对偏差应不超过±10.0%。
2.1.6.2尿液样本线性区间a)线性区间[0.2,10.0]mg/L,相关系数r应≥0.9900;b)[0.2,1.0]mg/L区间内绝对偏差应不超过±0.15mg/L;(1.0,10.0]mg/L 区间内相对偏差应不超过±15.0%。
2.1.7精密度2.1.7.1重复性CV应≤10%。
2.1.7.2批间差相对极差(R)应≤15%。
2.2校准品性能指标2.2.1性状血清或血浆校准品、尿液校准品应为无色液体。
2.2.2装量血清或血浆校准品、尿液校准品装量应不少于标示值。
2.2.3正确度使用校准物校准后测量参考物质,量值传递的正确度应符合|En|≤1。
2.2.4均匀性a)瓶内均匀性:CV≤10%;b)瓶间均匀性:CV≤10%。
尿视黄醇结合蛋白(uRBP)测定试剂盒(胶乳免疫比浊法)
适用范围:用于体外定量测定人体尿液中视黄醇结合蛋白的含量。
1.1 试剂盒包装规格
试剂1:1×15mL,试剂2:1×5mL;试剂1:2×30mL,试剂2:2×10mL;
试剂1:2×54mL,试剂2:2×18mL;试剂1:3×45mL,试剂2:3×15mL;
试剂1:4×54mL,试剂2:4×18mL;试剂1:2×300mL,试剂2:1×200mL;
试剂1:1×9L,试剂2:1×3L。
校准品(选配):5×0.5mL(五水平),5×1mL(五水平)。
质控品(选配):1×0.5mL,1×1mL。
1.2 试剂盒主要组成成分
注:校准品和质控品存在批特异性,具体浓度见对应批次产品标签。
2.1 外观
液体双试剂:试剂1 无色澄清液体;试剂2 白色悬浊液。
校准品:无色至淡黄色液体。
质控品:无色至淡黄色液体。
2.2 净含量
净含量不得低于标示体积。
2.3 试剂空白吸光度
在37℃、600 nm波长、1cm光径条件下,试剂空白吸光度应不大于
1.5。
2.4 分析灵敏度
测定浓度在1.0mg/L的样本时,吸光度变化值应>0.01。
2.5 线性
在(0.2,10.0)mg/L范围内,线性相关系数r不小于0.990。
在(0.2,1.0]mg/L区间内线性绝对偏差不大于±0.15mg/L;在(1.0,10.0)mg/L区间内线性相对偏差不大于±15.0%。
2.6 重复性
重复测试两份高低浓度的样本,所得结果的变异系数(CV%)应不大于10%。
2.7 批间差
不同批号试剂测试同一份样本,测定结果的批间相对极差应不大于15%。
2.8 准确度
与已上市产品进行比对试验,在(0.2,10.0)mg/L范围内,线性相关系数r不小于0.975。
在(0.2,1.0]mg/L区间内线性绝对偏差不大于±0.15mg/L;在(1.0,10.0)mg/L区间内线性相对偏差不大于±15.0%。
2.9 质控品赋值有效性
测定结果在靶值范围内。
2.10 校准品溯源性
依据GB/T 21415-2008《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》的要求,提供试剂盒内校准品的来源、赋值过程及测量不确定度。
校准品溯源至企业工作校准品。
2.11 稳定性
效期稳定性:试剂盒在2℃~8℃储存,有效期为12个月,取失效期的试剂盒进行检测,试验结果应满足2.1、2.3、2.4、2.5、2.6、2.8、2.9要求。