第4章管式反应器
- 格式:ppt
- 大小:2.43 MB
- 文档页数:107



第一章绪论习题1.1 解题思路:(1)可直接由式(1.7)求得其反应的选择性(2)设进入反应器的原料量为100 ,并利用进入原料气比例,求出反应器的进料组成(甲醇、空气、水),如下表:组分摩尔分率摩尔数根据式(1.3)和式(1.5)可得反应器出口甲醇、甲醛和二氧化碳的摩尔数、和。
并根据反应的化学计量式求出水、氧及氮的摩尔数,即可计算出反应器出口气体的组成。
习题答案:(1) 反应选择性(2) 反应器出口气体组成:第二章反应动力学基础习题2.1 解题思路:利用反应时间与组分的浓度变化数据,先作出的关系曲线,用镜面法求得反应时间下的切线,即为水解速率,切线的斜率α。
再由求得水解速率。
习题答案:水解速率习题2.3 解题思路利用式(2.10)及式(2.27)可求得问题的解。
注意题中所给比表面的单位应换算成。
利用下列各式即可求得反应速率常数值。
习题答案:(1)反应体积为基准(2)反应相界面积为基准(3)分压表示物系组成(4)摩尔浓度表示物系组成习题2.9 解题思路:是个平行反应,反应物A的消耗速率为两反应速率之和,即利用式(2.6)积分就可求出反应时间。
习题答案:反应时间习题2.11 解题思路:(1)恒容过程,将反应式简化为:用下式描述其反应速率方程:设为理想气体,首先求出反应物A的初始浓度,然后再计算反应物A的消耗速率亚硝酸乙酯的分解速率即是反应物A的消耗速率,利用化学计量式即可求得乙醇的生成速率。
(2)恒压过程,由于反应前后摩尔数有变化,是个变容过程,由式(2.49)可求得总摩尔数的变化。
这里反应物是纯A,故有:由式(2.52)可求得反应物A的瞬时浓度,进一步可求得反应物的消耗速率由化学计量关系求出乙醇的生成速率。
习题答案:(1)亚硝酸乙酯的分解速率乙醇的生成速率(2)乙醇的生成速率第三章釜式反应器习题3.1 解题思路:(1)首先要确定1级反应的速率方程式,然后利用式(3.8)即可求得反应时间。
(2)理解间歇反应器的反应时间取决于反应状态,即反应物初始浓度、反应温度和转化率,与反应器的体积大小无关习题答案:(1)反应时间t=169.6min.(2)因间歇反应器的反应时间与反应器的体积无关,故反应时间仍为169.6min.习题3.5 解题思路:(1)因为B过量,与速率常数k 合并成,故速率式变为对于恒容过程,反应物A和产物C的速率式可用式(2.6)的形式表示。


《化学反应工程原理》复习思考题第一章绪论1、了解化学反应工程的研究内容和研究方法。
2、几个常用指标的定义及计算:转化率、选择性、收率。
第二章化学反应动力学1、化学反应速率的工程表示,气固相催化反应及气液相非均相反应反应区的取法。
2、反应速率常数的单位及其换算。
3、复杂反应的反应速率表达式(可逆、平行、连串、自催化)。
4、气固相催化反应的步骤及基本特征。
5、物理吸附与化学吸附的特点。
6、理想吸附等温方程的导出及应用(单组分吸附、解离吸附、混合吸附)。
7、气固相催化反应动力学方程的推导步骤。
8、不同控制步骤的理想吸附模型的动力学方程的推导。
9、由已知的动力学方程推测反应机理。
第三章理想间歇反应器与典型化学反应的基本特征1、反应器设计的基本方程式。
2、理想间歇反应器的特点。
3、理想间歇反应器等温、等容一级、二级反应反应时间的计算及反应器体积的计算。
4、自催化反应的特点及最佳工艺条件的确定及最佳反应器形式的选择。
5、理想间歇反应器最优反应时间的计算.7、可逆反应的反应速率,分析其浓度效应及温度效应。
8、平行反应选择率的浓度效应及温度效应分析。
9、平行反应反应器形式和操作方式的选择。
10、串连反应反应物及产物的浓度分布,t opt C p.max的计算。
11、串连反应的温度效应及浓度效应分析。
第四章理想管式反应器1、理想管式反应器的特点。
2、理想管式反应器内进行一级、二级等容、变容反应的计算。
3、空时、空速、停留时间的概念及计算。
4、膨胀率、膨胀因子的定义,变分子数反应过程反应器的计算。
第五章理想连续流动釜式反应器1、全混流反应器的特点。
2、全混流反应器的基础方程及应用。
3、全混釜中进行零级、一级、二级等温、等容反应时的解析法计算。
4、全混釜的图解计算原理及图解示意。
5、全混流反应器中的浓度分布与返混,返混对反应的影响。
6、返混产生的原因及限制返混的措施。
7、多釜串联反应器进行一级、二级不可逆反应的解析法计算。
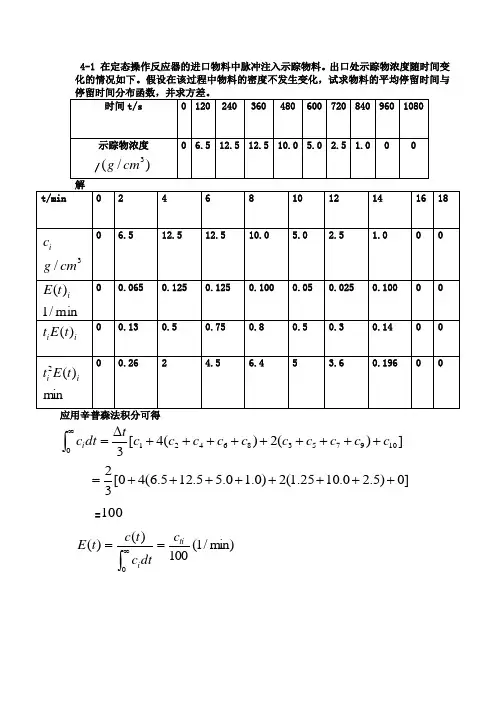
4-1 在定态操作反应器的进口物料中脉冲注入示踪物料。
出口处示踪物浓度随时间变化的情况如下。
假设在该过程中物料的密度不发生变化,试求物料的平均停留时间与])(2)(4[3109753864210c c c c c c c c c c tdt c i +++++++++∆=⎰∞]0)5.20.1025.1(2)0.10.55.125.6(40[32++++++++==100min)/1(100)()(0tii c dtc t c t E ==⎰∞})(])()()()([2])()()()([4)({31010997755338866442211_t E t t E t t E t t E t t E t t E t t E t t E t t E t t E t tt +++++++++∆=]0)03.08.05.0(2)14.05.075.013.0(40[32+++++++++=min 187.6=⎰∞=-=-=02222971.8187.625.47)(t dt t E t tσmin 24-2 无量纲方差表达式的推导 (1)推导无量纲方差222/ttσσθ=;(2)推导CSTR 的22tt=σ。
1. τθt=2. ττtet E -=1)(证明:222)(i i i ittt t E t -∆=∑∞σ⎰∞--=221tdt e t t ττ22)()()()(ττθθττθ--=⎰∞-d t E()]1)1([022--=⎰∞θθθτd E22θστ= 222/τσσθt=∴ 220222)(1)(--∞-=-=⎰⎰t dt e tt dt t E t ttττσ222ττ-=2τ=22τσ=t4-3 设()θF 及()θE 分别为闭式流动反应器的停留时间分布函数及停留时间分布密度函数,θ为对此停留时间。
(1)若该反应器为平推流反应器,试求①F(1); ②E(1);③F(0.8);④E(0.8);⑤F(1.2) (2)若该反应器为全混流反应器,试求①F(1); ②E(1);③F(0.8);④E(0.8);⑤F(1.2) (3)若该反应器为非理想流动反应器,试求 ①F(∞); ②F(0);③E(∞);④E(0);⑤⎰∞0)(θθd E ;⑥⎰∞)(θθθd E解1平推流模型0)(=θF )(t t 〈 0)(=θE )(t t ≠1)(=θF )(t t≥ ∞=)(θE )(t t =)()(τθtF F =⎪⎩⎪⎨⎧===2.1,18.0,01,1θθθ⎩⎨⎧=====8.0,01,1)()(θθτθt E E2 全混流θθ-=e E )( , θθ--=e F 1)(==)()(τθt f F ⎪⎭⎪⎬⎫=-=-=----699.01551.01632.012.18.01e e e ⎪⎩⎪⎨⎧===2.18.01θθθ ==)()(τθtE E ⎪⎭⎪⎬⎫==--449.0368.08.01e e ⎩⎨⎧==8.01θθ3非理想流动模型a 多釜串联θθθN N N e N N E ---=1)!1()(, 0)(C C F N =θ()()1]!11)(!21)(!111[1)(12=-++++-=∞--N N N N N N e F θθθθ()()0]!11)(!21)(!111[1)0(12=-++++-=--N N N N N N eF θθθθ()()()0!11=-=∞--θθN N Ne N N E()()1,00!1001≠=-=-N e N N E N N()()1!1!1)(01010=-=-=⎰⎰⎰∞--∞--∞θθθθθθθθd e N N d e N N d E N N NN N N ()1!1)(0=-=⎰⎰∞-∞θθθθθθd e N N d E N N N4-4 C(t)t/min4-18图用阶跃法测定某一闭式流动反应器的停留时间分布,得到离开反应器的示踪剂浓度与时间的关系,如图4-18所示。

第一章 绪论 1、化学反应工程是化学工程学科的一个分支,通常简称为反应工程。
其内容可概括为两个方面,即反应动力学和反应器设计与分析。
2、传递现象包括动量、热量和质量传递,再加上化学反应,这就是通常所说的三传一反。
3、反应组分的反应量与其化学计量系数之比的值为定值,ξ叫做反应进度且恒为正值。
、本书规定反应物的化学计量系数一律取负值,而反应产物则取正值。
8、工业反应器有三种操作方式: ① 间歇操作;② 连续操作;③ 半间歇(或半连续)操作 9、反应器设计的基本内容一般包括:1)选择合适的反应型式 ;2)确定最佳操作条件 ;3)根据操作负荷和规定的转化程度,确定反应器的体积和尺寸 。
10.反应器按结构原理的特点可分的类型: 管式,釜式 ,塔式,固定床,流化床,移动床,滴流床反应器。
第二章 3、温度对反应速率的影响 如果反应速率方程可以表示为:r=f1 (T)f2(c ),f1(T)是温度的影响。
当温度一定时,其值一定。
通常用阿累尼乌斯方程(Arrhenius ‘ law )表示反应速度常数与温度的关系, 即, 为指前因子,其因次与k 相同;E 为反应的活化能;R 为气体常数。
两边取对数,则有 : lnk=lnA0-E/RT ,lnk 对 1/T 作图,可得-直线,直线的斜率=-E/RT 。
注意:不是在所有的温度范围内上面均为直线关系,不能外推。
其原因包括:(1)速率方程不合适; (2)反应过程中反应机理发生变化;(3)传质的影响;(4)指前因子A0与温度有关。
速率极大点处有: 对应于极大点的温度叫做最佳温度Top 。
速率为零点处有: rA=0 6、多相催化与吸附 1)、催化剂的用途:①加快反应速度②定向作用(提高选择性)-化学吸附作用结果 2)、催化剂的组成:主催化剂-金属或金属氧化物,用于提供反应所需的活性中心。
助催化剂-提高活性,选择性和稳定性。
助催化剂可以是 ①结构性的;② 调变性的。
载体-用于 ① 增大接触表面积;②改善物理性能。



化学反应工程陈甘棠答案【篇一:反应工程第五章习题答案】xt>5.1乙炔与氯化氢在hgcl2-活性炭催化剂上合成氯乙烯的反应c2h2?hcl?c2h3cl (a)(b) (c)其动力学方程式可有如下种种形式:(1) r??(papb?pc/k)/(1?kapa?kbpb?kcpc) (2)r??kakbpapb/(1?kbpb?kcpc)(1?kapa) (3)r??kapapb/(1?kapa?kbpb)(4) r??kbpapb/(1?kbpb?kcpc)2试说明各式所代表的反应机理和控制步骤。
解:(1) a???a?b???b?a??b??c??? (控制步骤) c??c??(2) a??1?a?1b??2?b?2a?1?b?2?c?2??1(控制步骤) c?1?c??1(3)a???a?b???b?a??b?c?? (控制步骤)(4) b???b?a?b??c? (控制步骤) c??c??5.2 在pd-al2o3催化剂上用乙烯合成醋酸乙烯的反应为c2h4?ch3cooh?12实验测得的初速率数据如下[功刀等,化工志,71,2007(1968).] 115℃, pacoh?200mmhg,po?92mmhg。
2pc2h4(mmhg)r0?10(mol/hr?g催化剂)570 100 195 247 315 4653.94.4 6.0 6.6 7.255.4注:1mmhg=133.322pa如反应机理设想为acoh???acoh?c2h4???c2h4?acoh?c2h4?hc2h4oac???o2?2??2o?hc2h4oac??o??c2h3oac??h2o? (控制步骤)c2h3oac??c2h3oac??h2o? ?h2o+?试写出反应速率并检验上述部分数据能与之符合否。
解:c2h4?ch3cooh?12o2?ch2cooc2h3?h2o(a)(b)(c)(e)(f) ?a?kapa?v?b?kbpb?v?c?v?f?kfpf?v ?d?ks1kakbpapb?v ?e?kep?ev?v??k2?k3par?ks2?d?c??k1pa(k2?k3pa)2r0??pa(k2?k3pa)2pc2h4(mmhg)70 100 195 247 315 465r0?10(mol/hr?g催化剂)53.94.4 6.0 6.6 7.255.41.3410?31.51 1.80 1.932.08 2.93pa作图,基本上为一直线。

管式反应器除了上一章的两类理想反应器,管式反应器也是一类理想反应器模型(活塞流模型)。
与间歇釜式反应器不同,全混流和活塞流模型用于流动过程。
根据上一章所学的知识,物料在反应器中的停留时间是决定化学反应转化程度和产物分布的一个重要因素。
全混流和活塞流模型均是根据特定的停留时间分布规律建立起来的(这部分内容将在下一章中详细阐述),是两种极端的情况,是分析许多问题的出发点,也是各种实际反应器设计的理论基础。
本章将涉及到如下的具体内容:活塞流模型的基本假定等温管式反应器设计与分析管式反应器与釜式反应器的性能比较循环管式反应器的分析计算管式反应器的变温操作第一节活塞流假定流体流动是非常复杂的物理现象,影响到系统的反应速率和转化程度。
一、流动状况对反应过程的影响1. 流动情况影响例1. (1)空管中, 图4.1 (a)(b) 内部各部分流体的停留时间不同,因此反应时间也不一样,反应速率和最终转化率也不一样第二节等温管式反应器的设计一、单一反应在管式反应器中进行的单一反应,取如图4.2所示的微元体(高为dZ)图 4.2 管式反应器示意图在定态条件下,由此得到或∴(4-4)∴(4-5)假设 =常数(=X Af下的值),则--釜式反应器的设计方程式(4-5)可以进一步变成:(间歇釜式的设计的方程为)注意:二者尽管形式上相同,但一个是反应时间t,一个空时τ(与所选择的进口状态有关)。
另外,间歇釜式反应器总是恒容的。
如果管式反应器也在恒容下进行,则有τ=t;否则,τ≠t。
对于式(4-4),设反应器的截面积为A,则有dV r=Ad Z,那么对于恒容过程 C A=C AO(1-X A)则时间变量转化为位置变量。
例4.1 例4.2 例4.3例4.4例4.5第三节管式与釜式反应器反应体积的比较在处理量、组成、T、XAf相同的条件下进行对比。
对于二级可逆反应,使用不同形式的理想反应器时所需要的反应体积如表4-1所示,即有(本章前面和上一章的例题给出的结果)一般来说,比较按正常动力学和反常动力学两种情况讨论:图 4.3 连续反应器反应体积的比较对于复杂反应,要同时考虑反应体积V和产物分布,后者更为重要。
1 / 1
第四章非理想流动习题
1.脉冲示踪法测得如下数据:
求E 函数和F 函数
2.有一个反应器测得其离散准数τ
0.2D
uL
=。
对此反应进行示踪实验时符合闭式容器条件。
今在同样条件下用多釜串联模型描述其模型参数N 为多少?
3.有一个长12m 的管子,其中左端1m ,装有2mm 的固体颗粒,中间9m ,装有1cm 的固体颗粒,右端2m ,填有4mm 的固体颗粒。
假设空隙率相同
2D
udp
=,流体通过的时间为2min ,试估计出口方差:【提示:1()D udp =2()D udp =3()2D udp =,
()D uLi =()D
udpi ()dpi Li
,22t ti σσ=∑(有加合性)
】
求:(1)平均停留时间和方差;
(2)若在该反应器中进行一级不可逆反应A R →,速率常数0.045k =min -1 求A 的平均转化率?
求:(1)平均停留时间和无因次方差; (2)若用于一级反应,且该反应在单个全混釜中相同的τ下限定组分A 的转化率为0.82,在此真实反应器中转化率为多少?
(3)若进料量为20L/s,该容器的体积多大?
请预测一下相当于几个全混釜的串联效果。