分子轨道理论8.
- 格式:ppt
- 大小:542.50 KB
- 文档页数:54

分子轨道知识点总结1. 分子轨道的形成分子轨道是由分子中的原子核和电子组合而成的,它可以描述分子中的所有电子的动态行为。
分子轨道的形成可以通过原子轨道的线性组合来解释。
在分子中,原子轨道可以相互叠加和组合,从而形成分子轨道。
分子轨道的形成过程中要考虑电子之间的排斥作用和吸引作用,这些相互作用将影响分子轨道的形状和能量。
2. 分子轨道的分类分子轨道可以根据它们的形状和能量分为两类:成键分子轨道和反键分子轨道。
成键分子轨道是由原子轨道的叠加形成的,它们的能量低于原子轨道的能量,并且在成键区域中存在电子密度。
反键分子轨道则是原子轨道叠加形成的,它们的能量高于原子轨道的能量,并且在反键区域中存在电子密度。
成键分子轨道和反键分子轨道之间存在一个能隙,称为禁带,代表了分子的稳定性和化学性质。
3. 分子轨道理论的基本原理分子轨道理论的基本原理是通过量子力学的方法来描述分子的电子结构和化学性质。
量子力学中的薛定谔方程可以用来描述分子轨道的波函数和能量,并且通过求解薛定谔方程可以得到分子轨道的形状和能量。
分子轨道理论假设分子的波函数是原子波函数的线性组合,这种线性组合的方法被称为LCAO(线性组合原子轨道)近似。
在LCAO近似下,可以得到分子轨道能量和形状的数学表达式,从而可以对分子的电子结构和化学性质进行计算和预测。
4. 分子轨道理论的应用分子轨道理论在化学和物理领域有广泛的应用。
它可以用来解释分子的结构和性质,预测分子的反应和性质,设计新的分子材料,以及研究分子相互作用和反应机理。
分子轨道理论可以结合实验数据来解释分子实验现象,并且可以为化学工程、材料科学和药物设计等领域提供理论指导。
它也可以用来模拟分子的光电性质、磁性质和电荷传输性质,为材料和分子器件的设计提供理论基础。
5. 分子轨道理论的发展与挑战分子轨道理论自提出以来已经经历了数十年的发展,形成了多种不同的理论方法和计算技术。
包括分子轨道理论、密度泛函理论、半经验分子轨道理论等。

无机化学万题库是非题(一)物质的状态1.()1 mol 物质的量就是1 mol 物质的质量。
2.()溶液的蒸气压与溶液的体积有关,体积越大,蒸气压也越大。
3.()温度较低、压力较高的实际气体性质接近于理想气体。
4.()范德华方程是在理想气体状态方程的基础上修正的,所以修正后范德华方程中的压力指理想气体的压力,体积是理想气体的体积。
5.()对于任何纯物质而言,熔点总比凝固点高一些。
6.()水的三相点就是水的冰点。
7.()通常指的沸点是蒸气压等于外界压力时液体的温度。
8.()三相点是固体、液体和气体可以平衡共存时的温度和压力。
9.()临界温度越高的物质,越容易液化。
10.()高于临界温度时,无论如何加压,气体都不能液化。
11.()任何纯净物质都具有一个三相点。
12.()混合气体中,某组分气体的分压力与其物质的量的大小成正比。
13.()气体扩散定律指出:同温同压下气体的扩散速度与其密度成反比。
14.()单独降温可以使气体液化;单独加压则不一定能使气体液化。
15.()使气体液化所需要的最低压强,称为临界压强。
16.()气体的最几速率、平均速率和均方根速率中以最几速率数值最大。
17.()气体的最几速率、平均速率和均方根速率中以平均速率数值最大。
18.()气体的最几速率、平均速率和均方根速率中以均方根速率数值最大。
19.()气体的最几速率、平均速率和均方根速率中以最几速率分子数最多。
20.()气体的最几速率、平均速率和均方根速率中以平均速率分子数最多。
21.()气体的最几速率、平均速率和均方根速率中以均方根速率分子数最多。
22.()液体的蒸发速度与液面面积有关,液面面积越大,蒸发速度也越大。
23.()凝聚和蒸发的过程是分别独立进行的,两者之间没有直接的定量关系。
24.()液体的饱和蒸气压仅与液体的本质和温度有关,与液体的量和液面上方空间的体积大小无关。
25.()若液体的蒸气压为p,实验证明lg p与绝对温度T成直线关系。

化学反应中原子轨道的重叠与反应活性一、原子轨道的重叠1.原子轨道的概念:原子轨道是描述原子内部电子运动轨迹的数学函数,它是一种概率分布。
2.原子轨道的重叠类型:a)s轨道重叠:s轨道重叠形成s-sσ键,如H2分子中的氢原子之间的重叠。
b)p轨道重叠:p轨道重叠形成p-pσ键,如CH4分子中的碳原子与氢原子之间的重叠。
c)d轨道重叠:d轨道重叠形成d-dσ键,如Fe2O3中的铁原子之间的重叠。
d)π键的形成:p轨道侧向重叠形成π键,如C2H4分子中碳原子之间的重叠。
二、反应活性与原子轨道的重叠1.反应活性与键能的关系:键能越高,化学键越稳定,反应活性越低。
键能与原子轨道的重叠程度有关。
2.重叠程度与反应活性的关系:a)σ键重叠:σ键重叠程度越大,键能越高,反应活性越低。
b)π键重叠:π键重叠程度越大,键能越高,反应活性越低。
3.影响原子轨道重叠程度的因素:a)原子大小:原子半径越小,原子轨道重叠程度越大。
b)原子电负性:电负性越大,原子轨道重叠程度越大。
c)原子价层电子数:价层电子数越多,原子轨道重叠程度越大。
4.反应活性与分子结构的关系:分子结构中,键的类型、键长、键角等因素都会影响原子轨道的重叠程度,进而影响分子的反应活性。
化学反应中原子轨道的重叠与反应活性密切相关,σ键和π键的重叠程度影响键能的高低,进而影响分子的反应活性。
掌握原子轨道重叠的类型和影响因素,有助于理解分子的结构与性质,为研究化学反应 mechanism 提供理论依据。
习题及方法:1.习题:H2分子中的氢原子之间的键是什么类型的键?解题方法:根据知识点,H2分子中的氢原子之间的键是s-sσ键。
答案:s-sσ键。
2.习题:CH4分子中的碳原子与氢原子之间的键是什么类型的键?解题方法:根据知识点,CH4分子中的碳原子与氢原子之间的键是p-pσ键。
答案:p-pσ键。
3.习题:Fe2O3中的铁原子之间的键是什么类型的键?解题方法:根据知识点,Fe2O3中的铁原子之间的键是d-dσ键。

物理化学知识点物理化学知识点概述1. 热力学定律- 第零定律:如果两个系统分别与第三个系统处于热平衡状态,那么这两个系统之间也处于热平衡状态。
- 第一定律:能量守恒,系统内能量的变化等于热量与功的和。
- 第二定律:熵增原理,自然过程中熵总是倾向于增加。
- 第三定律:当温度趋近于绝对零度时,所有纯净物质的熵趋近于一个常数。
2. 状态方程- 理想气体状态方程:PV = nRT,其中P是压强,V是体积,n是摩尔数,R是理想气体常数,T是温度。
- 范德瓦尔斯方程:(P + a(n/V)^2)(V - nb) = nRT,修正了理想气体状态方程在高压和低温下的不足。
3. 相平衡与相图- 相律:描述不同相态之间平衡关系的数学表达。
- 相图:例如,水的相图展示了水在不同温度和压强下的固态、液态和气态的平衡关系。
4. 化学平衡- 反应速率:化学反应进行的速度,受温度、浓度、催化剂等因素影响。
- 化学平衡常数:在一定温度下,反应物和生成物浓度之比达到平衡时的常数值。
5. 电化学- 电解质:在溶液中能够产生带电粒子(离子)的物质。
- 电池:将化学能转换为电能的装置。
- 电化学系列:金属的还原性或氧化性排序。
6. 表面与胶体化学- 表面张力:液体表面分子间的相互吸引力。
- 胶体:粒子大小在1到1000纳米之间的混合物,具有特殊的表面性质。
7. 量子化学- 量子力学基础:描述微观粒子如原子、分子的行为。
- 分子轨道理论:通过分子轨道来描述分子的结构和性质。
- 电子能级:原子和分子中电子的能量状态。
8. 光谱学- 吸收光谱:分子吸收特定波长的光能,导致电子能级跃迁。
- 发射线谱:原子或分子在电子能级跃迁时发出特定波长的光。
- 核磁共振(NMR):利用核磁共振现象来研究分子结构。
9. 统计热力学- 微观状态与宏观状态:通过系统可能的微观状态数来解释宏观热力学性质。
- 玻尔兹曼分布:描述在给定温度下,粒子在不同能量状态上的分布。


高中化学知识点总结(最全版)
化学是一门研究物质组成、性质和变化规律的科学。
下面是高中化学的知识点总结,涵盖了各个方面的内容。
1. 原子结构
- 元素、原子、分子的概念
- 电子结构:电子云模型、能级概念、电子排布规则
2. 化学键
- 离子键、共价键、金属键的概念
- 杂化轨道和化学键的形成
- 分子轨道理论
3. 物质的量和化学反应
- 摩尔概念和摩尔质量
- 化学方程式、平衡常数和速率常数
- 反应速率和速率方程
4. 酸碱和盐
- 酸碱理论:Arrhenius理论、Brønsted-Lowry理论- 中和反应和盐的生成
- 强酸强碱的性质
5. 氧化还原反应
- 氧化还原的概念和电子转移
- 氧化剂和还原剂的判别
- 电化学和电池的原理
6. 化学平衡
- 平衡的定义和特征
- 平衡常数和Le Chatelier原理
- 溶液的酸碱平衡和氧化还原平衡
7. 溶液和溶解性
- 溶液的组成和分类
- 溶解度和溶解过程
- 饱和溶液和溶解度曲线
8. 化学反应速率
- 反应速率的实验测定
- 影响反应速率的因素
- 反应速率与能量变化的关系
9. 高能化合物
- 化学能和反应热
- 燃烧反应和燃烧热
- 异常热效应和热力学定律
这些是高中化学的核心知识点总结,希望对你的研究有所帮助。
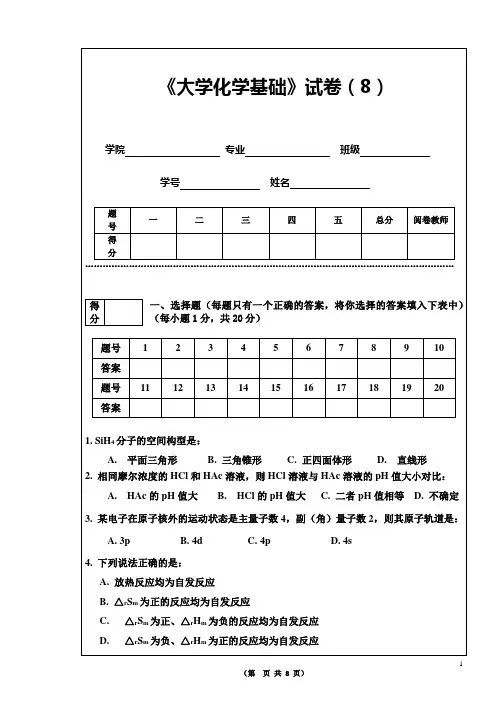
《大学化学基础》试卷(8)学院 专业 班级学号 姓名题 号 一 二 三 四 五 总分 阅卷教师得 分………………………………………………………………………………………………………………一、选择题(每题只有一个正确的答案,将你选择的答案填入下表中)(每小题1分,共20分) 题号 1 2 3 4 5 6 7 8 9 10 答案 题号 11 12 13 14 15 16 17 18 19 20 答案1. SiH 4分子的空间构型是:A. 平面三角形B. 三角锥形C. 正四面体形D. 直线形 2. 相同摩尔浓度的HCl 和HAc 溶液,则HCl 溶液与HAc 溶液的pH 值大小对比:A. HAc 的pH 值大B. HCl 的pH 值大C. 二者pH 值相等D. 不确定 3. 某电子在原子核外的运动状态是主量子数4,副(角)量子数2,则其原子轨道是:A. 3pB. 4dC. 4pD. 4s 4. 下列说法正确的是: A. 放热反应均为自发反应 B. △r S m 为正的反应均为自发反应 C. △r S m 为正、△r H m 为负的反应均为自发反应 得 分5. 下列各物质中不存在氢键的分子是:A. NH3B. CH4C. 邻硝基苯酚D. HNO36.已知:(1)CoO(s)+CO(g)= Co(s)+CO2(g),K(2)CO2(g)+H2(g) = CO(g)+H2O(l),K(3)H2O(l) = H2O(g),K则反应CoO(s)+H2(g)=Co(s)+H2O(g)的平衡常数为:A. K K/KB. K K KC. K K/KD. K/K K7. BaCO3能溶于盐酸的最合理解释是:A. BaCO3的K spθ较大;B. BaCO3在水中的溶解度较大;C. 能反应生成CO2气体离开系统,使溶解平衡发生移动;D. BaCO3的K spθ较小;8. 根据分子轨道理论下列物质中不可能存在的是:A. Li2B. B2C. C2D. He29. 下列各项条件改变中,能引起化学反应的标准平衡常数数值改变的是:A. 压力改变;B. 催化剂更换;C. 温度改变;D. 容器的体积改变;10.下列氧化剂中,当其溶液的H+浓度增大时,氧化性增强的是:A. KClO3B. Br2C. FeCl3D. F211. 按配合物的价键理论,配合物中中心原子与配体之间的结合力为A. 离子键B. 配位键C. 氢键D. 正常共价键12. 下列物理量值的大小与化学反应方程式的写法无关的是:A. △r H mB. △r S mC. E(电池电动势)D. △r G m13.下列电对中,Eθ值最小的是:A. H+/H2B. H2O/H2C. HOAc/H2D. HF/H214、欲使AgCl溶解,可加入:A. NH3·H2OB. HClC. NaOHD. NaCl15.具有下列各组量子数的电子能量最高的是:A. 4,2,0,-1/2B. 4,3,1,+ 1/2C. 3,2,1,-1/2D. 3,2,0,+1/2A. K a/2B.KaC 21 C.2/KaC D. C/217. 下列描述中正确的是:A. 因为电对Ni 2++2eNi 的ϕӨ为–0.23 V ,所以2Ni 2++4e2Ni 的ϕӨ为–0.46 VB. 在氧化还原反应中,若两个电对的E θ值相差越大,则反应进行得越快C. 含氧酸根的氧化能力通常随溶液的pH 值减小而增强D. 由于E θ(Fe 2+/Fe)=-0.440V , E θ(Fe 3+/Fe 2+)=0.771V , 故Fe 3+与Fe 2+能发生氧化还原反应18.往1dm 3浓度为0.10 mol·dm -3HAc 溶液中加入一些NaAc 晶体并使之溶解,会发生的情况是:A. HAc 的K a 值增大B. HAc 的K a 值减小C. 溶液的pH 值增大D. 溶液的pH 值减小 19.关于铜、锌和稀硫酸构成的原电池,叙述错误的是:A. 锌是负极B. 铜是正极C. 电子由锌片经导线流入铜片D. 电子由锌片经硫酸溶液流入铜片 20. 某容器中加入相同物质的量的HCl 和O 2,在一定温度下发生反应: 4HCl(g)+O 2(g)2Cl 2(g)+2H 2O(g),平衡时,下列关系正确的是:A. p (HCl)>p (O 2)B. p (HCl)<p (O 2)C. p (HCl)=p (O 2)D. p (HCl)=p (Cl 2)二、是非判断题(判断下列叙述是否正确,正确的画√,错误的画×,请将答案填入下表中) (每小题1分,共10分) 题号 1 2 3 4 5 6 7 8 9 10 答案1. 凡含有极性键的分子都是极性分子。


基础化学试卷(14)一、填空题1.产生渗透现象的条件是:①,②。
2.最外层电子组态为5s25p4的元素处在元素周期表的区第周期族原子序数为。
3.热力学第一定律的数学表达式为。
4.用强碱滴定强酸时,滴定曲线的突跃范围大小与有关。
5.根据酸碱质子理论,酸碱反应的实质是;而氧化还原反应的实质是。
6.配制HCl标准溶液只能用间接法配制而不能采用直接法配制,其原因是。
7.血浆中主要的缓冲系有、、和。
8.对电极反应Hg2Cl2 + 2e 2Hg + 2Cl-,298K时,若将氯离子浓度提高10倍,电极电位将改变V。
9.影响电对的电极电位的因素有、、和。
10.电对的电极电位值越小,说明电对中的能力越强;电对的电极电位值越大,说明电对中的能力越强。
11.24Cr的电子排布式是;29Cu的电子排布式是。
12.当n = 3时,原子共有个原子轨道;n = 3、l = 1的原子轨道在空间有种不同的取向。
13.多电子原子中的电子在核外的排布遵循原理、原理和_________规则。
14.[PtCl2(NH3)2]的名称是;氯化·二氯·二(乙二胺)合钴(Ⅲ)的化学式为。
15.朗伯-比尔定律的数学表达式为A = ab c,其中符号c代表_________,b代表_________,a代表_________。
当c =1mol·L-1、b =1cm时,则a以符号_________表示,并称为______。
二、选择题(每题只有1个正确答案)1.分子轨道理论中,原子轨道线性组合成分子轨道应遵循的首要原则是( )A.对称性匹配原则B.能量最低原则C.能量近似原则D.Hund规则E.Pauli不相容原理2.下列化合物中,能与中心原子形成五员环螯合物的是( )A. NH2NH2B. NH2CH2NH2C.NH2CH2CH2NH2D.NH2CH2CH2CH2NH23.下列哪个金属离子在八面体弱场中的单电子数n = 4,而在八面体强场中的单电子数n = 0?( )A.Mn2+B.Ni2+C.Fe2+D.Cr2+E.Co2+ 4.已知某原子中5个电子的量子数分别为( )① 3,2,1,-1/2 ② 2,1,1,-1/2 ③ 2,1,0,1/2④ 2,0,0,-1/2 ⑤ 3,1,1,-1/2这5个电子的能量大小是A.④>③=②>⑤>①B.①>⑤>②=③>④C.①>⑤>②>③>④D.①=⑤>②=③>④E.④>③=②>①=⑤5.欲使Mg(OH)2的溶解度降低,最好加入下列哪种物质? ( ) A.NaOH B.Fe(OH)3C.H2O D.HCl E.H2SO4 6.某溶液加入甲基红指示剂呈黄色,加入酚酞指示剂呈无色,若需稳定此pH,加入的缓冲溶液是( )A.HAc—NaAc(p K a= 4.75)B.Na2HPO4—Na3PO4(p K a3 = 12.67)C.H2CO3—HCO3-(p K a= 6.35)D.H3PO4—NaH2PO4(p K a1 = 2.12)E.NH4+—NH3(p K a= 9.25)7.pH玻璃电极的电极电位与被测H+离子的活度(浓度)之间的关系是( ) A.成正比B.成反比C.无定量关系D.恒定不变E.符合Nernst 方程式8.将FeCl3溶液慢慢滴到沸水中制备Fe(OH)3溶胶,Fe(OH)3溶胶的胶团结构为( )A.{[Fe(OH)3]m·n Fe3+·(n-x)OH-}x+·x OH-B.{[Fe(OH)3]m·n Fe3+·(n-x)Cl-}x+·x Cl-C.{[Fe(OH)3]m·n FeO+·(n-x)Cl-}x+·x Cl-D.{[Fe(OH)3]m·n OH-·(n-x)FeO+}x-·x FeO+E.{[Fe(OH)3]m·n Cl-·(n-x)FeO+}x-·x FeO+9.关于电负性,下列说法错误的是( )A.电负性是指元素的原子在分子中吸引电子能力的相对大小B.电负性越大,原子在分子中吸引电子的能力越大C.同一周期的元素,从左到右电负性递增D.同一主族的元素,从上到下电负性递减E.同一副族的元素,从上到下电负性递减10.不会使红细胞发生溶血和皱缩的溶液是( )A.18 g·L-1 NaCl溶液B.9 g·L-1 NaCl溶液加10倍体积水的混合液C.150 mmol·L-1 NaCl溶液与50g·L-1葡萄糖溶液的等体积混合液D.100 g·L-1葡萄糖溶液加3倍水的混合液E.9 g·L-1 NaCl溶液与200 mmol葡萄糖溶液的等体积混合11.某金属离子M2+的价层电子组态为3d10,其在周期表中位置为( ) A.Ⅷ族,d区,第三周期B.ⅡB族,ds区,第三周期C.ⅡB族,ds区,第四周期D.ⅡA族,s区,第三周期E.ⅡA族,s区,第四周期12.ξ电势的大小可以判断( )A.胶粒电泳的方向B.胶凝的速度C.溶胶聚沉的难易D.渗透压的大小E.电渗的方向13.人血清白蛋白的等电点(pI)是4.64,将其置于pH=3.0的缓冲溶液中,下列说法正确的是( )A.人血清白蛋白带负电,在外电场作用下向正极移动B.人血清白蛋白带正电,在外电场作用下向负极移动C.人血清白蛋白不带电,在外电场作用下不发生泳动D.要使人血清白蛋白带负电,需滴加强酸,使溶液pH<pIE.要使人血清白蛋白带正电,需滴加强碱,使溶液pH>pI14.已知[Ni(CN)4]2-的中心原子采取dsp2杂化,由此可知该配合物的空间构型是( )A.正四面体B.平面正方形C.三角双锥D.正八面体E.四方锥15.正常人血液中,H2CO3—HCO3-缓冲系的缓冲比为( )A.10 : 1 B.1 : 10 C.1 : 1 D. 1 : 20 E.20 : 1 16.下列几个与分光光度法有关的仪器参数或物质性质中,哪一个数值越大时,测定灵敏度越高?( )A.I0B.I t C.T D.κE.c 17.取0.20 mol·L-1 NaH2PO4与0.20 mol·L-1Na2HPO4等体积混合(H3PO4的p K a1 = 2.12,p K a2 = 7.21,p K a3 = 12.32),此溶液的pH值约为( )A. 2.12B. 7.21C. 12.32D. 1.68E. 8.2118. 欲较精确地测蛋白质的相对分子质量,最合适的测定方法是( ) A.蒸气压下降法B.凝固点降低法C.沸点升高法D.渗透压法E.凝固点升高法19. 下列配合物中命名正确的是( )A.[CoCl2(NH3)4]Cl 氯化四氨·二氯·合钴(Ⅲ)B.K[Co(NO2)4(NH3)2] 二氨·四硝基合钴(Ⅲ)酸钾C.[CoCl2(NH3)2(H2O)2]Cl 氯化二氯·二氨·二水合钴(Ⅲ)D.[Co(NO2)2(en)2]Cl 氯化二(乙二胺)·二硝基合钴(Ⅲ)E.[CoCl3(H2O)3] 三水·三氯合钴(Ⅲ)20.决定缓冲溶液pH值的主要因素是( )A.弱酸的p K a和总浓度B.弱酸的p K a和缓冲比C.缓冲溶液的总浓度和缓冲比D.弱酸的p K a和共轭碱的p K bE.共轭碱的p K b和总浓度21.已知Pt的价层电子组态为5d96s1, 抗癌药[PtCl2(OH)2]2-配离子有两种异构体, 则中心原子Pt所采取的杂化方式是( )A.sp3杂化B.dsp2杂化C.sp3d2杂化D.d2sp3杂化E.sp杂化22.加入催化剂,反应速率加快,其原因是( )A.活化分子百分数增加B.活化分子数增加C.活化能降低D.(A+B) E.(A+B+C)23.关于氢键,下列说法错误的是( )A.氢键不仅可在分子间形成,也可在同一分子内形成B.氢键的形成对物质的溶解度有一定的影响C.氢键具有方向性与饱和性D.分子间氢键的形成一般使物质的熔、沸点升高E.分子内氢键的形成一般使物质的熔、沸点升高24.可用下列哪一种方法减小分析结果中的偶然误差?( )A.进行空白试验B.进行对照试验C.进行仪器校正D.进行分析结果的校正E.增加平行试验的次数25.人体中最重要的抗酸成分是( )A.H2PO4-B.HPO42-C.H2CO3D.HCO3-E.H n-1P-26. 0.010 mol·L-1 Na2SO4溶液与0.20 mol·L-1KNO3等体积混合后,溶液的离子强度是( )A.0.115 B.0.23 C.0.345 D.0.103 E.0.045 27.根据晶体场理论,高自旋配合物的理论判据是( )A.分裂能=电子成对能 B.分裂能<电子成对能C.分裂能>电子成对能D.分裂能>成键能E.分裂能<成键能]3-的Δo< P,那么该中心原子d电子的排布式是( ) 28.已知配合物[CoF6A. dε5dγ1B. dε6dγ1C. dε4dγ3D. dε3dγ3E. dε4dγ229.在Lambert-Beer 定律中,吸光系数与下列何种因素无关?( )A. 物质种类B. 入射光波长C. 入射光强度D. 物质的量浓度E. 溶剂种类30.在酸碱滴定中,选择指示剂应考虑( )A. 滴定突跃范围B. 指示剂的变色范围C. 变色点D. (A+B)E. (A+B+C)31.在下列电极反应中,溶液的pH值降低,其氧化态的氧化能力增强的是( )A.Br2 + 2e 2Br-B.Cl2 + 2e2Cl-C.MnO4- + 8H+ + 5e-Mn2+ + 4H2OD.Fe3+ + e Fe3+ E.MnO4- + e MnO42-32.下列关于维持血液pH值基本不变的说法,错误的是( )A.血液中存在多种缓冲系B.肺的生理调节作用C.肾的生理调节功能D.红细胞中存在多种缓冲系E.人体代谢产物往往是中性物质33.下列各种物质的浓度(以该分子式为基本单元)均为0.1 mol·L-1,不能被0.1 mol·L-1 HCl 滴定的是( )A.Na3PO4 (H3PO4的K a1 = 7.52×10-3,K a2 = 6.23×10-8,K a3 = 2.2×10-13)B.Na2C2O4 (H2C2O4的K a1 = 5.89×10-2,K a2 = 6.46×10-5)C.C6H5COONa(C6H5COOH的K a = 6.46×10-5)D.Na2CO3 (H2CO3的K a1 = 4.46×10-7,K a2 = 4.68×10-11)E.NH3·H2O(K b = 1.76×10-5)34.已知某反应的反应式为:A + 2B = D,则其速率方程式为υ= ( ) A. kc(A)c2(B) B. kc(A) c2(B)/ c(D) C. k c(D)/ c(A) c2(B)D. kc (D)E. 不能确定35.For the reaction of the first, the second or zero order, the half-life is( ) A. concerned with k B. concerned with c0 C. concerned with k and c0D. not concerned with kE. not concerned with c036.When sodium chloride is added to the saturated solution of AgCl, the solubility of AgCl would ( )A. increase slightly.B. increase greatly.C. decrease slightly.D. decrease greatly.E. unchange.37.Which of the following molecules has the strongest electric dipole moment?( )A .NH 3B .BF 3C .PCl 5D .SiF 4E .SF 6三、是非题(对者打√,错者打×)1.在滴定分析中有了高精密度的实验数据,一定有高准确度的分析结果。

分子轨道理论1. 引言分子轨道理论是化学中的一种重要理论,它用量子力学的原理解释了分子的电子结构和化学性质。
本文将介绍分子轨道理论的基本概念、应用以及相关的计算方法。
2. 基本概念2.1 原子轨道在分子轨道理论中,首先要了解的是原子轨道。
原子轨道是描述单个原子中电子运动的波函数。
根据量子力学的原理,一个原子可以存在多个不同的原子轨道,每个原子轨道都对应着不同的能量状态。
2.2 分子轨道当两个或更多个原子靠近形成化学键时,原子轨道会互相重叠,形成新的分子轨道。
分子轨道描述的是电子在整个分子中的运动状态。
根据分子轨道理论,分子轨道可以分为两类:成键分子轨道和反键分子轨道。
成键分子轨道对应着电子的主要分布区域,而反键分子轨道则对应着电子分布相对较少的区域。
2.3 分子轨道能级分子轨道能级与原子轨道能级类似,分子轨道的能量随着轨道的能级增加而增加。
有时,分子轨道能级之间会有一定的能隙,这种能隙反映了分子稳定性的特征。
3. 分子轨道的应用分子轨道理论可以解释大量的化学现象和性质,下面列举了几个常见的应用:3.1 化学键的形成分子轨道理论提供了解释化学键产生的机制。
当两个原子靠近并形成化学键时,原子轨道会发生线性组合形成分子轨道。
通过分子轨道理论,我们可以理解不同类型的化学键(如共价键、离子键和金属键)是如何形成的以及其性质的差异。
3.2 分子轨道的能级顺序分子轨道理论还可以预测分子轨道的能级顺序,从而解释分子的化学性质。
能级较低的分子轨道通常具有较高的稳定性,从而决定了分子的化学反应性质。
3.3 分子光谱在分子光谱中,分子轨道理论被广泛应用。
分子轨道理论可以解释分子在吸收或发射光的过程中所发生的能级跃迁,从而解释不同光信号的产生和分子结构的变化。
4. 分子轨道的计算方法4.1 原子轨道模型著名的原子轨道计算方法包括Hartree-Fock方法和密度泛函理论。
这些方法通过求解原子的薛定谔方程,得到原子轨道及其能量。
分析化学试题一、选择题(每题1.5分,共24分)1.在滴定分析中,对其化学反应的主要要求是:A.反应必须定量完成 B.反应必须有颜色变化C.滴定剂与被测物必须是1:1反应 D.滴定剂必须是基准物2.实验室中使用铂坩埚时,要尽量避免使用:A.热氢氟酸 B.浓热高氯酸 C.浓热硫磷混酸 D.碳酸钠熔融3.消除分析方法中存在的系统误差,可以采用的方法是:A.增大试样称量质量 B.用两组测量数据对照C.增加测定次数 D.进行仪器校准4.在以下各类滴定中,当滴定剂与被滴物质均增大10倍时,滴定突跃范围增大最多的是:A.NaOH滴定Hac B.EDTA滴定Ca2+ C.K2Cr2O7滴定Fe2+D.AgNO3滴定CI-5.从溶液中沉淀A12O3·nH2O时,应该:A.在较稀溶液中进行沉淀B.加入大量电解质C.沉淀完成后陈化一段时间D.沉淀时不能搅拌6.在pH为10.0的氨性溶液中,己知αZn(NH3)=104.7,αZn(OH)=102.4,αY(H)=100.5。
在此条件下,lg K’ZnY为(己知lg K ZnY=16.5)A. 8.9 B. 11.8 C. 14.3 D. 11.37.对配位反应中的条件稳定常数,正确的叙述是:A.条件稳定常数是实验条件下的实际稳定常数B.酸效应系数并不总是使条件稳定常数减小C.所有的副反应均使条件稳定常数减小D.条件稳定常数与配位滴定突跃无关8.在Mohr法中用标准CI-测定Ag+时不适合用直接滴定法,是由于A.AgCl的溶解度太大 B.AgCl强烈吸附Ag+离子C.Ag2CrO4转化为AgCI的速度太慢D.Ag+离子容易水解9.在氧化还原滴定中用K2Cr2O7标定Na2S2O3时,如果接近终点时加入Na2S2O3溶液速度较快,将会使标出的Na2S2O3溶液浓度:A.偏高 B.准确C.视使用的指示剂而定 D.偏低10.配位滴定中用EDTA滴定Bi3+时,消除Fe3+干扰应采用:A.加NaOHB.加抗坏血酸C.加三乙醇胺D.加KCN11.对标准缓冲溶液pH值的计算,正确的说法是A.一般不能计算,只能由实验值得到B.计算时一定要用精确式C.计算时必须考虑离子强度的影响D.根据缓冲范围决定计算公式12.以下实验中不存在操作错误的是:A.滴定分析时指示剂在化学计量点前变色B.KMnO4法测钙时,直接用蒸馏水洗涤CaC2O4沉淀C.称样时砝码数值记错D.配制K2Cr2O7标准溶液时,在容量瓶中加水稀释混合均匀后发现未到刻度线,补加蒸馏水至刻度线。
化学中的物理化学与化学物理化学中的物理化学与化学物理是研究物质的性质、状态变化以及化学反应过程中能量变化和转换规律的科学。
它既涉及到物理学的理论基础,又与化学的实际应用紧密相连。
以下是这一学科领域的核心知识点:1.物质的量与状态:研究物质的量的概念,包括摩尔、摩尔质量等;以及物质的气、液、固三态变化及其规律。
2.热力学基础:包括能量守恒定律、热力学第一定律(内能的变化)、热力学第二定律(熵的概念及其在化学中的应用)。
3.化学动力学:研究化学反应速率、化学平衡、反应机理以及影响反应速率的因素。
4.电化学:探究原电池、电解池的原理,电镀、腐蚀等电化学现象及其应用。
5.物质结构:涉及原子、分子、离子晶体的结构理论,以及它们对物质性质的影响。
6.相平衡:研究不同相之间的平衡关系,包括杠杆法则、相图等。
7.溶液理论:溶液的组成、浓度表示方法、溶液的稀释与浓缩、离子积理论、盐类的水解。
8.胶体与界面化学:胶体的性质、胶体的稳定性和聚沉、表面活性剂的作用以及界面现象。
9.化学键与分子轨道理论:不同类型的化学键(离子键、共价键、金属键),以及分子轨道理论的基本概念。
10.量子化学基础:量子力学在化学中的应用,如原子轨道、分子轨道的概念,以及它们在化学键理论中的应用。
11.化学信息学:化学信息的收集、处理、储存和传递,化学数据库的使用。
12.绿色化学:介绍可持续化学原理,包括反应设计、过程优化、原子经济性等。
13.化学实验技能:实验基本操作、实验数据的处理与分析、实验安全等。
以上知识点遵循中学生发展需求和教材内容,旨在为学生构建坚实的化学基础,并激发他们对化学科学的兴趣和探究精神。
习题及方法:1.知识点:物质的量与状态习题:1摩尔的氧气在标准状况下的体积是多少?解题方法:使用理想气体状态方程PV=nRT,其中P为压强(标准大气压),V为体积,n为物质的量(1摩尔),R为理想气体常数,T为温度(标准温度)。
解得V=22.4L。
1.离子晶体中的化学键都是离子键。
()1.错2.CO 分子含有配位键。
()2.对3.所有分子的共价键都具有饱和性与方向性,而离子键没有饱和性与方向性。
()3.错4. 中心原子所形成的杂化轨道数等于参加杂化的原子轨道数。
()4.对5. 原子轨道发生杂化后可以增强成键能力。
()5.对6. 杂化轨道具有能量相等、空间伸展方向一定的特征。
()6.对7. 凡是中心原子采取sp3杂化轨道成键的分子,其空间构型都是正四面体。
()7.错8. 在任何情况下,每一个sp2杂化轨道所含的s、p成分均相同。
()8.错9. 由分子轨道理论可推知 O2-、O22-都比 O2稳定。
()9.错10. 按照分子轨道理论,N2+和 N2-的键级相等。
()10.对11. 色散力存在于一切分子之间。
()11.对12. 弱极性分子之间的分子间力均以色散力为主。
()12.对13. 氢键只存在于 NH3、H2O、HF 的分子之间,其它分子间不存在氢键。
()13.错14. 根据价层电子对互斥理论,分子或离子的空间构型取决于中心原子的价层电子对数。
()14.对15. 对 AB m型分子 ( 或离子 ) 来说,当中心原子 A 的价电子对数为 m 时,分子的空间构型与电子对在空间的构型一致。
()15.对16. AsF5是三角双锥形分子。
()16.错17. SO42-、ClO4-、PO43-的空间构型相同。
()17.对18. 下列化合物中既有离子键又有共价键和配位键的是()。
18.D(A) KF; (B) H2SO4; (C) CuCl2; (D) NH4NO3。
19. 关于离子键的本性,下列叙述中正确的是()。
19.D(A) 主要是由于原子轨道的重叠; (B) 由一个原子提供成对共用电子;(C) 两个离子之间瞬时偶极的相互作用; (D) 正、负离子之间的静电吸引为主的作用力。
20. 下列各组卤化物中,离子键成分大小顺序正确的是()。
20.A(A) CsF > RbCl > KBr > NaI;(B) CsF > RbBr > KCl > NaF;(C) RbBr > CsI > NaF > KCl;(D) KCl > NaF > CsI > RbBr。
分子轨道理论简介一种化学键理论,是原子轨道理论对分子的自然推广。
其基本观点是:物理上存在单个电子的自身行为,只受分子中的原子核和其他电子平均场的作用,以及泡利不相容原理的制约;数学上则企图将难解的多电子运动方程简化为单电子方程处理。
因此,分子轨道理论是一种以单电子近似为基础的化学键理论。
描写单电子行为的波函数称轨道(或轨函),所对应的单电子能量称能级。
对于任何分子,如果求得了它的系列分子轨道和能级,就可以像讨论原子结构那样讨论分子结构,并联系到分子性质的系统解释。
有时,即便根据用粗糙的计算方案所得到的部分近似分子轨道和能级,也能分析出很有用处的定性结果。
理论⒈原子在形成分子时,所有电子都有贡献,分子中的电子不再从属于某个原子,而是在整个分子空间范围内运动。
在分子中电子的空间运动状态可用相应的分子轨道波函数ψ(称为分子轨道)来描述。
分子轨道和原子轨道的主要区别在于:⑴在原子中,电子的运动只受1个原子核的作用,原子轨道是单核系统;而在分子中,电子则在所有原子核势场作用下运动,分子轨道是多核系统。
分子轨道理论⑵原子轨道的名称用s、p、d…符号表示,而分子轨道的名称则相应地用σ、π、δ…符号表示。
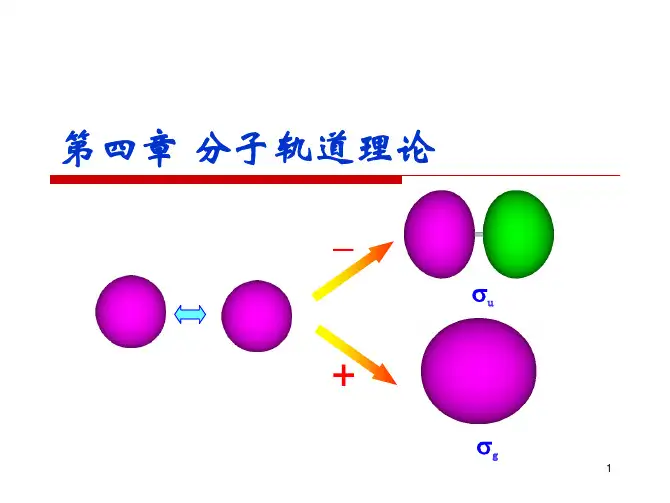
⒉分子轨道可以由分子中原子轨道波函数的线性组合(linearcombinationofatomicorbitals,LCAO)而得到。
有几个原子轨道就可以可组合成几个分子轨道,其中有一部分分子轨道分别由对称性匹配的两个原子轨道叠加而成,两核间电子的概率密度增大,其能量较原来的原子轨道能量低,有利于成键,称为成键分子轨道(bondingmolecularorbital),如σ、π轨道(轴对称轨道);同时这些对称性匹配的两个原子轨道也会相减形成另一种分子轨道,结果是两核间电子的概率密度很小,其能量较原来的原子轨道能量高,不利于成键,称为反键分子轨道(antibondingmolecularorbital),如σ*、π*轨道(镜面对称轨道,反键轨道的符号上常加"*"以与成键轨道区别)。