(衡水金卷)2018年普通高等学校招生全国统一考试模拟化学试题二
- 格式:doc
- 大小:262.50 KB
- 文档页数:8

2018年高考仿真模拟化学试题新课标全国卷(二)答案(word版可编辑修改) 编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望(2018年高考仿真模拟化学试题新课标全国卷(二)答案(word版可编辑修改))的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为2018年高考仿真模拟化学试题新课标全国卷(二)答案(word版可编辑修改)的全部内容。
2018年高考仿真模拟试题(新课标全国卷)化学(二)答案1.D【解析】地沟油属于酯类,遇氢氧化钠溶液水解,但是不分层,矿物油是烃的混合物,与氢氧化钠溶液不反应,分层,A正确;光导纤维的主要成分是二氧化硅,二氧化硅能与碱反应,B正确;氢能、太阳能都为清洁能源,无污染,C正确;铝与氧化铁反应虽然在高温下进行,但为放热反应,D错误。
2.C【解析】常温下,碳与浓硝酸不反应,A不符合题意;SiO2与HF反应得到的SiF4不是盐,故SiO2不是碱性氧化物,是酸性氧化物,B不符合题意;新制的氯水中含有的次氯酸具有漂白性,能使蓝色石蕊试纸变白,C符合题意;SO2可使滴加酚酞的NaOH溶液褪色是因为SO2是酸性气体,D不符合题意.3.C【解析】该有机物中含有醇羟基、碳碳双键,A正确;该有机物中含有碳碳双键,可以使酸性高锰酸钾溶液褪色,B正确;1 mol该有机物与1 mol HBr发生加成反应生成的产物有4种,C错误;该有机物中含有碳碳双键,可以发生加聚反应,含有—CH2OH,可以发生催化氧化反应,D正确。
4.B【解析】由Y、Z的单质之间的反应及题干信息可知,Y为O,Z为Na,由X、W均能形成含氧强酸知,X是N,W是S或Cl。

7.化学与生产和生活密切相关,下列说法不正确的是()A.钢铁在潮湿的空气中更容易生锈,其主要原因是形成了原电池B.从海带、海藻中提取碘单质必须通过化学反应才能实现C.用纳米铁粉除去污水中的Cu2+、Hg2+等重金属离子是利用了铁的还原性D.一次性纸杯的内层材料主要成分是聚氯乙烯8.以Al2O3为原料(含杂质Fe2O3)制备药品级的氢氧化铝的一种工艺流程如下,下列说法不正确的是()A.操作Ⅰ中用到的玻璃仪器有漏斗、烧杯、玻璃棒B.NaHCO3溶液可用足量氨水代替C.碱溶过程中发生反应的离子方程式为Al2O3+2OH-=2AlO2-+H2OD.加入NaHCO3溶液发生反应的离子方程式为AlO2-+HCO3-+H2O=Al(OH)3↓+CO32-9.已知甲在一定条件下可转化为乙和丙,转化关系如图所示,下列说法正确的是()A.丙与是同分异构体B.丙与乙酸是同系物C.乙中所有碳原子一定位于同一平面上D.丙能发生加聚反应、取代反应和氧化反应10.25℃时,在一体积为10 L的绝热密闭容器中充入1molH2与1moI2(g),反应中能量变化曲线如图所示。
测得平衡时H2的物质的量为0.5mol,已知H-H键的键能为436kJ·mol-1,I-I键的键能为151 kJ·mol-1,H-I键的键能为b kJ·mol-1。
下列说法不正确的是()A.25℃时.反应H2(g)+I2(g)2HI(g)的平衡常数K=4B.当容器中压强保持不变时,H2(g)+I2(g)2HI(g)达到平衡状态C.b=299D.H2(g)+I2(g)2HI(l) △H=(a-11) kJ·mol-111.设N A为阿伏加德罗常数的值,下列叙述正确的是()A.将1molFe 与足量碘加热反应,转移电子数目为3N AB.84g溶有聚乙烯的环已烷中含有的C-H键数目小于12N AC.标准状况下,11.2 LCH3Cl所含的分子数目为0.5N AD.1L0.5mol·L-1的Na2S溶液中,阳离子与阴离子数目之和为1.5N A12.下表中,陈述Ⅰ、Ⅱ均正确,并且两者之间具有因果关系的是()13.常温下,向2 0mL0.1 mol·L-1的Na2CO3溶液中逐滴加入40mL0.1 mol·L-1的盐酸,溶液的pH逐渐降低,下列说法确的是()A.完全反应后.溶液呈中性B.当加入20 mL盐酸时,溶液中NaHCO3的物质的量为0.002 molC.20mL0.1 mol·L-1Na2CO3溶液中:c(Na+)+c(H+)=c(CO32-)+c(HCO3-)+c(OH-)D.20 mL0.1 mol·L-1Na2CO3溶液中:c(H+)+2c(H2CO3-)+c(HCO3-)=c(OH-)26.(14 分)某合作小组的同学为了测定某铜的硫化物(Cu x S y)的组成,在实验室中利用如图装置(夹持装置略去)进行实验探究。

河北衡水中学2018年高考押题试卷化学试卷(二)可能用到的相对原子质量:H- 1 C -12 N -14 O-16 Ca -40 Cu -64 Br -80第Ⅰ卷选择题:本题共13小题,每小题6分。
在每小题给出的四个选项中,只有一项是符含题目要求的。
7.化学与社会、生活密切相关,对下列现象或亊实的解释不正确的是8.下列说法正确的是A.H2C=CHCH3分子中所有原子在同一平面上B.分子式为C3H5Br2的有机物共有4件同分异构体(不含立体异构)C.乙二醇和甘油互为同系物D.结构式为…-CH =CH—CH =CH—CH =CH—CH=CH-…的高分子化合物,其单体是乙烯9.下列实验中,操作和现象以及对应结论都正确且现象与结论具有因果关系的是10.合成药物异搏定路线中某一步骤如图所示,下列说法错误的是A.物质X 的分子中存在2种含氧官能团B.物质Y 可以发生水解和消去反应C.1molZ 最多可与2molBr 2发生加成反应D.等物质的量的X 、Y 分别与NaOH 溶液反应,最多消耗的NaOH 的物质的量之比为1:111. 锌银(Zn-Ag 2O)电池多应用于军事、航空、移动的通信设备、电子仪器和人造卫星、宇宙航行等方面,用如图所示装置模拟其工作原理,下列说法正确的是A.K +向a 极移动B.b 极的电极反应式为 Ag 2O+H 2O+2e -=2Ag+2OH -C.用该电池给铁棒镀铜,则铁棒与 b 极相连D.电池工作一段时间后,电解液的pH 减小12.短周期主族元素 X 、Y 、Z 、W 的原子序数依次增大,四种元素形成的单质依次为m 、n 、p 、q ;r 、t 、u是这些元素组成的二元化合物,其中u 为葡萄酒中的抑菌成分;25 ℃,0.01 mol/L 的v 溶液中:)()(-+OH c H c= 1.0×10-10。
上述物质的转化关系如图所示,下列说法不正确的是A.简单离子半径:W>Y>Z>XB.W ,Y 分別与X 元素形成的简单化合物的沸点: Y> WC.Z 2Y 和ZX 都只存在离子键D.能抑制水的电离,u 的水溶液能促进水的电离 13.室温下,下列关亍电解质的说法中正确的是A.中和等体积、等浓度的氨水和氢氧化钠溶液至pH 等于7,前者消耗的盐酸多B.向NaHS 溶液中加入适量 KOH 后:c(Na +)=c(H 2S)+c(HS -)+c(S 2-)C.将amol ·L -1的醋酸与0.01 mol ·L -1的氢氧化钠溶液等体积混合,溶液中:c(Na +)=c(CH 3COO -),醋酸的电离常数K a =01.01029-⨯-a (用含a 的代数式表示)D.向NH 4Cl 溶液中加入少量等浓度的稀盐酸,则)()(234O H NH c NH c ⋅+的值减小26. (15分)溴化钙易溶于水,医学上可用于治疗神经衰弱、癫痫等症。

衡水金卷2018年普通高校招生全国统一考试模拟试题(二)化学试卷第I卷(选择题)1.化学与社会、生活密切相关,下列说法正确的是A.通过浸渍水玻璃的方法防止木材腐朽B.宣纸的主要成分为蛋白质,酸性条件下易水解C.地沟油的主要成分与柴油的主要成分相同,所以地沟油可用于制生物柴油D.SO2有毒,不能用作食品漂白剂和食品防腐剂添加在粉条、红酒等食品饮料中【答案】A【解析】A.水玻璃具有防腐阻燃的作用,故A正确;B.纸的主要成分为纤维素,故B错误;C.地沟油的主要成分为高级脂肪酸甘油酯,茶油的主要成分为烃,故C错误;D.SO2是在葡萄酒生产中普遍使用的一种食品添加剂,故D错误;本题选A。
学#科网2.设NA为阿伏加德罗常数的值。
下列有关叙述正确的是A.标准状况下,足量的铜与一定量浓硝酸反应,每生成224mL气体,转移电子数目为0.01NAB.一定条件下,一定量的氧气通过Na单质后,Na单质增重3.2g,转移电子数目为0.4NAC.0.1mol/L的CH3COONa溶液中所含碳原子总数为0.2NAD.4g SiC中所含碳硅键数目为0.4NA【答案】D【解析】A.随着反应的进行,浓硝酸公变稀,生成的气体就会发生变化转移电子数日无法计算,故A项错误;B.氧气与Na单质反应得到的产物有可能是氧化钠,也有可能是过氧化钠,转移电子数日无法计算,B项错误;C.未给出溶液体积,故C项错误;D.4gSiC即0.1molSiC.含碳硅键数目为0.4mol,故D项正确。
3.分子式为C4H6O2的链状有机物M能与NaHCO3溶液反应产生CO2,下列关于M的说法中不正确的是A.能使酸性高锰酸钾溶液和溴水褪色B.同系物的通式为Cn H2n-2O2(n≥3)C.与HBr发生加成反应,最多有6种不同的结构( 不考虑立体异构) D.分子中至少有6个原于共平面【答案】C【解析】分子式为C4H6O2的链状有机物且含有羧基,根据分子式可知含碳碳双键,故A、D项正确;同系物的通式为Cn H2n-2O2(n≥3),故B项正确;M的结构简式可能为CH2=CHCH2COOH、CH3CH=CHCOOH、CH2=C(CH3)COOH,这3种物质与HBr加成时均可得到两种不同的物质,但其中有两种物质的结构简式均为CH3CHBRCH2COOH,即为5种结构,C项错误;故选C。
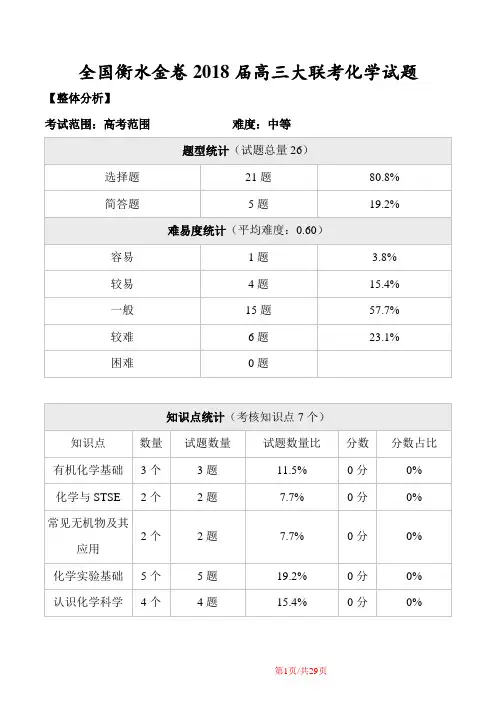
全国衡水金卷2018届高三大联考化学试题【整体分析】考试范围:高考范围难度:中等【知识点分析】17 选择题离子方程式的正误判断18 选择题仪器使用与实验安全19 选择题化学平衡的移动及其影响因素20 选择题氧化还原反应的应用21 选择题物质分离、提纯综合应用22 选择题化学科学对人类文明发展的意义23 简答题化学反应原理综合考查24 简答题物质制备的探究25 选择题氧化还原反应有关计算26 选择题有机官能团的性质及结构第I卷(选择题)1.下列生活用品的主要成分属于有机高分子化合物的是A.大豆油B.味精C.紫砂壶D.面巾纸【答案】D【解析】A.大豆油的主要成分是油脂,不是高分子化合物,A错误;B.味精的主要成分是谷氨酸钠,不是高分子化合物,B错误;C.紫砂壶的主要成分是硅酸盐,不是高分子化合物,C错误;D.面巾纸的主要成分是纤维素,属于高分子化合物,D正确,答案选D。
2.化学与生产、生活密切相关,下列与化学有关的说法错误的是A.草木灰与Ca(H2PO4)2混合施用可增强肥效B.水下钢柱桩壤锌块防腐的方法为牺牲阳极的阴极保护法C.区分羊绒织品和棉麻织品可用灼烧纺线的方法D.治理雾霾的根本方法是从源头上控制形成雾霾的污染物3.下列关于物质用途的说法正确的是A.磁性氧化铁可用于制备颜料和油漆B.小苏打既可用于制发酵粉又可用于制泡沫灭火器C.铝热剂可作为耐火材料D.铜罐可用于储运浓硝酸【答案】B【解析】A.氧化铁可用于制备颜料和油漆,A错误;B.小苏打是碳酸氢钠,既可用于制发酵粉又可用于制泡沫灭火器,B正确;C.铝热剂是金属铝和金属氧化物的混合物,不能作为耐火材料,C错误;D.铜与浓硝酸常温下即反应,铜罐不能用于储运浓硝酸,D错误,答案选B。
点睛:掌握相关物质的性质特点是解答的关键,选项D中注意钝化的条件和范围,常温下铝或铁在浓硫酸或浓硝酸中钝化,而不是铜。
4.下列说法错误的是A.石灰石既是制玻璃的原料又是制水泥的原料B.“大漠孤烟直”描述的是物质升华的过程C.高锰酸钾和浓盐酸不能保存在同一药品橱中D.可用盐酸酸化的BaCl2溶液检验露置的Na2SO3已变质【答案】B【解析】A、制玻璃的主要原料是石灰石、纯碱和石英,制水泥的原料为石灰石和黏土以及辅助原料,A正确;B、“大漠孤烟直”中的“烟”指的是烽烟,不是物质的升华,B错误;C、高锰酸钾和浓盐酸不属于同类物质,且二者之间能反应,不能保存在同一药品橱中,C正确;D、将待检物质中加入足量盐酸酸化的BaCl2溶液,若变质则有白色沉淀产生,D正确,答案选B。

7 •下列关于物质的性质或应用的说法正确的是 A •直接用淀粉溶液检验加碘盐中的碘元素B •石墨烯是一种强度最大、导电导热性能最强的化合物C .有机高分子化合物均为绝缘体,不能导电D .雷雨天空气中的氮气与氧气化合后物质的总能量升高&科学解释能力是科学素养的重要组成部分。
下列对实验操作、现象或事实的解释不合理 的是选项实豔撰作、现象哦寧实解释A. 用两根洁净的玻璃棒分别権取诫盐酸利诲 氨水■繭根玻馬棒在空中接近,产生白烟浓盐醴和餓氨水挥发出的HCkNH 3均 与水蒸气结合K 不能用碱式滴定骨址取高铤酸钾溶液 髙匾酸钾具有强氣化性•戚式滴定营下 端连有橡胶管,容易被轼化C.配制F e Cl a 溶液时拥人适曲盐截破化 抑制F 后亠水解.防止所配制溶液变澤浊P D.桁二戦化硫他人品红溶液中,品红溶液褪色二氧化硫貝有漂门性9. 设N A 为阿伏加德罗常数的值,下列说法正确的是3A . 20 g H 2O 中含有的电子数为 10N AB .向某密闭容器中充入O.lmol N 2、0.3 mol H 2,充分反应后,转移的电子数为0.6N AC .常温下,1 L 0.1 mol • L -1氨水中含有的氢原子数为0.5N AD . 60 g CH 3COOH 和HCOOCH 3的混合物中,含有的共用电子对数为 8N A10.前20号元素 W 、X 、Y 、Z 的原子序数依次增大,且分列四个不同周期和四个不同主族。
其中A 为Y 元素组成的单质;甲、乙、丙、丁、戊为上述四种元 素组成的二元或三元化合物;常温下乙为液体。
下列说法正确的 是 A .简单离子半径:Z>Y B .反应①为吸热反应C .反应②为工业上制备漂白粉的反应原理D . X 、Y 分别与Z 形成的化合物中,化学键类型一定相同 11. 锂-铜空气燃料电池是通过一种复杂的铜腐蚀“现象”产 生电力,其放电过程为 2Li+Cu 2O+H 2O===2Cu+2Li ++2OH —,下列说法不正确的是A .放电时,每转移 2 mol 电子,负极减轻14 g需质驚競固水晶电緬HI]空气。
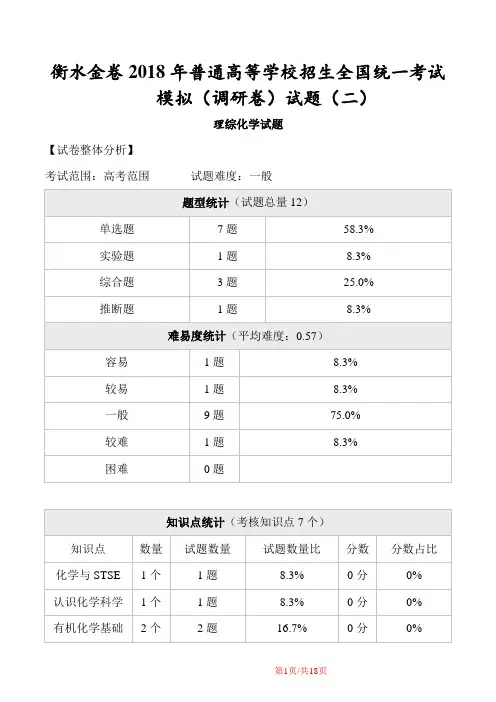
衡水金卷2018年普通高等学校招生全国统一考试模拟(调研卷)试题(二)理综化学试题【试卷整体分析】考试范围:高考范围试题难度:一般【题型考点分析】第I卷(选择题)1.化学与社会、生活密切相关,下列说法正确的是A.通过浸渍水玻璃的方法防止木材腐朽B.宣纸的主要成分为蛋白质,酸性条件下易水解C.地沟油的主要成分与柴油的主要成分相同,所以地沟油可用于制生物柴油D.SO2有毒,不能用作食品漂白剂和食品防腐剂添加在粉条、红酒等食品饮料中【答案】A【解析】A.水玻璃具有防腐阻燃的作用,故A正确;B.纸的主要成分为纤维素,故B错误;C.地沟油的主要成分为高级脂肪酸甘油酯,茶油的主要成分为烃,故C错误;D.SO2是在葡萄酒生产中普遍使用的一种食品添加剂,故D错误;本题选A。
学#科网点睛:二氧化硫不能用作其他食品的添加剂,但是可以用于葡萄酒的生产。
2.设N A为阿伏加德罗常数的值。
下列有关叙述正确的是A.标准状况下,足量的铜与一定量浓硝酸反应,每生成224 mL气体,转移电子数目为0.01N AB.一定条件下,一定量的氧气通过Na单质后,Na单质增重3.2 g,转移电子数目为0.4N AC.0.1mol/L的CH3COONa溶液中所含碳原子总数为0.2N AD.4 g SiC 中所含碳硅键数目为0.4N A【答案】D【解析】A.随着反应的进行,浓硝酸公变稀,生成的气体就会发生变化转移电子数日无法计算,故A项错误;B.氧气与Na单质反应得到的产物有可能是氧化钠,也有可能是过氧化钠,转移电子数日无法计算,B项错误;C.未给出溶液体积,故C项错误;D.4gSiC即0.1molSiC.含碳硅键数目为0.4mol,故D项正确。
点睛:SiC是原子晶体,每个Si和C都平均有2个共价键。
3.分子式为C4H6O2的链状有机物M能与NaHCO3溶液反应产生CO2,下列关于M的说法中不正确的是A.能使酸性高锰酸钾溶液和溴水褪色B.同系物的通式为C n H2n-2O2(n≥3)C.与HBr发生加成反应,最多有6种不同的结构( 不考虑立体异构)D.分子中至少有6个原于共平面【答案】C【解析】分子式为C4H6O2的链状有机物且含有羧基,根据分子式可知含碳碳双键,故A、D项正确;同系物的通式为C n H2n-2O2(n≥3),故B项正确;M的结构简式可能为CH2=CHCH2COOH、CH3CH=CHCOOH、CH2=C(CH3)COOH,这3种物质与HBr加成时均可得到两种不同的物质,但其中有两种物质的结构简式均为CH3CHBRCH2COOH,即为5种结构,C 项错误;故选C。


绝密★启用前2 01 8年普通高等学校招生全国统一考试模拟试题理科综合能力测试(二)本试题卷共1 6页,38题(含选考题)。
全卷满分300分,考试用时1 50分钟。
可能用到的相对原子质量:H 1 C 12 O 1 6 Mg 24 S 32 Cl 35.5 Ca 40Cu 64第I卷一、选择题:本题共13小题,每小题6分,共78分。
每小题只有一个选项符合题目要求。
1.下列有关细胞中元素和化合物的说法正确的是A.核酸和三磷酸腺苷所含化学元素的种类相同B.蔗糖的合成需要酶的催化,属于放能反应C.细胞膜表面有糖蛋白和脂质分子结合构成的糖脂D.脂肪是细胞内的主要能源物质2.下列有关细胞生命历程的说法正确的是A.细胞分裂后,物质运输效率会降低B.细胞分化后,有利于提高各种生理功能的效率C.细胞衰老后,细胞内的自由基会明显减少‘D.细胞癌变后,细胞核的体积增大、核膜内折3.下列有关实验的说法正确的是A.设置对照组和进行重复实验,二者的目的相同B.不能用样方法调查丛生草本植物的种群密度C.摩尔根用假说——演绎法证明了萨顿关于基因与染色体关系的假说D.能被甲基绿和健那绿染液染色的细胞均是死细胞4.某同学从温暖的教室里走到寒冷的室外,机体经过一系列调节达到相对稳定在此状态下,下列有关说法错误的是A.皮肤血管收缩,在室外的散热速率大于室内B.血液中促甲状腺激素增多,会促进甲状腺激素的分泌C.细胞内ATP的分解速率大于合成速率D.机体的热量主要来自于骨骼肌和肝脏产热5.下列有关基因突变和染色体变异的叙述正确的是A.两者都需要外界因素的诱导才能发生,都是随机的、不定向的B.发生基因突变或染色体变异后,生物性状必然改变C.将N基因导人M基因的内部,可实现这两个基因的重新组合D.诱发基因突变和利用单倍体培育新品种,均可缩短育种时间6.某草原生态系统经历长期干旱后,群落内的生物种类及个体数量均发生了较大的变化。
下列有关说法错误的是A.严重干旱改变了一些生物间的种间关系B.该草原生态系统经历了次生演替C.经历干旱后的草原生态系统的抵抗力稳定性下降D.与经历干旱前相比,某些种群的数量可能会增加7.化学与生产、生活密切相关,下列与化学有关的说法正确的是A.漂白粉久置于空气中易被氧化而变质B.酯类物质在碱性条件下的水解反应也称皂化反应C.T一碳(三维结构的碳纤维)和玻璃均为传统无机非金属材料D.“原子经济”的核心理念是在化学反应中原子利用率为100%8.下列对于相关描述的解释正确的是9.一定条件下,有机物a、b、c可完成转化:。

2018年高考全国卷II化学试题(含答案解析)2018年普通高等学校招生全国统一考试2理科综合能力测试试题卷(化学)可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 P 31 S 32 Fe 56一、选择题:本题共7个小题,每小题6分,共42分。
在每小题给出的四个选项中,只有一项是符合题目要求的。
1. 化学与生活密切相关。
下列说法错误的是()A. 碳酸钠可用于去除餐具的油污B. 漂白粉可用于生活用水的消毒C. 氢氧化铝可用于中和过多胃酸D. 碳酸钡可用于胃肠X射线造影检查2. 研究表明,氮氧化物和二氧化硫在形成雾霾时与大气中的氨有关(如下图所示)。
下列叙述错误的是()A. 雾和霾的分散剂相同B. 雾霾中含有硝酸铵和硫酸铵C. NH3是形成无机颗粒物的催化剂D. 雾霾的形成与过度施用氮肥有关3. 实验室中用如图所示的装置进行甲烷与氯气在光照下反应的实验。
光照下反应一段时间后,下列装置示意图中能正确反映实验现象的是()4. W、X、Y和Z为原子序数依次增大的四种短周期元素。
W与X 可生成一种红棕色有刺激性气味的气体;Y的周期数是族序数的3倍;Z原子最外层的电子数与W的电子总数相同。
下列叙述正确的是()A. X与其他三种元素均可形成两种或两种以上的二元化合物B. Y与其他三种元素分别形成的化合物中只含有离子键C. 四种元素的简单离子具有相同的电子层结构D. W的氧化物对应的水化物均为强酸5. N A代表阿伏加德罗常数的值。
下列说法正确的是()A. 常温常压下,124 g P4中所含P—P键数目为4N AB. 100 mL 1mol·L?1FeCl3溶液中所含Fe3+的数目为0.1N AC. 标准状况下,11.2 L甲烷和乙烯混合物中含氢原子数目为2N AD. 密闭容器中,2 mol SO2和1 mol O2催化反应后分子总数为2N A6. 我国科学家研发了一种室温下“可呼吸”的Na—CO2二次电池。

2018届全国衡水金卷高三大联考
化学试卷(原卷版)
可能用到的相对原子质量:H-1 C-12 O-16 Ca-40 Ti-48 Cu-64 Ag-l08
第I卷
一、选择题:本题包括21小题,每小题2分,共42分。
每小题只有一个选项符合题意。
1. 下列生活用品的主要成分属于有机高分子化合物的是
A. 大豆油
B. 味精
C. 紫砂壶
D. 面巾纸
2. 化学与生产、生活密切相关,下列与化学有关的说法错误的是
A. 草木灰与Ca(H
2PO
4
)
2
混合施用可增强肥效
B. 水下钢柱桩壤锌块防腐的方法为牺牲阳极的阴极保护法
C. 区分羊绒织品和棉麻织品可用灼烧纺线的方法
D. 治理雾霾的根本方法是从源头上控制形成雾霾的污染物
3. 下列关于物质用途的说法正确的是
A. 磁性氧化铁可用于制备颜料和油漆
B. 小苏打既可用于制发酵粉又可用于制泡沫灭火器
C. 铝热剂可作为耐火材料
D. 铜罐可用于储运浓硝酸
4. 下列说法错误的是
A. 石灰石既是制玻璃的原料又是制水泥的原料
B. “大漠孤烟直”描述的是物质升华的过程
C. 高锰酸钾和浓盐酸不能保存在同一药品橱中
D. 可用盐酸酸化的BaCl
2溶液检验露置的Na
2
SO
3
已变质
5. 洗涤仪器时,下列所选试剂合理的是
A. 用稀盐酸洗涤粘有二氧化锰的烧杯
B. 用稀硫酸洗涤做过银镜反应的试管
C. 用水洗涤久置漂白粉的试剂瓶
1 / 11。
2018年普通高等学校招生全国统一考试模拟试题化学(二)本试卷共8页,19题(含选考题)。
全卷满分100分,考试用时90分钟。
注意事项:1、答题前,先将自己的姓名、准考证号填写在试题卷和答题卡上,并将准考证号条形码粘贴在答题卡上的指定位置。
2、选择题的作答:每小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑,在试题卷、草稿纸和答题卡上的非答题区域均无效。
3、非选择题的作答:用签字笔直接答在答题卡上对应的答题区域内,写在试题卷、草稿纸和答题卡上的非答题区域均无效。
4、选考题的作答:先把所选题目的题号在答题卡上指定的位置用2B铅笔涂黑,答案写在答题卡上对应的答题区域内,写在试题卷、草稿纸和答题卡上的非答题区域均无效。
5、考试结束后,请将本试题卷和答题卡一并上交。
可能用到的相对原子质量:H 1 B 11 C 12 N 14 O 16 Na 23 C1 35.5 Cu 64Se 79 Br 80 Pd 106第I卷一、选择题:本题包括14小题,每小题3分,共42分。
每小题只有一个选项符合题目要求。
1.化学与生产、生活密切相关,下列说法正确的是A.国产大飞机——C919使用的碳纤维是一种新型的有机高分子材料B.Cu2+可水解生成Cu(OH)2胶体,因此可用硫酸铜净水C.“天舟一号”上使用了大量的合金材料,合金材料的组成元素不一定全部是金属元素D.75%的酒精溶液和稀高锰酸钾溶液均可用于杀菌、消毒,其原理相同2.下列关于有机化合物的说法正确的是A.糖类、油脂、蛋白质均属于高分子化合物B.葡萄糖、植物油均可使酸性高锰酸钾溶液褪色C.石油的分馏、煤的干馏均属于物理变化D.乙烯和聚乙烯均可使溴水褪色3.下列说法正确的是A.向海水中加入明矾可以使海水淡化B.钙基固硫和NO x的催化转化都能减少空气污染C.绿色化学的核心是利用化学原理对环境污染进行处理D.焚烧废旧塑料以防止“白色污染”4.下列是实验室以硫铁矿为原料制取硫酸亚铁溶液的实验装置,进一步制取Fe2O3的部分操作过程中能达到实验目的的是5.已知:lg2=0.3。
绝密★启用前2 01 8年普通高等学校招生全国统一考试模拟试题理科综合能力测试(二)化学本试题卷共1 6页,38题(含选考题)。
全卷满分300分,考试用时1 50分钟。
可能用到的相对原子质量:H 1 C 12 O 1 6 Mg 24 S 32 Cl 35.5 Ca 40Cu 647.化学与生产、生活密切相关,下列与化学有关的说法正确的是A.漂白粉久置于空气中易被氧化而变质B.酯类物质在碱性条件下的水解反应也称皂化反应C.T一碳(三维结构的碳纤维)和玻璃均为传统无机非金属材料D.“原子经济”的核心理念是在化学反应中原子利用率为100%8.下列对于相关描述的解释正确的是9.一定条件下,有机物a、b、c可完成转化:。
下列说法错误的是A.a的分子式为C8H10B.b的所有原子可能在同一平面上C.c的苯环上的二溴代物有5种(不含立体异构)D.a、b、c均能发生加成反应和取代反应l0.短周期主族元素X、Y、Z、W的原子序数依次增大,X、Z同主族。
Q为X、Y、W三种元素形成的一种化合物,常温下,0.1 mO1.L-1 Q溶液的pH<1。
下列说法正确的是A.原子半径:X<Y<Z<WB.X分别与Y、Z、W形成的简单化合物的沸点:Y>Z>WC.Y分别与X、Z形成的化合物中均含有极性键和非极性键D.均由X、Y、Z、W四种元素形成的两种常见化合物之间能发生复分解反应11.金属燃料电池在航海、通信、气象等领域有广泛用途。
某镁燃料电池反应为Mg+ClO一+H2O====Mg(OH)2+Cl一,其工作原理如图所示。
下列说法错误的是A.采用多孔铂电极可增大电极与电解质溶液的接触面积B.正极反应式为C1O—+H2O+2e一===2OH一+C1一C.M选用酸,有利于延长电池的使用寿命D.若负极消耗2.4 g Mg,通过交换膜的阳离子所带电荷总量为0.2 mol12.氢化钙固体是登山运动员常用的能源提供剂。
河北衡水中学2018年高考押题试卷化学试卷(二)可能用到的相对原子质量:H-1C-12N-14O-16Ca-40Cu-64Br-80第Ⅰ卷选择题:本题共13小题,每小题6分。
在每小题给出的四个选项中,只有一项是符含题目要求的。
7.化学与社会、生活密切相关,对下列现象或亊实的解释不正确的是8.下列说法正确的是A.H2C=CHCH3分子中所有原子在同一平面上B.分子式为C3H5Br2的有机物共有4件同分异构体(不含立体异构)C.乙二醇和甘油互为同系物D.结构式为…-CH=CH—CH=CH—CH=CH—CH=CH-…的高分子化合物,其单体是乙烯9.下列实验中,操作和现象以及对应结论都正确且现象与结论具有因果关系的是10.合成药物异搏定路线中某一步骤如图所示,下列说法错误的是A.物质X 的分子中存在2种含氧官能团B.物质Y 可以发生水解和消去反应C.1molZ 最多可与2molBr 2发生加成反应D.等物质的量的X 、Y 分别与NaOH 溶液反应,最多消耗的NaOH 的物质的量之比为1:111.锌银(Zn-Ag 2O)电池多应用于军事、航空、移动的通信设备、电子仪器和人造卫星、宇宙航行等方面,用如图所示装置模拟其工作原理,下列说法正确的是A.K +向a 极移动B.b 极的电极反应式为Ag 2O+H 2O+2e -=2Ag+2OH -C.用该电池给铁棒镀铜,则铁棒与b 极相连D.电池工作一段时间后,电解液的pH 减小12.短周期主族元素X 、Y 、Z 、W 的原子序数依次增大,四种元素形成的单质依次为m 、n 、p 、q ;r 、t 、u是这些元素组成的二元化合物,其中u 为葡萄酒中的抑菌成分;25℃,0.01mol/L 的v 溶液中:)()(-+OH c H c =1.0×10-10。
上述物质的转化关系如图所示,下列说法不正确的是A.简单离子半径:W>Y>Z>XB.W ,Y 分別与X 元素形成的简单化合物的沸点:Y>WC.Z 2Y 和ZX 都只存在离子键D.能抑制水的电离,u 的水溶液能促进水的电离13.室温下,下列关亍电解质的说法中正确的是A.中和等体积、等浓度的氨水和氢氧化钠溶液至pH 等于7,前者消耗的盐酸多B.向NaHS 溶液中加入适量KOH 后:c(Na +)=c(H 2S)+c(HS -)+c(S 2-)C.将amol ·L -1的醋酸与0.01mol ·L -1的氢氧化钠溶液等体积混合,溶液中:c(Na +)=c(CH 3COO -),醋酸的电离常数K a =01.01029-⨯-a (用含a 的代数式表示)D.向NH 4Cl 溶液中加入少量等浓度的稀盐酸,则)()(234NH c ⋅+的值减小26.(15分)溴化钙易溶于水,医学上可用于治疗神经衰弱、癫痫等症。
河北省衡水市衡水金卷2018届高三大联考化学试题可能用到的相对原子质量:H-1 C-12 O-16 Ca-40 Ti-48 Cu-64 Ag-l08第I卷一、选择题:本题包括21小题,每小题2分,共42分。
每小题只有一个选项符合题意。
1.下列生活用品的主要成分属于有机高分子化合物的是A.大豆油B.味精C.紫砂壶D.面巾纸2.化学与生产、生活密切相关,下列与化学有关的说法错误的是A.草木灰与Ca(H2PO4)2混合施用可增强肥效B.水下钢柱粧壤锌块防腐的方法为牺牲阳极的阴极保护法C.区分羊绒织品和棉麻织品可用灼烧纺线的方法D.治理雾霾的根本方法是从源头上控制形成雾霾的污染物3.下列关于物质用途的说法正确的是A.磁性氧化铁可用于制备颜料和油漆B.小苏打既可用于制发酵粉又可用于制泡沫灭火器C.铝热剂可作为耐火材料D.铜罐可用于储运浓硝酸4.下列说法的是A.石灰石既是制玻璃的原料又是制水泥的原料B.“大漠孤烟直”描述的是物质升华的过程C.高锰酸钾和浓盐酸不能保存在同一药品橱中D.可用盐酸酸化的BaCl2溶液检验露置的Na2SO3已变质5.洗涤仪器时,下列所选试剂合理的是A.用稀盐酸洗涤粘有二氧化锰的烧杯B.用稀硫酸洗涤做过银镜反应的试管C.用水洗涤久置漂白粉的试剂瓶D.用CS2洗涤粘有硫单质的圆底烧瓶6.环境和资源是人类面临的两大课题,下列说法正确的是A.燃煤中加入生石灰既可减少酸雨的产生,又可减少温室气体的排放B.石油分馏所得的汽油、煤油等产品均属于化合物C.海水淡化后所得的盐卤可提取溴、镁等多种重要元素D.沼气的主要成分为CH4,属于不可再生资源7.8.设NA为阿伏加德罗常数的值,下列说法正确的是A.50 g 46%的乙醇水溶液中含有的氢原子总数为6NaB. 1 mol H2与足量O2反应生成的H2O中含有的共价键总数为NAC.0.1molSO2溶于水,溶液中SO32-、HSO3-、H2SO3的总数为0.1NAD.用铂电极电解100 mL 1 mol • L-1的CuSO4溶液足够长时间,转移的电子数一定为0.2NA9.下列关于有机物a()、b()、c()的说法正确的是A.a、b的一氯代物均只有三种B.a、c互为同系物C.b的所有原子不可能在同一平面上D.a、b、c均能与溴水反应10.下列有关实验的说法正确的是A.洗净的量筒放在烘箱中烘干,可以缩短干燥的时间B.用棕色的碱式滴定管准确量取10.00 mL碘水,可以避免HIO光照分解C.将硝酸铵晶体溶于水,测得水温降低,说明硝酸铵水解吸热D.区分NaHSO4溶液和Na2CO3溶液,可以不用任何其他试剂11.示踪原子法是研究化学反应的重要方法之一,下列化学方程式正确的是A. 2Na218O2+2H2O=4NaOH+l8O2↑B.CH3C18OOH +CH3OHCH3CO18OCH3+H2OC.2KmnO4+5H218O2+3H2SO4=K2SO4+2MnSO4+518O2↑+8H2OD. 2C1’8+ H202 + 2Na()H2NaCR)2+ "02+ 2H2C)12.短周期主族元素X、Y、Z、W的原子序数依次增大。
衡水金卷2018届高三上学期全国大联考化学本试卷共8页,26题(含选考题)。
全卷满分100分。
考试时间90分钟。
注意事项:1.本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。
答卷前,考生务必将自己的姓名和考生号、试室号、座位号填写在答题卡上,并用铅笔在答题卡上的相应位置填涂考生号。
2.回答第Ⅰ卷时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑,如需改动,用橡皮擦干净后,再选涂其它答案标号。
写在本试卷上无效。
3.回答第Ⅱ卷时,将答案写在答题卡上。
写在本试卷上无效。
4.考试结束后,将本试卷和答题卡一并交回。
可能用到的相对原子质量:H-1 C-12 O-16 Ca-40 Ti-48 Cu-64 Ag-l08第I卷一、选择题:本题包括21小题,每小题2分,共42分。
每小题只有一个选项符合题意。
1.下列生活用品的主要成分属于有机高分子化合物的是A.大豆油B.味精C.紫砂壶 D.面巾纸2.化学与生产、生活密切相关,下列与化学有关的说法错误..的是A.草木灰与Ca(H2PO4)2混合施用可增强肥效B.水下钢柱粧壤锌块防腐的方法为牺牲阳极的阴极保护法C.区分羊绒织品和棉麻织品可用灼烧纺线的方法D.治理雾霾的根本方法是从源头上控制形成雾霾的污染物3.下列关于物质用途的说法正确的是A.磁性氧化铁可用于制备颜料和油漆B.小苏打既可用于制发酵粉又可用于制泡沫灭火器C.铝热剂可作为耐火材料D.铜罐可用于储运浓硝酸4.下列说法错误..的是A.石灰石既是制玻璃的原料又是制水泥的原料B.“大漠孤烟直”描述的是物质升华的过程C.高锰酸钾和浓盐酸不能保存在同一药品橱中D.可用盐酸酸化的BaCl2溶液检验露置的Na2SO3已变质5.洗涤仪器时,下列所选试剂合理的是A.用稀盐酸洗涤粘有二氧化锰的烧杯B.用稀硫酸洗涤做过银镜反应的试管C.用水洗涤久置漂白粉的试剂瓶D.用CS2洗涤粘有硫单质的圆底烧瓶6.环境和资源是人类面临的两大课题,下列说法正确的是A.燃煤中加入生石灰既可减少酸雨的产生,又可减少温室气体的排放B.石油分馏所得的汽油、煤油等产品均属于化合物C.海水淡化后所得的盐卤可提取溴、镁等多种重要元素D.沼气的主要成分为CH4,属于不可再生资源7.下列事实所对应的离子方程式正确的是8.设N A为阿伏加德罗常数的值,下列说法正确的是A.50 g 46%的乙醇水溶液中含有的氢原子总数为6N AB.1 mol H2与足量O2反应生成的H2O中含有的共价键总数为N AC.0.1molSO2溶于水,溶液中SO32-、HSO3-、H2SO3的总数为0.1N AD.用铂电极电解100 mL 1 mol • L-1的CuSO4溶液足够长时间,转移的电子数一定为0.2N A9.下列关于有机物的说法正确的是A.a、b的一氯代物均只有三种B.a、c互为同系物C.b的所有原子不可能在同一平面上D.a、b、c均能与溴水反应10.下列有关实验的说法正确的是A.洗净的量筒放在烘箱中烘干,可以缩短干燥的时间B.用棕色的碱式滴定管准确量取10.00 mL碘水,可以避免HIO光照分解C.将硝酸铵晶体溶于水,测得水温降低,说明硝酸铵水解吸热D.区分NaHSO4溶液和Na2CO3溶液,可以不用任何其他试剂11.示踪原子法是研究化学反应的重要方法之一,下列化学方程式正确的是A.2Na218O2+2H2O===4NaOH+l8O2↑B.CH3C18OOH +CH3OH CH3CO18OCH3+H2OC.2KmnO4+5H218O2+3H2SO4===K2SO4+2MnSO4+518O2↑+8H2OD.2C118 O2+ H2 O2+ 2NaOH===2NaClO2+ 18O2+ 2H2O12.短周期主族元素X、Y、Z、W的原子序数依次增大。
(衡水金卷)2018年普通高等学校招生全国统一考试模拟化学试题二7.化学与社会、生活密切相关,下列说法正确的是A.通过浸渍水玻璃的方法防止木材腐朽B.宣纸的主要成分为蛋白质,酸性条件下易水解C.地沟油的主要成分与柴油的主要成分相同,所以地沟油可用于制生物柴油D.SO2有毒,不能用作食品漂白剂和食品防腐剂添加在粉条、红酒等食品饮料中8.设N A为阿伏加德罗常数的值。
下列有关叙述正确的是A.标准状况下,足量的铜与一定量浓硝酸反应,每生成224 mL气体,转移电子数目为0.01N AB.一定条件下,一定量的氧气通过Na单质后,Na单质增重3.2 g,转移电子数目为0.4N AC.0.1mol/L的CH3COONa溶液中所含碳原子总数为0.2N AD.4 g SiC 中所含碳硅键数目为0.4N A9.分子式为C4H6O2的链状有机物M能与NaHCO3溶液反应产生CO2,下列关于M的说法中不正确的是A.能使酸性高锰酸钾溶液和溴水褪色B.同系物的通式为C n H2n-2O2(n≥3)C.与HBr发生加成反应,最多有6种不同的结构( 不考虑立体异构)D.分子中至少有6个原于共平面10.A、B、C、D、E为原子序数依次增大的短周期元素,对应单质为a、b、c、d、e。
B、C、D的最外层电子数之和为10,对应的最高价氧化物的水化物分别为m、n、p;q为B和E形成的二元化合物。
上述物质发生的转化关系如图所示(部分产物已略去)。
下列说法不正确的是A.可通过电解熔融状态的q制备b和eB.原子半径:B>C>D>E>AC.n既能溶解在m的水溶液中,又能溶解在p的水溶液中D.d可以保存在CS2中11.利用电解法制备Ca(H2PO4)2并得到副产物NaOH 和Cl2。
下列说法正确的是A.C 膜可以为质子交换膜B.阴极室的电极反应式为2H2O-4e-=O2↑+4H+C.可用铁电极替换阴极的石墨电极D.每转移2mole-,阳极室中c(Ca2+)降低1mol/L12.下列实验的操作、现象、结论或解释均合理的是A.酸碱中和滴定时,未用标准液润洗滴定管可导致最终计算结果偏大B.向Na2SiO3 溶液中滴加稀盐酸,产生白色沉淀可说明非金属性:Cl>SiC.用已检查不漏液的分液漏斗分离苯和水的混合物,需在分液漏斗下端放出苯D.向某溶液中滴加盐酸酸化的氯化钡,产生白色沉淀可说明原溶液中含有SO42-13.常温下,分别取未知浓度的MOH 和HA溶液,加水稀释至原体积的n倍。
稀释过程中,两溶液pH的变化如图所示。
下列叙述错误的是A.MOH为强碱,HA 为弱酸B.水的电离程度:X=Y>ZC.若升高温度,Y、Z 点对应溶液的pH值均减小D.将X 点溶液与Z点溶液等体积混合,所得溶液中c(A-)>c(M+)>c(H+)>c(OH-)26.(13 分)某校化学兴趣小组欲制取SO2,并探究SO2与FeCl3溶液的反应。
在图中选用必要装置完成实验。
(1)所选装置按气流方向的连接顺序为_________(填仪器接口的字母编号)。
(2)装置A中盛放浓硫酸和铜片的仪器名称为________,发生反应的化学方程式为______。
(3)欲配制装置C中100 mL 1mol/LFeCl3溶液,需要用到的玻璃仪器除烧杯、玻璃棒、量筒外,还需要_______;所配溶液需用盐酸酸化,请结合离子方程式解释原因:_______ 。
(4)实验过程中观察到装置C中的实验现象为溶液由棕黄色变成红棕色,最终变成浅绿色。
甲同学认为红棕色的出现,可能是产生了Fe(OH)3胶体,再混合其他颜色导致;乙同学查阅资料发现Fe(HSO3)2+为红棕色,且具有较强的还原性,认为红棕色是Fe(HSO3)2+所引起。
你认为____(填“甲”或“乙”)同学分析较为合理,原因为__________,验证两位同学结论的方法为____________。
27.(15 分)工业上用铬铁矿(主要成分可表示为FeO·Cr2O3,还含有Al2O3、MgCO3、SiO2等杂质)为原料制备重铬酸钾晶体(K2Cr2O7)和铁红的流程如下:已知: I.常见离子开始生成沉淀和沉淀完全的pH如下表所示:II. 熔融Na2CO3条件下主要发生反应:2FeO·Cr2O3+4Na2CO3+7NaNO3=4Na2CrO4+Fe2O3+4CO2↑+7NaNO2。
(1) 熔融Na2CO3条件下还可以得到的副产物为NaAlO2和Na2SiO3,生成这两种副产物的化学方程式为___________________。
(2)滤渣2 的主要成分为________(填化学式)。
(3)用醋酸调节pH2=5的目的为__________;若调节的pH过低,NO2-可被氧化为NO3-,其离子方程式为______________。
(4)调节pH2后,加入KCl控制一定条件,可析出K2Cr2O7晶体的可能理由是_______。
(5)调节pH3的范围为______。
(6)检验滤液4中Fe3+是否沉淀完全的方法是____________。
28.(15 分)一定条件下正戊烷(CH3CH2CH2CH2CH3)易发生两种裂解反应:I.CH3CH2CH2CH2CH3(g)CH3CH=CH2(g) + CH3CH3(g) △H1= +274. 2 kJ/mol;II.CH3CH2CH2CH2CH3(g)CH3CH2CH3(g) +CH2=CH2(g) △H2=+122.7 kJ/mol。
(1)维持体系温度T不变,总压强p恒定时,体积为V1L的正戊烷发生裂解反应,一段时间平衡后气体体积变为V2L,此时正戊烷的转化率α(正戊烷)=_______;维持体系温度不变,向体系中充入一定量的水蒸气(水蒸气在该条件下不参与反应),再次平衡后正戊烷的转化率将______(填“增大”“减小”或“不变”),原因为_____________。
(2)一定温度下,向体积为2L的密闭容器中充入0.2 mol CH3CH=CH2和0.5 molCH3CH3发生反应CH3CH=CH2(g) +CH3CH3(g)CH3CH2CH3(g)+CH2=CH2(g) △H3;5 min后达到平衡状态,容器内剩余CH3CH=CH2的物质的量为0.1mol。
①△H3=________。
②5 min内,该反应的平均反应速率v(CH3CH3)=________。
③保持温度不变,起始时向该密闭容器中充入等物质的量的CH3CH=CH2和CH3CH3,平衡后容器内CH3CH3的体积分数为______(保留一位小数)。
(3)将0.1mol CH3CH3完全燃烧后的气体通入100mL一定浓度的NaOH 溶液中,并将所得溶液稀释至1L。
最终所得溶液中CO32-、HCO3-、H2CO3三者所占物质的量分数随原NaOH 溶液浓度变化的关系如图所示:其中图中表示原氢氧化钠浓度为3 mol.L-1的是_____(填“a”“b”“c”“d”或“e”)。
(4)以氢氧化钠溶液为电解质溶液,CH3CH3燃料电池的负极反应式为_________。
35.【化学-选修3:物质结构与性质】(15 分)A、B、C、D、E、F 为原子序数依次增大的前36 号元素,其中只有两种金属元素。
A 与C同主族,B与E同主族;B与C能形成两种常见化合物;C与F最外层只有1个电子,且内层均已排满;基态D 原子成对电子数是未成对电子数的4倍。
请问答下列问題:(1)基态B原子的轨道表达式为______,其最高能级的电子云有_____个不同的伸展方向。
(2)B、C、E 原子半径由大到小的顺序为_________(用元素符号表示)。
(3)D 和E中第一电离能较大的是_______(填元素符号),原因为___________。
(4)A 与B形成的最简单化合物比A 与E形成的最简单化合物的熔点______(填“高“或“低”),原因为___________。
(5)D的最高价氧化物对应的水化物中,D原子的杂化轨道类型为______,已知该分子中除氢外其他原子均满足最外层8电子稳定结构,则其结构式为________。
(6)单质F 及其同族元素P、Q的堆积模型均为面心立方最密堆积,三种原子的半径分别为128pm、144pm、144pm,其中P和Q的相对原子质量分别为Mτ(P)、Mτ(Q)。
①单质F中的配位数为______;密度为_____g/cm3(用N A表示阿伏加德罗常数的值,列式即可)。
②单质P 和Q 的密度之比为________[用含Mτ(P)、Mτ(Q)的代数式表示]。
36.【化学一选修5:有机化学基础】(15分)茉酚是一种重要的有机化工原料。
利用苯酚合成已二醛[OHC(CH2)4CHO]和尼龙6()的合成路线如下:已知:I. ;II. 。
回答下列问题:(1)由A制取B的反应类型为_______;C的化学名称为___________。
(2)E的结构简式为____________。
(3)上述流程中合成尼龙6的化学方程式为_____________________。
(4)已二醛与银氨溶液反应的化学方程式为___________________。
(5)已二醛的同分异构休中既含五元环结构,又含“”结构的有_____种(不考虑立体异构);其中核磁共振氢谱有三组峰的结构简式有_________________。
(6)写出以溴乙烷为原料( 其他试剂任选)制备甲醛的合成跻线:_______________________。
参考答案7-13:ADCD CAB26.(13分)(1)adeg(2分)(2)圆底烧瓶(1分) Cu+2H 2SO 4(浓) △4+SO 2↑+2H 2O(2分) (3)胶头滴管 100ml 容量瓶(2分) Fe 3++3H 2OFe(OH)3+3H +,盐酸可抑制Fe 3+水解(2分)(4)乙(1分)实验过程中并未促进Fe 3+水解(2分) 丁达尔效应 (1分)27.(15分)(1)Na 2CO 3+Al 2O 3 2NaAlO 2+CO 2↑、Na 2CO 3+SiO 2 2Na2SiO 3+CO 2↑(3分,写对1个给2分。
两个都对给3分)(2)H 2SiO 3、Al(OH)3(2分,写对1各给1分,写错一个不得分)(3)将CrO 42-转化为Cr 2O 72-(2分) Cr 2O 72-+3NO 2-+8H +=2Cr 3++3NO 3-+4H 2O(2分)(4)在该条件下K 2Cr 2O 7的溶解度最低,更易以晶体形式析出(2分。
其他合理答案也得分)(5)3.2≤pH<8.1(2分)(6)取少量滤液于试管中,滴加KSCN 溶液, 溶液未变红即可证明Fe 3+沉淀完全,反之未沉淀完全。