2020版化学鲁科版选修4学案:第1章 微型专题重点突破(一)
- 格式:pdf
- 大小:898.88 KB
- 文档页数:23

第1章 化学反应与能量转化第1节 化学反应的热效应教学重点:反应热概念的含义;热化学方程式的正确书写;热化学方程式的正确书写以及反应焓变的计算。
从物质结构的角度看,化学反应的实质是旧化学键的断裂和新化学键的生成,因此几乎所有的化学反应都伴随着能量的释放或吸收。
通过过去对化学的学习,我们知道在化学反应中,化学能可以与多种形式的能量发生转化,其中最普遍的能量转化是化学能与热能之间的转化。
因此可以将化学反应分为放热反应和吸热反应。
第1节 化学反应的热效应常见的放热反应:①活泼金属与水或酸的反应 ②酸碱中和反应 ③燃烧反应 ④多数化合反应 常见的吸热反应:①多数分解反应,如CaCO 3高温CaO+CO 2↑②2NH 4Cl (s )+Ba(OH)2·8H 2O (s )=BaCl 2+2NH 3 ↑+10H 2O ③C(s)+H 2O(g)高温CO+H 2 ④CO 2+C高温2CO注意:化学反应是放热还是吸热,与反应条件(加热或不加热)没有关系。
放热反应和吸热反应我们还可以借助下面的图像来理解。
下列对化学反应热现象的说法不正确的是( AC )A.放热反应时不必加热B.化学反应一定有能量变化C.一般地说,吸热反应加热后才能发生D.化学反应的热效应的数值与参加反应的物质的多少有关为了定量描述化学反应中释放或吸收的热能,化学上把化学反应在一定温度下进行时,反应所释放或吸收吸热反应放热反应的热量称之为该温度下的热效应,简称反应热。
一、化学反应的反应热(一)反应热1、定义:当化学反应在一定的温度下进行时,反应所释放或吸收的热量称为该反应在此温度下的热效应,简称反应热。
2、反应热的意义:描述化学反应释放或吸收热量的物理量.3、符号:Q>0 反应放热Q Q<0 反应吸热4、获得Q值的方法:(1)实验测量法(2)理论计算法5、①中和热反应热的分类:②燃烧热③生成热……(二)中和热1、定义:在稀溶液中,强酸跟强碱发生中和反应,生成1mol水时的反应热叫做中和热。

微型专题重点突破(二)[核心素养发展目标] 1.创新意识:能从多角度理解原电池的原理,认识化学能转化为电能方式的多样性,学会新型电池原理的分析方法,增强创新意识。
2.模型认知:进一步理解电解的原理,构建电解应用与计算的相关思维模型,并能应用其模型解决实际问题。
一、原电池原理的多角度考查例1热激活电池可用做火箭、导弹的工作电源。
一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能。
该电池总反应为:PbSO4+2LiCl+Ca===CaCl2+Li2SO4+Pb。
下列有关说法正确的是()A.正极反应式:Ca+2Cl--2e-===CaCl2B.放电过程中,Li+向负极移动C.每转移0.1 mol电子,理论上生成20.7 g PbD.常温下,在正、负极间接上检流计,指针不偏转答案 D解析正极发生还原反应,故为:PbSO4+2e-===Pb+SO2-4,A项错误;放电过程为原电池,故阳离子向正极移动,B项错误;每转移0.1 mol电子,生成0.05 mol Pb为10.35 g,C项错误;常温下,电解质不能熔化,不能形成原电池,故指针不偏转,D项正确。
考点原电池的相关综合题点原电池原理的多角度考查常从如下方面考查原电池的原理:(1)判断原电池正极和负极,或确定其电极材料;(2)判断电极反应类型,负极发生氧化反应,正极发生还原反应;(3)判断离子迁移方向,电解质溶液中阴离子移向负极,阳离子移向正极;(4)判断电子流向,电子从负极流出经外电路流向正极;(5)电极反应式的正误判断,要特别注意电极产物是否与电解质溶液反应。
变式1水泥在固化过程中自由水分子减少并形成碱性溶液。
根据这一物理化学特点,科学家发明了电动势法测水泥的初凝时间。
此法的原理如图所示,反应的总方程式为:2Cu+Ag2O===Cu2O+2Ag。
下列说法正确的是()A.负极材料是银B.负极的电极反应式为:2Cu+2OH--2e-===Cu2O+H2OC.测量原理示意图中,电流从Cu经过导线流向Ag2OD.电池工作时,溶液中OH-向正极移动答案 B解析在该氧化还原反应中还原剂是铜,铜做负极,A错误;铜为负极、Ag2O为正极,负极的电极反应式为:2Cu+2OH--2e-===Cu2O+H2O,电流从Ag2O经过导线流向铜,B正确,C错误;电池工作时,阳离子向正极移动,阴离子向负极移动,D错误。

第3课时 金属的腐蚀与防护目标与素养:1.了解金属腐蚀的原因,能辨别金属发生腐蚀的类型。
(宏观辨识)2.理解金属发生电化学腐蚀的原理及类型,了解金属腐蚀带来的危害。
(证据推理与模型认知)3.掌握金属防护的方法以及金属的电化学防护的原理。
(变化观念与平衡思想)1.金属的腐蚀(1)金属腐蚀的定义和分类(2)化学腐蚀和电化学腐蚀2.金属的防护(1)在金属表面覆盖保护层①涂油漆等。
②镀抗腐蚀金属,如电镀等。
③镀膜,如烤蓝等。
(2)改变金属内部组成、结构等,如制成不锈钢。
(3)电化学防护①牺牲阳极保护法。
利用原电池原理,在被保护的金属上连接更活泼的金属,使被保护金属成为正极。
②外加电流阴极电保护法。
利用电解池原理,使被保护的金属连接电源的负极成为阴极。
1.判断对错(对的在括号内打“√”,错的在括号内打“×”。
)(1)金属被腐蚀的本质是M+n H2O===M(OH)n+n2H2↑。
(2)马口铁(镀锡铁)镀层破损后,首先是镀层被氧化。
(3)金属在一般情况下发生的电化学腐蚀主要是吸氧腐蚀。
(4)常温下,置于空气中的金属主要发生化学腐蚀。
(5)钢铁发生析氢腐蚀和吸氧腐蚀的正极反应式相同。
[提示](1)×金属被腐蚀的本质是M-n e-===M n+。
(2)×活动性:Fe>Sn,故马口铁破损后形成Fe-Sn原电池,Fe作负极被氧化。
(3)√(4)×常温下,置于空气中的金属主要发生电化学腐蚀。
(5)×钢铁发生析氢腐蚀和吸氧腐蚀的负极反应式相同。
2.铁制自来水管与下列材料做成的水龙头连接,自来水管锈蚀最快的是()A.铁水龙头B.铜水龙头C.塑料水龙头D.陶瓷水龙头B[Fe-Cu形成原电池,Fe作负极加快其腐蚀。
]3.牺牲阳极保护法中被保护的金属作()A.阳极B.阴极C.正极D.负极C[牺牲阳极保护法为原电池原理,被保护的金属作正极。
]1.金属的电化学腐蚀、注意事项(1)化学腐蚀和电化学腐蚀往往同时发生,只是电化学腐蚀比化学腐蚀更普遍,危害更大。

章节复习及练习讲评知识与能力:1.建立化学反应中能量变化的观点,了解吸热反应和放热反应,并会正确书写热化学方程式;2.学会利用题目中所提供的信息,对电解池、原电池等电解原理实际应用的电极材料和电极反应式判断和书写;3.解决好电子转移的关系来完成电解有关计算。
过程与方法:通过知识点的简单回顾,以及考点的归纳分析,进一步在练习上加深对知识点的认识,在讲评中强化一些概念和多增加一些注意点,以协助和补充对课本内容的理解和掌握。
然后通过抓主干去枝叶来拓展思维,在头脑这高层领域里对知识点的有新的认识。
情感态度与价值观:养成循序渐进的思维历程,在研究和探讨中激发起学习的兴趣。
课型:练习研讨课教学重难点:旨在让学生了解考点以及对练习的把握,如何能够将知识融会贯通,在解决问题的过程中能够积极开动脑筋。
课时安排:2课时教学过程:(第一课时)【考点归纳】本章教科书以“能量转化”为主线,首先学习了通过实验测定方法和理论方法来定量描述化学反应的热效应,然后学习了化学能与电能相互转化的两种具体形式:一是电能转化为化学能—电解;二是化学能转化为电能—电池。
(一起阅读P26--27)【考点一】化学反应的热效应1.建立化学反应中能量变化的观点,了解吸热反应和放热反应2.书写热化学方程式应注意的问题【考点二】电解原理极其应用1.电解池判断2.电极反应3.电解有关计算的方法规律【考点三】原电池工作原理极其应用1.原电池判断2.电极反应3.化学电源【题1】下列各项与反应热的大小无关的是(D)A.反应物的状态B.生成物的状态C.反应物的多少D.表示反应热的单位【解析】反应热指化学反应在一定的温度下进行时,反应所释放或吸收的热。
反应热与反应物的物质的量成正比。
与物质状态有关,与表示反应热的单位无关。
【题3】已知充分燃烧a g乙炔气体时生成1 mol二氧化碳气体和液态水,并放出热量b kJ,则乙炔燃烧的热化学方程式正确的是(A)A.2C2H2(g)+5O2(g)==4CO2(g)+2H2O(l) ΔH=-4b kJ•mol-1B.C2H2(g)+5/2O2(g)==2CO2(g)+H2O(l) ΔH=-2b kJ•mol-1C.2C2H2(g)+5O2(g)==4CO2(g)+2H2O(l) ΔH=-2b kJ•mol-1D.2C2H2(g)+5O2(g)==4CO2(g)+2H2O(l) ΔH=b kJ•mol-1【解析】放热反应中ΔH <0,所以B、D错误。
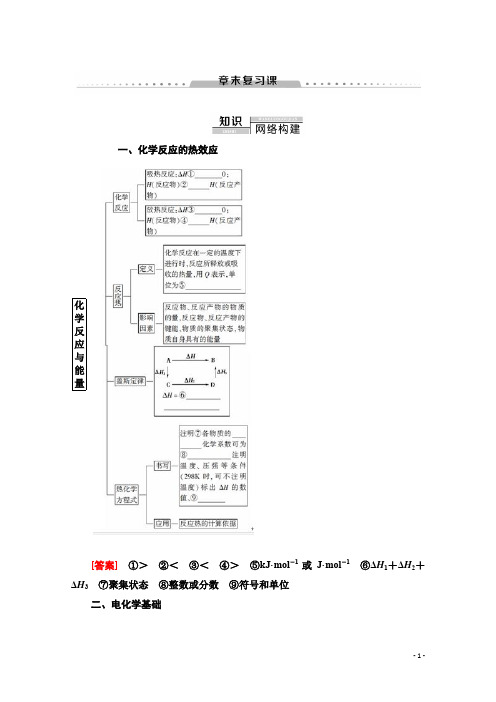
一、化学反应的热效应Array化学反应与能量[答案]①>②<③<④>⑤kJ·mol-1或J·mol-1⑥ΔH1+ΔH2+ΔH3⑦聚集状态⑧整数或分数⑨符号和单位二、电化学基础电化学原理—[答案]①相连的两个电极②电解质溶液③氧化反应④还原反应⑤活泼性不同⑥电解质溶液⑦还原反应⑧化学⑨电化学⑩析氢⑪吸氧⑫牺牲阳极⑬外加电流1.ΔH=反应物总键能-反应产物总键能2.ΔH=反应产物总能量-反应物总能量=H(反应产物)-H(反应物)3.ΔH=正反应活化能-逆反应活化能。
4.根据盖斯定律计算,可以将两个或两个以上的热化学方程式相加或相减,得到一个新的热化学方程式,从而确定ΔH。
1.已知下列反应:SO2(g)+2OH-(aq)===SO2-3(aq)+H2O(l)ΔH1ClO-(aq)+SO2-3(aq)===SO2-4(aq)+Cl-(aq)ΔH2CaSO4(s)===Ca2+(aq)+SO2-4(aq)ΔH3则反应SO2(g)+Ca2+(aq)+ClO-(aq)+2OH-(aq)===CaSO4(s)+H2O(l)+Cl-(aq)的ΔH=__________________________。
[解析]将题给三个热化学方程式分别标号为Ⅰ、Ⅱ、Ⅲ,根据盖斯定律,由Ⅰ+Ⅱ-Ⅲ可得:SO2(g)+Ca2+(aq)+ClO-(aq)+2OH-(aq)===CaSO4(s)+H2O(l)+Cl-(aq),则有ΔH=ΔH1+ΔH2-ΔH3。
[答案]ΔH1+ΔH2-ΔH32.甲醇既是重要的化工原料,又可作为燃料,利用合成气(主要成分为CO、CO2和H2)在催化剂作用下合成甲醇。
发生的主要反应如下:①CO(g)+2H 2(g)CH3OH(g)ΔH1②CO 2(g)+3H2(g)CH3OH(g)+H2O(g)ΔH2③CO 2(g)+H2(g)CO(g)+H2O(g)ΔH3回答问题:已知反应①中相关的化学键键能数据如下:=123________kJ·mol-1。

微专题(一)电解池与原电池的综合复习1.电解池与原电池装置的辨析(1)先分析有无外接电源,有外接电源的为电解池,无外接电源的可能为原电池。
(2)再分析反应本质,如发生非自发氧化还原反应,装置为电解池,如能发生自发氧化还原反应,则装置为原电池。
(3)多池相连,但无外接电源时,两极活泼性差异最大的一池为原电池,其他各池可看作电解池。
2.电解池与原电池的有关计算规律(1)同一原电池的正、负极—同一电解池的阴极、阳极的电极反应得、失电子数相等。
(2)串联电路中的各个电极反应得、失电子数相等。
(3)在计算电解产物的量时,应按得、失电子数相等计算。
3.书写电极反应式和总反应式的规律(1)根据给出的两个电极反应式,写总反应式。
已知两个电极反应式,写总反应式时,要使两个电极反应式得失电子数相等后,将两式相加,消去相同的化学式即可。
(2)给出总反应式,写出电极反应式。
书写电极反应式的步骤一般分为四步:①列物质、标得失;②选离子、配电荷;③配个数、巧用水;④两式加、验总式。
(3)根据信息给予的知识,写电极反应式和总反应式。
(甲)【典例】串一串——辨清装置,写出电极反应,回答问题甲:(左)铁(____极)______________________________;石墨(____极)____________________________。
(右)石墨(____极)_________________________________;铜(____极)____________________________________。
当右图装置左侧________电极收集到224 mL(已换算成标准状况下体积)气体时,右侧________电极增重________g。
(乙)乙:银电极反应式:_________________________________;铂电极反应式:____________________________________。
高三化学复习《化学选修4》第1章第1节鲁教版【本讲教育信息】一. 教学内容:高考第一轮复习《化学选修4》第1章化学反应与能量变化第1节化学反应的热效应1、化学反应的反应热2、化学反应的焓变3、反应焓变的计算二. 教学目的:1、掌握化学反应中能量变化的主要原因。
2、掌握反应热和焓的概念。
3、掌握热化学方程式的书写。
4、掌握盖斯定律并用之进行相关计算。
三. 重点和难点:1、反应热概念的含义。
2、热化学方程式的书写。
3、反应焓变的计算。
四. 考点分析:本节内容在高考中的主要考查点是:1、热化学方程式的书写与正误判断。
2、有关反应焓变的计算、比较焓变的大小。
3、燃烧热、中和热的概念及计算。
五. 知识要点1、反应热焓变(1)根据化学反应过程中的热量变化,可以把化学反应分为___________反应和___________反应。
(2)化学反应过程中_____________叫做反应热,又称为_____________,符号用___________表示,单位常采用_____________。
许多化学反应的反应热可以通过___________测量。
(3)任何化学反应都有反应热,这是由于在化学反应过程中,当反应物分子内的化学键断裂时,需要克服_____________间的_____________,这需要_____________能量;当原子重新结合成生成物分子,即新_____________形成时,又要_____________能量。
生成物释放的总能量比反应物吸收的总能量大时为_____________反应;反之为_____________反应。
(4)对于放热反应,由于反应后放出热量而使反应体系的能量___________,因此△H 为_____________或△H_____________0;对于吸热反应,由于反应通过加热、光照等吸收能量而使体系的能量升高,因此吸热反应的△H为_____________或△H_____________0。
第一章本章总结【考点归纳】本章教科书以“能量转化”为主线,首先学习了通过实验测定方法和理论方法来定量描述化学反应的热效应,然后学习了化学能与电能相互转化的两种具体形式:一是电能转化为化学能—电解;二是化学能转化为电能—电池。
【考点一】化学反应的热效应1.建立化学反应中能量变化的观点,了解吸热反应和放热反应2.书写热化学方程式应注意的问题【考点二】电解原理极其应用1.电解池判断2.电极反应3.电解有关计算的方法规律【考点三】原电池工作原理极其应用1.原电池判断2.电极反应3.化学电源【题1】下列各项与反应热的大小无关的是()A.反应物的状态 B.生成物的状态 C.反应物的多少 D.表示反应热的单位【题2】已知充分燃烧a g乙炔气体时生成1 mol二氧化碳气体和液态水,并放出热量b kJ,则乙炔燃烧的热化学方程式正确的是()A.2C2H2(g)+5O2(g)==4CO2(g)+2H2O(l) ΔH=-4b kJ•mol-1B.C2H2(g)+5/2O2(g)==2CO2(g)+H2O(l) ΔH=-2b kJ•mol-1C.2C2H2(g)+5O2(g)==4CO2(g)+2H2O(l) ΔH=-2b kJ•mol-1D.2C2H2(g)+5O2(g)==4CO2(g)+2H2O(l) ΔH=b kJ•mol-1【题3】1L0.1 mol•L-1agNO3溶液在以Ag作阳极,Fe作阴极的电解槽中电解,当阴极增重2.16g时,下列判断正确的是(设电解按理论进行,溶液不蒸发)()A.溶液的浓度变为0.08 mol•L-1 B.阳极上产生112mLO2(标准状况)1022个 D.反应中有0.01mol的Ag被氧化C.转移的电子数是1.204【题4】将铂电极放置在KOH溶液中,然后分别向两极通入CH4和O2即可产生电流,称为燃料电池,下列叙述正确的是()①通入CH4的电极为正极②正极的电极反应式是2H2O+O2+4e-→4OH-③通入CH4的电极反应式是CH4+2O2+4e-→CO2+2H2O④正极的电极反应式是CH4+10OH-→CO32-+7H2O+8e-⑤放电时溶液中的阳离子向负极移动⑥放电时溶液中的阴离子向负极移动A.①③⑤B.②④⑥C.④⑤⑥D.①②③【题5】四个电解装置都以Pt作电极,它们分别装着如下电解质溶液进行电解,电解一段时间后,测定其pH()【题6】电解硫酸溶液时,放出25mL(标准状况)O2,若以等量的电荷量在同样条件下电解盐酸溶液,所放出的气体的体积最接近下列数据中的是()A.45mL B.50mL C.75mL D.100mL【题7】用惰性电极电解pH=6的CuSO4溶液500mL ,当电极上有16mg 铜析出时,溶液的pH 约为(设电解前后溶液体积变化可忽略,阴极上无H 2析出) ( )A.1B.3C.6D.9【题8】高铁电池是一种可充电电池,与普通高能电池相比,该电池能长时间保持稳定放电电压。
第1节化学反应的热效应第1课时化学反应的反应热[核心素养发展目标] 1.变化观念:知道化学反应中能量转化的原因,能说出常见的能量转化形式,理解反应热的概念,认识和判断放热反应和吸热反应。
2.科学探究:了解反应热(中和热)测定的原理和方法,会分析产生误差的原因,不断完善和改进测定方法。
一、化学反应的反应热1.化学反应过程中能量变化的原因(1)化学反应的两大基本特征(2)化学反应中的能量变化已知:1 mol H2分子中的化学键断裂吸收的能量是436 kJ;1 mol Cl2分子中的化学键断裂吸收的能量是243 kJ;2 mol HCl分子中的化学键形成释放的能量是862 kJ;H2(g)+Cl2(g)===2HCl(g)的反应放出的热量为183 kJ。
2.反应热的概念当化学反应在一定的温度下进行时,反应所释放或吸收的热量称为该反应在此温度下的热效应,简称为反应热。
(1)表示方法:用符号Q表示;Q>0,反应吸热;Q<0,反应放热。
(2)单位:J·mol-1或kJ·mol-1。
(3)图示图1表示放热反应,图2表示吸热反应。
(1)反应热与化学键断裂与形成的关系Q=断裂反应物化学键吸收的总能量(E1)-形成反应产物化学键放出的总能量(E2)①若E1>E2,则Q>0,为吸热反应。
②若E1<E2,则Q<0,为放热反应。
(2)反应热与反应物、反应产物能量的关系Q=反应产物的总能量(E2)-反应物的总能量(E1)例1已知化学反应A2(g)+B2(g)===2AB(g)的能量变化如图所示,判断下列叙述中正确的是()A.每生成2分子AB吸收b kJ热量B.断裂1 mol A—A键和1 mol B—B键,放出a kJ能量C.该反应中反应物的总能量高于反应产物的总能量D.该反应热为(a-b) kJ·mol-1答案 D解析依据题图分析,1 mol A2和1 mol B2反应生成2 mol AB,每生成2 mol AB(g)吸收(a -b) kJ的热量,A项错误;断裂1 mol A—A键和1 mol B—B键,吸收a kJ能量,B项错误;依据题图可知,反应物的总能量低于反应产物的总能量,C项错误;反应热Q=反应产物的总能量-反应物的总能量,所以反应热Q=(a-b) kJ·mol-1,D项正确。