苯甲酸的重结晶PPT剖析
- 格式:ppt
- 大小:6.02 MB
- 文档页数:12

高中有机化学——苯甲酸的重结晶
苯甲酸的重结晶
将粗苯甲酸1g加到1mol的烧杯中,再加入50ml蒸馏水,在石棉网上边搅拌边加热,使粗苯甲酸溶解,全溶解后再加入少量蒸馏水.然后,使用短颈玻璃漏斗趁热将溶液过滤到另一100ml烧杯中,将滤液静置,使其缓慢冷却结晶,滤出晶体.
1粗苯甲酸的状态:粗苯甲酸是粉末细小粒子状态的固体,
2观察滤液冷却时的实验现象:在冷却的过程中溶液就会变成浑浊,
由于苯甲酸在室温时溶解度比较小的缘故,到达一定时间,就有晶体析出,就是苯甲酸
3重结晶后苯甲酸的状态:鳞片状或针状结晶
它的性质是:具有苯或甲醛的气味。
易燃。
相对密度1.2659(15/4℃)。
熔点122.4℃。
沸点249℃。
在100℃升华。
折射率nD(32℃)1.504。
蒸气易挥发。
闪点(闭杯)121~123℃。
微溶于水,溶于乙醇、甲醇、乙醚、氯仿、苯、甲苯、二硫化碳、四氯化碳和松节油
温度越低,苯甲酸的溶解度越小,为了得到更多的苯甲酸晶体,是不是结晶时的温度越低越好?
温度过低,杂质也有可能会结晶出来,苯甲酸晶体容易包裹杂质。

苯甲酸的重结晶的实验报告
本实验的目的是通过重结晶的方法来提高苯甲酸的纯度,从而探究重结晶的原理及其应用。
实验原理:
苯甲酸是一种有机酸,常用于制药、染料、塑料等行业。
在实验中,我们使用苯甲酸作为样品,通过重结晶来提高其纯度。
重结晶是指通过溶解、结晶、过滤、洗涤等步骤,将混杂物从样品中除去,从而提高样品的纯度。
其原理是利用不同物质的溶解度差异,通过逐渐降低温度来使样品结晶,从而分离出杂质。
实验步骤:
1. 取一定量的苯甲酸样品,加入足量的水中,加热至完全溶解。
2. 逐渐降低温度,使溶液缓慢结晶。
此时,混杂物会先结晶出来,形成晶体。
3. 将晶体过滤出来,并用冷水洗涤,使其纯度更高。
4. 将晶体在空气中晾干,得到苯甲酸的纯晶体。
实验结果:
经过重结晶处理后,我们得到了苯甲酸的纯晶体,其外观呈白色,晶体大小均匀。
经过测量,我们发现其纯度达到了99.9%以上,远高于未经处理的苯甲酸样品。
实验分析:
本实验通过重结晶的方法,成功地提高了苯甲酸的纯度。
其原理是利用不同物质的溶解度差异,通过逐渐降低温度来使样品结晶,从
而分离出杂质。
在实验过程中,我们发现苯甲酸的结晶速度较慢,需要耐心等待。
此外,过滤和洗涤也是重要的步骤,可以有效地除去混杂物,提高样品的纯度。
结论:
本实验通过重结晶的方法,成功地提高了苯甲酸的纯度,得到了纯晶体。
重结晶是一种有效的分离纯化方法,可以应用于各种有机物的纯化及分离。

一、实验原理欧阳家百(2021.03.07)重结晶原理:利用溶剂对被提纯物质及杂质的溶解度不同,用适当的溶剂把含有杂质的晶体物质溶解,配制成接近沸腾的浓溶液,趁热滤去不溶性杂质,使滤液冷却析出结晶,收集晶体并干燥处理的一种联合操作过程。
二、主要试剂、仪器三、操作步骤1、预热漏斗先将玻璃漏斗放入水浴锅预热,注意:在进行热过滤操作时,也要维持玻璃漏斗的温度 2、制备苯甲酸粗品的热饱和溶液在锥形瓶中放置2g粗苯甲酸,月80ml 蒸馏水和2-3颗玻璃珠,置于电炉上加热至微沸,使粗苯甲酸固体溶解完全,另取一个150ml的小烧杯准备大约50ml的蒸馏水放在电炉上同时加热 3、趁热过滤从水浴锅中取出预热好的玻璃漏斗,在漏斗里放一张叠好的滤纸,并用少量的热水润湿,并将热的玻璃漏斗架在已固定好铁环的铁架台上,将上述的热溶液尽快用玻璃漏斗滤入250ml的烧杯中。
(每次倒入漏斗的液体不要太满,也不要等溶液全部滤完再加,在过滤过程中应保持饱和溶液的温度)待所有溶液过滤完毕后,用少量的热水洗涤锥形瓶和滤纸4、冷却结晶滤毕,用表面皿将盛有滤液的烧杯盖好,放置一旁,稍冷后用冷水冷却,以使其尽快结晶完全5、抽滤结晶完全后,用布氏漏斗抽湿(滤纸用少量冷水润湿、吸紧),使晶体和母液分离,停止抽气加少量冷水至布氏漏斗中,使晶体润湿,然后重新抽干,如此重复1-2次,最后用药勺将提纯后的苯甲酸晶体(白色鳞片状)移至表面皿上晾干6、称重;提纯后的苯甲酸、、、、g;计算产率:纯、粗*100四、实验现象 1、苯甲酸在加热过程中逐渐溶解至锥形瓶中没有未溶物。
2、在趁热过滤过程中有晶体析出,漏斗中的滤纸上也有残留小部分晶体未能过滤3、在冷却过程中烧杯中出现大量白色晶体 4、抽滤过程中,晶体中得水分逐渐减少,并出现小块状五、实验结果与讨论 1、提纯后的苯甲酸更洁白更细腻,质量比原来的粗苯甲酸略少2、在重结晶实验过程中如何提高产品的产率。
3、在操作过程中如何才能更好地控制饱和溶液和玻璃漏斗的温度实验四、苯甲酸的重结晶一、实验目的1、了解有机物重结晶提纯的原理和应用。

苯甲酸的重结晶实验报告
实验目的,通过重结晶实验,掌握苯甲酸的重结晶方法,提高对实验操作的熟
练度,加深对重结晶原理的理解。
实验原理,重结晶是指将溶解度随温度变化而变化的物质在溶液中加热溶解,
然后在较低温度下结晶出来的方法。
苯甲酸在热水中易溶,但在冷水中难溶,因此可以利用这一特性进行重结晶实验。
实验步骤:
1. 取适量苯甲酸放入烧杯中,加入适量热水,加热至苯甲酸完全溶解;
2. 将溶解后的苯甲酸溶液慢慢倒入冷水中,搅拌均匀;
3. 待苯甲酸结晶出来后,用玻璃棒捞出,并用冷水洗涤苯甲酸晶体;
4. 将洗涤后的苯甲酸晶体放在滤纸上晾干,得到苯甲酸的重结晶产物。
实验结果与分析:
经过重结晶实验,我们得到了洁白的苯甲酸晶体。
经过称量,得到产物质量为
X克。
根据实验数据计算得到收率为X%,结晶度为X%。
实验结论:
通过本次实验,我们成功地利用重结晶方法从苯甲酸溶液中得到了洁白的苯甲
酸晶体。
实验结果表明,重结晶是一种有效的纯化方法,能够得到较高纯度的产物。
同时,实验也加深了我们对重结晶原理的理解,提高了实验操作的熟练度。
实验注意事项:
1. 实验中要注意安全,避免热水和化学品溅到皮肤上;
2. 实验操作要轻柔,避免产生溅射;
3. 实验后要及时清洗实验器材,保持实验台面整洁。
以上就是本次苯甲酸的重结晶实验报告,希望能对大家有所帮助。

苯甲酸的重结晶原理苯甲酸的重结晶是一种常见的实验方法,用于纯化苯甲酸,并移除其中的杂质。
重结晶是基于物质溶解度差异的原理进行的,利用溶质在溶液中的溶解度随温度的变化而改变,实现分离纯度较高的溶质。
重结晶的步骤主要包括溶解、结晶和过滤三个阶段。
首先,将苯甲酸样品加入适量的溶剂中,通过加热使苯甲酸完全溶解。
溶解度与温度有关,一般来说,溶解度随温度的升高而增加。
因此,加热能够增加溶质的溶解度,使苯甲酸溶解于溶剂中。
在此过程中,需要控制溶液的温度和溶解度,以保证溶质能够充分溶解。
接下来,将溶液慢慢冷却,使温度逐渐下降。
冷却的过程中,溶液中的溶质溶解度会随温度的降低而降低,逐渐达到饱和状态。
当溶液中的溶质超过其溶解度时,就会发生结晶。
结晶过程需要通过控制冷却速率、搅拌和添加种子晶核等方式来促进结晶的发生和生长。
最后,将形成的结晶通过过滤等操作进行分离,得到纯净的苯甲酸固体。
过滤时,可以使用滤纸或玻璃纤维过滤器,将溶剂和溶质分离。
过滤完毕后,用冷溶剂洗涤结晶物,去除吸附在结晶表面的杂质,进一步提高苯甲酸的纯度。
整个重结晶过程是通过控制溶解度和结晶条件,使溶质在溶液中重新结晶而实现的。
溶解度差异是基于溶剂和溶质之间相互作用力的不同程度,以及温度对于溶质溶解度的影响。
在加热溶解的过程中,苯甲酸能够在溶剂中充分溶解,但随着温度的降低,溶聚物之间的相互作用力增强,导致溶质的溶解度下降,最终发生结晶。
由于杂质通常在溶解度较低的苯甲酸溶液中溶解度较高,因此通过重结晶可以有效地去除苯甲酸中的杂质,得到纯净度较高的苯甲酸。
总结起来,苯甲酸的重结晶是一种常见的分离纯化方法,基于物质溶解度差异的原理进行。
通过控制苯甲酸在溶剂中的溶解度和结晶条件,实现了纯净度较高的苯甲酸的分离纯化。
这个过程需要注意温度、搅拌和结晶条件的控制,在操作过程中要注意细致,以获得较好的分离效果。


苯甲酸的重结晶一、实验原理重结晶原理:利用溶剂对被提纯物质及杂质的溶解度不同,用适当的溶剂把含有杂质的晶体物质溶解,配制成接近沸腾的浓溶液,趁热滤去不溶性杂质,使滤液冷却析出结晶,收集晶体并干燥处理的一种联合操作过程。
二、主要试剂、仪器三、操作步骤1、预热漏斗先将玻璃漏斗放入水浴锅预热,注意:在进行热过滤操作时,也要维持玻璃漏斗的温度2、制备苯甲酸粗品的热饱和溶液在锥形瓶中放置2g粗苯甲酸,月80ml蒸馏水和2-3颗玻璃珠,置于电炉上加热至微沸,使粗苯甲酸固体溶解完全,另取一个150ml的小烧杯准备大约50ml的蒸馏水放在电炉上同时加热3、趁热过滤从水浴锅中取出预热好的玻璃漏斗,在漏斗里放一张叠好的滤纸,并用少量的热水润湿,并将热的玻璃漏斗架在已固定好铁环的铁架台上,将上述的热溶液尽快用玻璃漏斗滤入250ml的烧杯中。
(每次倒入漏斗的液体不要太满,也不要等溶液全部滤完再加,在过滤过程中应保持饱和溶液的温度)待所璃漏斗的温度实验四、苯甲酸的重结晶一、实验目的1、了解有机物重结晶提纯的原理和应用。
2、掌握加热、回流、冷却、减压过滤和恒重干燥等操作。
3、掌握折叠滤纸的作用与折叠方法。
3、掌握有机物重结晶提纯的基本步骤和操作方法。
4、掌握固体有机物干燥与否的恒重法判断方法。
二、试验原理1、基本原理将欲提纯的物质在较高温度下溶于合适的溶剂中制成饱和溶液,趁热将不溶物滤去,在较低温度下结晶析出,而可溶性杂质留在母液中,这一过程称为重结晶。
原理就是利用物质中各组分在同一溶剂中的溶解性能不同而将杂质除去。
2、一般过程选择溶剂;制饱和溶液;趁热过滤(如溶液的颜色深,则应先脱色,再趁热过滤);冷却析晶;抽气过滤;洗涤干燥。
活性炭的用量应视杂质的多少而定。
一般为干燥粗产品重量的1-5%。
3、重结晶所用溶剂要求与要提纯的物质不起化学反应;对被提纯的有机物质必须具备溶解度在热时较大,而在较低温度时则较小的特性;对杂质的溶解度非常大或非常小,溶解度大者使杂质留在母液中,不与被提纯物一道析出结晶;溶解度小者使杂质在热过滤时被除去;对要提纯的物质能生成较整齐的晶体;溶剂的沸点,不宜太低,也不宜太高。
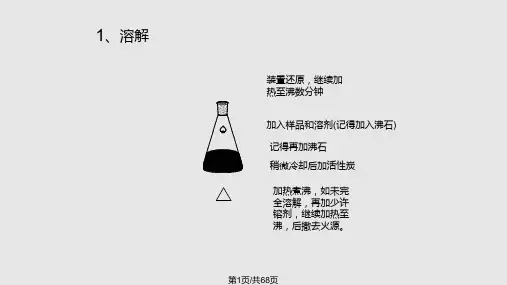


实验二苯甲酸的重结晶及测熔点一、苯甲酸的重结晶(一)实验目的1、了解重结晶原理,初步学会用重结晶方法提纯固体有机化合物;2、掌握热过滤和抽滤操作。
(二)基本原理无论天然得到的还是制备得到的固体有机物含有杂质——副产物、没反应的原料、催化剂等,需选用适当的溶剂进行重结晶提纯。
除去这些杂质最有效的方法就是重结晶。
这个方法的原理是利用固体混合物中各组分在某种溶剂中的溶解度不同,使它们相互分离,达到提纯精制的目的(把固体有机物溶解在热的溶剂中使之饱和,冷却时由于溶解度降低,有机物又重新析出晶体。
——利用溶剂对被提纯物质及杂质的溶解度不同,使被提纯物质从过饱和溶液中析出。
让杂质全部或大部分留在溶液中,从而达到提纯的目的)。
注意——重结晶只适宜杂质含量在5%以下的固体有机混合物的提纯。
从反应粗产物直接重结晶是不适宜的,必须先采取其他方法初步提纯,然后再重结晶提纯。
(三)实验学时:4学时。
(四) 仪器、药品量筒100毫升1个烧杯150毫升1个布氏漏斗1个吸滤瓶250毫升1个表面皿10厘米1个温度计200 ℃1个齐列管1个锥形瓶150毫升1个苯甲酸粗品1.5克活性炭少量液体石蜡(测熔点用的浴液)(五)实验步骤1、选择适当的溶剂理想溶剂具备的条件,查手册、资料或通过实验来决定。
2、制饱和溶液在溶剂沸点温度下,将被提纯物制成饱和溶液。
怎么制?然后再多加20%的溶剂。
(过多会损失,过少会析出。
有机溶剂需要回流装置)。
若溶液含有色杂质,要加活性炭脱色。
(用量为粗产品质量的1%—5%)——待溶液稍冷后加活性炭!!煮沸5~10分钟。
3、热过滤方法一:用热水漏斗趁热过滤,见装置。
(预先加热漏斗,叠菊花滤纸,准备锥形瓶接收滤液,减少溶剂挥发用的表面皿)。
若用有机溶剂,过滤时应先熄灭火焰或使用档火板。
方法二:可把布氏漏斗预先烘热,然后便可趁热过滤。
可避免晶体析出而损失。
上述两种方法在过滤时,应先用溶剂润湿滤纸,以免结晶析出而阻塞滤纸孔。

苯甲酸重结晶实验报告
实验目的,通过苯甲酸重结晶实验,掌握固体的重结晶方法,提高结晶的纯度。
实验原理,苯甲酸是一种有机化合物,其在水中的溶解度随温度的升高而增大。
在实验中,首先将苯甲酸加热至溶解,然后慢慢冷却,使其结晶沉淀出来,最后进行过滤、洗涤、干燥,得到苯甲酸的结晶。
实验步骤:
1. 取一定量的苯甲酸放入烧杯中;
2. 加入适量的蒸馏水,加热搅拌至苯甲酸完全溶解;
3. 将溶液慢慢冷却至室温,观察结晶的生成;
4. 用玻璃棒搅拌结晶,使其充分析出;
5. 过滤结晶,用冷蒸馏水洗涤,将结晶物干燥至恒定质量。
实验数据:
取样重量(g)|溶解重量(g)|结晶重量(g)|收率(%)。
--------------|--------------|--------------|---------。
10|8.5|7.2|72%。
实验结果分析,通过实验数据可以看出,苯甲酸的重结晶收率为72%,说明实
验操作基本正确,结晶物的纯度较高。
实验结论,通过本次实验,掌握了苯甲酸重结晶的基本方法,提高了对固体重
结晶的理解,为今后的实验操作打下了基础。
实验注意事项:
1. 实验中要注意安全,避免苯甲酸的接触和吸入;
2. 操作过程中要小心,避免溅出;
3. 实验后要及时清洗玻璃仪器,保持实验台面的整洁。
通过本次实验,我对苯甲酸重结晶有了更深入的了解,也提高了实验操作的技能。
希望今后能够运用这些知识,更好地进行实验研究。
实验七苯甲酸的重结晶一、实验目的1. 学习和熟悉固体溶解,热过滤,减压过滤等基本操作;2. 通过苯甲酸重结晶实验,理解固体有机物重结晶提纯的原理及意义。
二、基本原理无论是天然的或有机合成的固体化合物,往往是不纯的,夹杂着少量的其它化合物,通常称为杂质。
从有机合成反应分离出来的固体粗产物往往含有未反应的原料、副产物及杂质,必须加以分离纯化。
纯化这类固体物质的有效而简便的方法是用合适的溶剂进行重结晶。
这是每个有机化学工作者应该掌握的最有用的实验技巧之一。
重结晶是利用被提纯物和杂质的溶解度及各自在混合物中的含量不同而进行的一种分离纯化方法。
绝大多数固体化合物在溶剂中的溶解度随温度的升高而增大,随温度的下降而减小。
通常混合物中,被提纯物为主要成分,其含量较高,容易配制成热的饱和溶液,而此时杂质则远未达到饱和溶液。
因此,当热的饱和溶液冷却时,被提纯的物质由于溶解度下降会结晶出来,而杂质则全部或部分留在溶液中(若杂质在溶剂中的溶解度极小,则配成热饱和溶液后被过滤除去),这样便达到了提纯的目的。
重结晶适用于提纯杂质含量在5%以下的固体化合物,杂质含量过多,常会影响提纯效果,须经多次重结晶才能提纯。
因此,常用其它方法如:水蒸气蒸馏,萃取等手段先将粗产品初步化,然后再用重结晶法提纯。
三、仪器和药品仪器:烧杯、酒精灯、热漏斗、滤纸、无颈漏斗、布氏漏斗、抽滤瓶、表面皿、玻棒、量筒、水循环真空泵药品:苯甲酸、活性碳四、基本操作1.选择溶剂正确选择溶剂是进行重结晶的前提,对于确保重结晶纯化目的的实现,具有重要的意义。
理想的重结晶溶剂应具备以下条件:①不与被提纯物质发生化学反应;②提纯物质在该溶剂中的溶解度,随温度的变化有显著的差异。
一般在溶剂沸点附近的溶解度比室温时至少要大3倍。
③溶剂对被提纯物和杂质的溶解度差异较大。
最好是杂质在热溶剂中的溶解度很小(热过滤时可除去)。
或者在低温时溶解度很大,冷却后不会随样品结晶出来。
④被提纯物质在溶剂中能够形成良好的结晶。
实验二苯甲酸的重结晶及测熔点一、苯甲酸的重结晶(一)实验目的1、了解重结晶原理,初步学会用重结晶方法提纯固体有机化合物;2、掌握热过滤和抽滤操作。
(二)基本原理无论天然得到的还是制备得到的固体有机物含有杂质——副产物、没反应的原料、催化剂等,需选用适当的溶剂进行重结晶提纯。
除去这些杂质最有效的方法就是重结晶。
这个方法的原理是利用固体混合物中各组分在某种溶剂中的溶解度不同,使它们相互分离,达到提纯精制的目的(把固体有机物溶解在热的溶剂中使之饱和,冷却时由于溶解度降低,有机物又重新析出晶体。
——利用溶剂对被提纯物质及杂质的溶解度不同,使被提纯物质从过饱和溶液中析出。
让杂质全部或大部分留在溶液中,从而达到提纯的目的)。
注意——重结晶只适宜杂质含量在5%以下的固体有机混合物的提纯。
从反应粗产物直接重结晶是不适宜的,必须先采取其他方法初步提纯,然后再重结晶提纯。
(三)实验学时:4学时。
(四) 仪器、药品量筒100毫升1个烧杯150毫升1个布氏漏斗1个吸滤瓶250毫升1个表面皿10厘米1个温度计200 ℃1个齐列管1个锥形瓶150毫升1个苯甲酸粗品 1.5克活性炭少量液体石蜡(测熔点用的浴液)(五)实验步骤1、选择适当的溶剂理想溶剂具备的条件,查手册、资料或通过实验来决定。
2、制饱和溶液在溶剂沸点温度下,将被提纯物制成饱和溶液。
怎么制?然后再多加20%的溶剂。
(过多会损失,过少会析出。
有机溶剂需要回流装置)。
若溶液含有色杂质,要加活性炭脱色。
(用量为粗产品质量的1%—5%)——待溶液稍冷后加活性炭!!煮沸5~10分钟。
3、热过滤方法一:用热水漏斗趁热过滤,见装置。
(预先加热漏斗,叠菊花滤纸,准备锥形瓶接收滤液,减少溶剂挥发用的表面皿)。
若用有机溶剂,过滤时应先熄灭火焰或使用档火板。
方法二:可把布氏漏斗预先烘热,然后便可趁热过滤。
可避免晶体析出而损失。
上述两种方法在过滤时,应先用溶剂润湿滤纸,以免结晶析出而阻塞滤纸孔。
苯甲酸的重结晶实验报告竭诚为您提供优质文档/双击可除苯甲酸的重结晶实验报告篇一:苯甲酸重结晶实验报告苯甲酸的重结晶实验目的:了解重结晶提纯粗苯甲酸的原理和方法。
实验原理:苯甲酸在水中的溶解度随温度的变化较大,通过重结晶可以使它与杂质分离,从实验试剂:粗苯甲酸(本实验中的药品混有氯化钠和少量泥沙)、Agno3溶液、蒸馏水实验仪器、用品:烧杯、铁架台(带铁圈)、酒精灯、普通漏斗、玻璃棒、坩埚钳、滤纸、石棉网、药匙、三脚架、试管、胶头滴管、火柴。
实验步骤:一、热溶解①取约0.5g粗苯甲酸晶体置于100mL烧杯中,加入50mL 蒸馏水。
②在三脚架上垫一石棉网,将烧杯放在石棉网上,点燃酒精灯加热,不时用玻璃棒搅拌(注意:搅拌时玻璃棒不要触及烧杯内壁)。
③待粗苯甲酸全部溶解,停止加热。
二、热过滤①将准备好的过滤器放在铁架台的铁圈上,过滤器下放一小烧杯。
②将烧杯中的混合液趁热过滤。
(过滤时可用坩埚钳夹住烧杯,避免烫手),使滤液沿玻璃棒缓缓注入过滤器中。
三、冷却结晶将滤液静置冷却,观察烧杯中晶体的析出。
(在静置冷却的同时,再准备好一个过滤器)。
四、过滤洗涤①将析出苯甲酸晶体的混合液过滤,滤纸上为苯甲酸晶体。
②取2mL滤液于一支试管中,检验其中的氯离子。
③用适量蒸馏水洗涤过滤器中的苯甲酸晶体,另取一烧杯收集第二次洗涤液,并检验其中是否还存在氯离子。
注意事项:加热后的烧杯不要直接放在实验台上,以免损坏实验台。
使用坩埚钳进行趁热过滤时,注意使烧杯保持适当的倾斜角度,同时注意安全,防止烫伤。
不要用手直接接触刚加热过的烧杯、三脚架。
用自来水洗涤烧杯、玻璃棒后,要用蒸馏水润洗,以免引入氯离子。
讨论:该实验为什么在粗苯甲酸全溶后,还要加少量蒸馏水?答:因溶液过滤时溶液与环境的温差较大,易使苯甲酸晶体提前析出,滞留在过滤器中,故需在过滤前适当稀释。
被溶解的粗苯甲酸为什么要趁热过滤?答:若待冷却后过滤,就会有苯甲酸提前结晶析出。
苯甲酸的重结晶实验目的:了解重结晶提纯粗苯甲酸的原理和方法。
实验原理:苯甲酸在水中的溶解度随温度的变化较大,通过重结晶可以使它与杂质分离,从而达到分离提纯的目的。
实验试剂:粗苯甲酸(本实验中的药品混有氯化钠和少量泥沙)、AgNO3溶液、蒸馏水实验仪器、用品:烧杯、铁架台(带铁圈)、酒精灯、普通漏斗、玻璃棒、坩埚钳、滤纸、石棉网、药匙、三脚架、试管、胶头滴管、火柴。
实验步骤:一、热溶解①取约0.5g粗苯甲酸晶体置于100mL烧杯中,加入50mL蒸馏水。
②在三脚架上垫一石棉网,将烧杯放在石棉网上,点燃酒精灯加热,不时用玻璃棒搅拌(注意:搅拌时玻璃棒不要触及烧杯内壁)。
③待粗苯甲酸全部溶解,停止加热。
二、热过滤①将准备好的过滤器放在铁架台的铁圈上,过滤器下放一小烧杯。
②将烧杯中的混合液趁热过滤。
(过滤时可用坩埚钳夹住烧杯,避免烫手),使滤液沿玻璃棒缓缓注入过滤器中。
三、冷却结晶将滤液静置冷却,观察烧杯中晶体的析出。
(在静置冷却的同时,再准备好一个过滤器)。
四、过滤洗涤①将析出苯甲酸晶体的混合液过滤,滤纸上为苯甲酸晶体。
②取2mL滤液于一支试管中,检验其中的氯离子。
③用适量蒸馏水洗涤过滤器中的苯甲酸晶体,另取一烧杯收集第二次洗涤液,并检验其中是否还存在氯离子。
注意事项:加热后的烧杯不要直接放在实验台上,以免损坏实验台。
使用坩埚钳进行趁热过滤时,注意使烧杯保持适当的倾斜角度,同时注意安全,防止烫伤。
不要用手直接接触刚加热过的烧杯、三脚架。
用自来水洗涤烧杯、玻璃棒后,要用蒸馏水润洗,以免引入氯离子。
讨论:该实验为什么在粗苯甲酸全溶后,还要加少量蒸馏水?答:因溶液过滤时溶液与环境的温差较大,易使苯甲酸晶体提前析出,滞留在过滤器中,故需在过滤前适当稀释。
被溶解的粗苯甲酸为什么要趁热过滤?答:若待冷却后过滤,就会有苯甲酸提前结晶析出。
为什么滤液需在静置条件下缓慢结晶?答:静置条件是为了得到均匀而较大晶体。
急速冷却滤液形成的结晶很小,表面积大,吸附的杂质多。
### 实验目的了解重结晶提纯粗苯甲酸的原理和方法。
### 实验原理苯甲酸在水中的溶解度随温度的变化较大。
在高温下,苯甲酸溶解度较高;而在低温下,溶解度较低。
通过重结晶,可以使苯甲酸与杂质分离,从而达到提纯的目的。
### 实验试剂- 粗苯甲酸(本实验中的药品混有氯化钠和少量泥沙)- AgNO3溶液- 蒸馏水### 实验仪器、用品- 烧杯- 铁架台(带铁圈)- 酒精灯- 普通漏斗- 玻璃棒- 坩埚钳- 滤纸- 石棉网- 药匙- 三脚架- 试管- 胶头滴管- 火柴### 实验步骤1. 热溶解:- 取约0.5g粗苯甲酸晶体置于100mL烧杯中,加入50mL蒸馏水。
- 在三脚架上垫一石棉网,将烧杯放在石棉网上,点燃酒精灯加热,不时用玻璃棒搅拌(注意:搅拌时玻璃棒不要触及烧杯内壁)。
- 待粗苯甲酸全部溶解,停止加热。
2. 热过滤:- 将准备好的过滤器放在铁架台的铁圈上,过滤器下放一小烧杯。
- 将烧杯中的混合液趁热过滤。
(过滤时可用坩埚钳夹住烧杯,避免烫手),使滤液沿玻璃棒缓缓注入过滤器中。
3. 冷却结晶:- 将滤液静置冷却,观察烧杯中晶体的析出。
(在静置冷却的同时,再准备好一个过滤器)。
4. 过滤洗涤:- 将析出苯甲酸晶体的混合液过滤,滤纸上为苯甲酸晶体。
- 取2mL滤液于一支试管中,检验其中的氯离子。
- 用适量蒸馏水洗涤过滤器中的苯甲酸晶体,另取一烧杯。
### 实验结果通过重结晶实验,成功提纯了苯甲酸,实现了与杂质的分离。
### 实验总结苯甲酸的重结晶实验是一种有效的提纯方法,通过控制温度和溶解度,可以实现对苯甲酸的提纯。
在实际应用中,该方法具有广泛的适用性。