苯甲酸的重结晶PPT
- 格式:ppt
- 大小:1.57 MB
- 文档页数:19

实验四、苯甲酸的重结晶
一、实验目的
1、掌握有机物重结晶提纯的原理和方法。
2、掌握加热、冷却、减压过滤和恒重干燥等操作。
3、掌握折叠滤纸的作用与折叠方法。
二、原理
将欲提纯的物质在较高温度下溶于合适的溶剂中制成饱和溶液,趁热将不溶物滤去,在较低温度下结晶析出,而可溶性杂质留在母液中,这一过程称为重结晶。
重结晶的原理就是利用混合物中各组分在同一溶剂中的溶解度不同以及溶解度随温度的变化而变化,从而将杂质除去。
三、仪器和药品
四、实验内容
1称取3g粗苯甲酸于锥形瓶中,加入40mL水加热搅拌至沸腾,若不完全溶解,可在沸腾状态下适量添加水直至完全溶解,最后加水量控制在60mL。
若样品液有颜色(非样品本身的颜色),在溶液温度稍冷时,加入粗样品重量的1-5%的活性碳,搅拌使混合均匀,继续加热煮沸5-10分钟。
2趁热用热水漏斗和折叠滤纸过滤,滤毕,用少量的热水洗涤烧杯和滤纸。
3用表面皿将盛滤液的锥形瓶盖好,于自来水中冷却结晶。
4抽滤,并以少量水洗涤晶体2次。
5取出晶体(连同滤纸)放在表面皿上凉干。
6称重,计算得率。

实验一苯甲酸的重结晶一、实验目的1、熟悉重结晶法提纯有机化合物的原理、方法和溶剂的选择。
2、掌握溶解、饱和溶液配制、抽滤、脱色、热过滤、结晶等实验基本操作技术。
二、基本原理(略,详见实验指导中的相关内容。
P61-64; P46-51)三、实验仪器真空循环水泵、三角锥瓶150ml、布氏漏斗、抽滤瓶、滤纸、烧杯100ml、表面皿、剪刀、水浴锅、电炉、红外灯。
四、实验操作步骤(1)溶解:称取需提纯的苯甲酸1.0g、放入150ml的三角烧瓶中并加入50ml水,电炉加热,并不断摇动使之溶解。
(2)脱色:三角烧瓶脱离电炉,微冷却后加入半药勺活性炭。
用电炉加热至沸腾3-5分钟。
(3)热过滤:将有色溶液用沟型滤纸热过滤,得到脱色滤液。
(4)结晶:热过滤得到的滤液,自然冷却至结晶析出后,可用冰水冷却至结晶完全析出。
(5)抽滤:用减压抽滤装置除去母液,使晶体完全转移,并用玻璃盖压紧结晶滤饼。
(6)洗涤:用 5ml蒸馏水均匀润洒洗涤滤饼、减压抽干。
重复洗涤一次,再减压抽干。
然后用不锈钢勺将结晶转移至一块表面皿上。
(7)干燥:将结晶移至红外灯下干燥,干燥后称重,计算转化率。
注意事项:1.不能在沸腾的溶液中加入活性炭(因为活性炭是多孔性物质),否则会引起暴沸,使溶液冲出容器造成产品损失。
2.脱色时有色溶液需趁热过滤,除溶液保温外,漏斗、锥瓶都应保温(如何操作)。
3.脱色不成功,可将滤纸及溶液一起放入锥瓶重新溶解,换滤纸,二次热过滤。
4.烧杯中溶液应自然冷却、有晶体出现后,再用冷水浴冷却,待晶体完全析出,进行减压抽滤(固液分离); 抽滤时需将样品搅拌,使晶体与母液搅混后再转移、抽滤。
5.洗涤晶体时,要先断开减压(为什么?)。



实验五苯甲酸的重结晶和过滤一、实验目的1.了解有机物重结晶提纯的原理和应用;2.掌握有机物重结晶提纯的基本步骤和操作方法。
二、实验原理重结晶是利用被提纯物和杂质的溶解度及各自在混合物中的含量不同而进行的一种分离纯化方法。
绝大多数固体化合物在溶剂中的溶解度随温度的升高而增大,随温度的下降而减小。
通常混合物中,被提纯物为主要成分,其含量较高,容易配制成热的饱和溶液,而此时杂质则远未达到饱和溶液。
因此,当热的饱和溶液冷却时,被提纯的物质由于溶解度下降会结晶出来,而杂质则全部或部分留在溶液中(容杂质在溶剂中的溶解度极小,则配成热饱和溶液后被过滤除去),三、试剂和仪器仪器:烧杯50ml、100ml各1个,电炉1个,石棉网1个,滤纸若干,普通漏斗1个,表面皿1个,玻璃棒1个,水循环真空泵公用2-3台,布氏漏斗1台/2-3组,抽滤瓶1台/2-3组,水浴锅公用2-3台,药勺若干,托盘天平1台/2-3组。
试剂:苯甲酸粗品大于3g。
四、实验步骤1、称样:将2.0g粗苯甲酸固体样品溶解在100ml烧杯中,边加热边搅拌,至完全溶解;同时准备好热水。
2、溶解粗苯甲酸和烧热水:将2.0g粗苯甲酸固体样品溶解在100ml烧杯中,边加热边搅拌,至完全溶解;同时准备好热水。
3、趁热过滤:取预热好的普通漏斗,在漏斗里放好一张叠好的滤纸,用少量热水润湿,将玻璃漏斗架在固定好的铁架台上,将上述热溶液尽快用玻璃漏斗滤入100ml烧杯中,待所有溶液过滤完毕后,用少量的热水洗涤烧杯和滤纸。
注意:趁热用热滤漏斗或布氏漏斗过滤,除去不溶性杂质。
每次倒入漏斗的溶液不要太满,盛剩余溶液的烧杯放在石棉网上继续用小火加热,以防结晶析出。
溶液过滤之后用少量热水洗涤滤纸和烧杯。
4、冷却、结晶:滤毕,用表面皿将盛有滤液的烧杯改好,静置,稍冷后用冷水冷却,使其结晶完全。
5、抽滤:结晶结束后,用布氏漏斗抽湿(滤纸用少量冷水润湿、吸紧),使晶体和母液分离,停止抽气加少量冷水至布氏漏斗中,使晶体润湿,然后重新抽干,如此重复1-2次,然后用药勺将提纯后的苯甲酸晶体(白色鳞片状)移至表面皿上晾干。

苯甲酸的重结晶一、实验原理重结晶原理:利用溶剂对被提纯物质及杂质的溶解度不同,用适当的溶剂把含有杂质的晶体物质溶解,配制成接近沸腾的浓溶液,趁热滤去不溶性杂质,使滤液冷却析出结晶,收集晶体并干燥处理的一种联合操作过程。
二、主要试剂、仪器三、操作步骤1、预热漏斗先将玻璃漏斗放入水浴锅预热,注意:在进行热过滤操作时,也要维持玻璃漏斗的温度2、制备苯甲酸粗品的热饱和溶液在锥形瓶中放置2g粗苯甲酸,月80ml蒸馏水和2-3颗玻璃珠,置于电炉上加热至微沸,使粗苯甲酸固体溶解完全,另取一个150ml的小烧杯准备大约50ml的蒸馏水放在电炉上同时加热3、趁热过滤从水浴锅中取出预热好的玻璃漏斗,在漏斗里放一张叠好的滤纸,并用少量的热水润湿,并将热的玻璃漏斗架在已固定好铁环的铁架台上,将上述的热溶液尽快用玻璃漏斗滤入250ml的烧杯中。
(每次倒入漏斗的液体不要太满,也不要等溶液全部滤完再加,在过滤过程中应保持饱和溶液的温度)待所璃漏斗的温度实验四、苯甲酸的重结晶一、实验目的1、了解有机物重结晶提纯的原理和应用。
2、掌握加热、回流、冷却、减压过滤和恒重干燥等操作。
3、掌握折叠滤纸的作用与折叠方法。
3、掌握有机物重结晶提纯的基本步骤和操作方法。
4、掌握固体有机物干燥与否的恒重法判断方法。
二、试验原理1、基本原理将欲提纯的物质在较高温度下溶于合适的溶剂中制成饱和溶液,趁热将不溶物滤去,在较低温度下结晶析出,而可溶性杂质留在母液中,这一过程称为重结晶。
原理就是利用物质中各组分在同一溶剂中的溶解性能不同而将杂质除去。
2、一般过程选择溶剂;制饱和溶液;趁热过滤(如溶液的颜色深,则应先脱色,再趁热过滤);冷却析晶;抽气过滤;洗涤干燥。
活性炭的用量应视杂质的多少而定。
一般为干燥粗产品重量的1-5%。
3、重结晶所用溶剂要求与要提纯的物质不起化学反应;对被提纯的有机物质必须具备溶解度在热时较大,而在较低温度时则较小的特性;对杂质的溶解度非常大或非常小,溶解度大者使杂质留在母液中,不与被提纯物一道析出结晶;溶解度小者使杂质在热过滤时被除去;对要提纯的物质能生成较整齐的晶体;溶剂的沸点,不宜太低,也不宜太高。

一、实验原理令狐采学重结晶原理:利用溶剂对被提纯物质及杂质的溶解度不同,用适当的溶剂把含有杂质的晶体物质溶解,配制成接近沸腾的浓溶液,趁热滤去不溶性杂质,使滤液冷却析出结晶,收集晶体并干燥处理的一种联合操作过程。
二、主要试剂、仪器三、操作步骤1、预热漏斗先将玻璃漏斗放入水浴锅预热,注意:在进行热过滤操作时,也要维持玻璃漏斗的温度 2、制备苯甲酸粗品的热饱和溶液在锥形瓶中放置2g粗苯甲酸,月80ml蒸馏水和2-3颗玻璃珠,置于电炉上加热至微沸,使粗苯甲酸固体溶解完全,另取一个150ml的小烧杯准备大约50ml 的蒸馏水放在电炉上同时加热 3、趁热过滤从水浴锅中取出预热好的玻璃漏斗,在漏斗里放一张叠好的滤纸,并用少量的热水润湿,并将热的玻璃漏斗架在已固定好铁环的铁架台上,将上述的热溶液尽快用玻璃漏斗滤入250ml的烧杯中。
(每次倒入漏斗的液体不要太满,也不要等溶液全部滤完再加,在过滤过程中应保持饱和溶液的温度)待所有溶液过滤完毕后,用少量的热水洗涤锥形瓶和滤纸4、冷却结晶滤毕,用表面皿将盛有滤液的烧杯盖好,放置一旁,稍冷后用冷水冷却,以使其尽快结晶完全5、抽滤结晶完全后,用布氏漏斗抽湿(滤纸用少量冷水润湿、吸紧),使晶体和母液分离,停止抽气加少量冷水至布氏漏斗中,使晶体润湿,然后重新抽干,如此重复1-2次,最后用药勺将提纯后的苯甲酸晶体(白色鳞片状)移至表面皿上晾干 6、称重;提纯后的苯甲酸、、、、g;计算产率:纯、粗*100四、实验现象 1、苯甲酸在加热过程中逐渐溶解至锥形瓶中没有未溶物。
2、在趁热过滤过程中有晶体析出,漏斗中的滤纸上也有残留小部分晶体未能过滤3、在冷却过程中烧杯中出现大量白色晶体 4、抽滤过程中,晶体中得水分逐渐减少,并出现小块状五、实验结果与讨论 1、提纯后的苯甲酸更洁白更细腻,质量比原来的粗苯甲酸略少2、在重结晶实验过程中如何提高产品的产率。
3、在操作过程中如何才能更好地控制饱和溶液和玻璃漏斗的温度实验四、苯甲酸的重结晶一、实验目的1、了解有机物重结晶提纯的原理和应用。
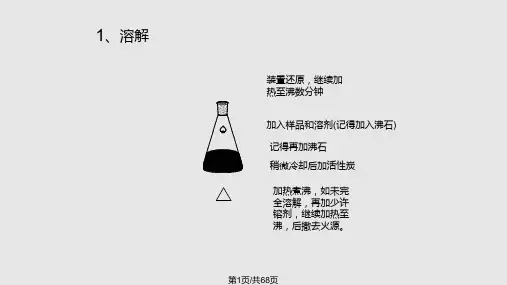

实验七苯甲酸的重结晶一、实验目的1. 学习和熟悉固体溶解,热过滤,减压过滤等基本操作;2. 通过苯甲酸重结晶实验,理解固体有机物重结晶提纯的原理及意义。
二、基本原理无论是天然的或有机合成的固体化合物,往往是不纯的,夹杂着少量的其它化合物,通常称为杂质。
从有机合成反应分离出来的固体粗产物往往含有未反应的原料、副产物及杂质,必须加以分离纯化。
纯化这类固体物质的有效而简便的方法是用合适的溶剂进行重结晶。
这是每个有机化学工作者应该掌握的最有用的实验技巧之一。
重结晶是利用被提纯物和杂质的溶解度及各自在混合物中的含量不同而进行的一种分离纯化方法。
绝大多数固体化合物在溶剂中的溶解度随温度的升高而增大,随温度的下降而减小。
通常混合物中,被提纯物为主要成分,其含量较高,容易配制成热的饱和溶液,而此时杂质则远未达到饱和溶液。
因此,当热的饱和溶液冷却时,被提纯的物质由于溶解度下降会结晶出来,而杂质则全部或部分留在溶液中(若杂质在溶剂中的溶解度极小,则配成热饱和溶液后被过滤除去),这样便达到了提纯的目的。
重结晶适用于提纯杂质含量在5%以下的固体化合物,杂质含量过多,常会影响提纯效果,须经多次重结晶才能提纯。
因此,常用其它方法如:水蒸气蒸馏,萃取等手段先将粗产品初步化,然后再用重结晶法提纯。
三、仪器和药品仪器:烧杯、酒精灯、热漏斗、滤纸、无颈漏斗、布氏漏斗、抽滤瓶、表面皿、玻棒、量筒、水循环真空泵药品:苯甲酸、活性碳四、基本操作1.选择溶剂正确选择溶剂是进行重结晶的前提,对于确保重结晶纯化目的的实现,具有重要的意义。
理想的重结晶溶剂应具备以下条件:①不与被提纯物质发生化学反应;②提纯物质在该溶剂中的溶解度,随温度的变化有显著的差异。
一般在溶剂沸点附近的溶解度比室温时至少要大3倍。
③溶剂对被提纯物和杂质的溶解度差异较大。
最好是杂质在热溶剂中的溶解度很小(热过滤时可除去)。
或者在低温时溶解度很大,冷却后不会随样品结晶出来。
④被提纯物质在溶剂中能够形成良好的结晶。

实验二苯甲酸的重结晶及测熔点一、苯甲酸的重结晶(一)实验目的1、了解重结晶原理,初步学会用重结晶方法提纯固体有机化合物;2、掌握热过滤和抽滤操作。
(二)基本原理无论天然得到的还是制备得到的固体有机物含有杂质——副产物、没反应的原料、催化剂等,需选用适当的溶剂进行重结晶提纯。
除去这些杂质最有效的方法就是重结晶。
这个方法的原理是利用固体混合物中各组分在某种溶剂中的溶解度不同,使它们相互分离,达到提纯精制的目的(把固体有机物溶解在热的溶剂中使之饱和,冷却时由于溶解度降低,有机物又重新析出晶体。
——利用溶剂对被提纯物质及杂质的溶解度不同,使被提纯物质从过饱和溶液中析出。
让杂质全部或大部分留在溶液中,从而达到提纯的目的)。
注意——重结晶只适宜杂质含量在5%以下的固体有机混合物的提纯。
从反应粗产物直接重结晶是不适宜的,必须先采取其他方法初步提纯,然后再重结晶提纯。
(三)实验学时:4学时。
(四) 仪器、药品量筒100毫升1个烧杯150毫升1个布氏漏斗1个吸滤瓶250毫升1个表面皿10厘米1个温度计200 ℃1个齐列管1个锥形瓶150毫升1个苯甲酸粗品1.5克活性炭少量液体石蜡(测熔点用的浴液)(五)实验步骤1、选择适当的溶剂理想溶剂具备的条件,查手册、资料或通过实验来决定。
2、制饱和溶液在溶剂沸点温度下,将被提纯物制成饱和溶液。
怎么制?然后再多加20%的溶剂。
(过多会损失,过少会析出。
有机溶剂需要回流装置)。
若溶液含有色杂质,要加活性炭脱色。
(用量为粗产品质量的1%—5%)——待溶液稍冷后加活性炭!!煮沸5~10分钟。
3、热过滤方法一:用热水漏斗趁热过滤,见装置。
(预先加热漏斗,叠菊花滤纸,准备锥形瓶接收滤液,减少溶剂挥发用的表面皿)。
若用有机溶剂,过滤时应先熄灭火焰或使用档火板。
方法二:可把布氏漏斗预先烘热,然后便可趁热过滤。
可避免晶体析出而损失。
上述两种方法在过滤时,应先用溶剂润湿滤纸,以免结晶析出而阻塞滤纸孔。

实验二苯甲酸的重结晶及测熔点一、苯甲酸的重结晶(一)实验目的1、了解重结晶原理,初步学会用重结晶方法提纯固体有机化合物;2、掌握热过滤和抽滤操作。
(二)基本原理无论天然得到的还是制备得到的固体有机物含有杂质——副产物、没反应的原料、催化剂等,需选用适当的溶剂进行重结晶提纯。
除去这些杂质最有效的方法就是重结晶。
这个方法的原理是利用固体混合物中各组分在某种溶剂中的溶解度不同,使它们相互分离,达到提纯精制的目的(把固体有机物溶解在热的溶剂中使之饱和,冷却时由于溶解度降低,有机物又重新析出晶体。
——利用溶剂对被提纯物质及杂质的溶解度不同,使被提纯物质从过饱和溶液中析出。
让杂质全部或大部分留在溶液中,从而达到提纯的目的)。
注意——重结晶只适宜杂质含量在5%以下的固体有机混合物的提纯。
从反应粗产物直接重结晶是不适宜的,必须先采取其他方法初步提纯,然后再重结晶提纯。
(三)实验学时:4学时。
(四) 仪器、药品量筒100毫升1个烧杯150毫升1个布氏漏斗1个吸滤瓶250毫升1个表面皿10厘米1个温度计200 ℃1个齐列管1个锥形瓶150毫升1个苯甲酸粗品 1.5克活性炭少量液体石蜡(测熔点用的浴液)(五)实验步骤1、选择适当的溶剂理想溶剂具备的条件,查手册、资料或通过实验来决定。
2、制饱和溶液在溶剂沸点温度下,将被提纯物制成饱和溶液。
怎么制?然后再多加20%的溶剂。
(过多会损失,过少会析出。
有机溶剂需要回流装置)。
若溶液含有色杂质,要加活性炭脱色。
(用量为粗产品质量的1%—5%)——待溶液稍冷后加活性炭!!煮沸5~10分钟。
3、热过滤方法一:用热水漏斗趁热过滤,见装置。
(预先加热漏斗,叠菊花滤纸,准备锥形瓶接收滤液,减少溶剂挥发用的表面皿)。
若用有机溶剂,过滤时应先熄灭火焰或使用档火板。
方法二:可把布氏漏斗预先烘热,然后便可趁热过滤。
可避免晶体析出而损失。
上述两种方法在过滤时,应先用溶剂润湿滤纸,以免结晶析出而阻塞滤纸孔。
实验名称:苯甲酸的重结晶一、实验目的1、了解重结晶原理,初步学会用重结晶方法提纯固体有机化合物;2、掌握热过滤和抽滤操作。
二、基本原理无论天然得到的还是制备得到的固体有机物含有杂质——副产物、没反应的原料、催化剂等,需选用适当的溶剂进行重结晶提纯。
除去这些杂质最有效的方法就是重结晶。
这个方法的原理是利用固体混合物中各组分在某种溶剂中的溶解度不同,使它们相互分离,达到提纯精制的目的(把固体有机物溶解在热的溶剂中使之饱和,冷却时由于溶解度降低,有机物又重新析出晶体。
——利用溶剂对被提纯物质及杂质的溶解度不同,使被提纯物质从过饱和溶液中析出。
让杂质全部或大部分留在溶液中,从而达到提纯的目的)。
三、仪器、药品量筒、烧杯、布氏漏斗、吸滤瓶、表面皿、温度计、锥形瓶、苯甲酸1.5克、活性炭少量四、试验步骤1、选择适当的溶剂理想溶剂具备的条件,查手册、资料或通过实验来决定。
2、制饱和溶液在溶剂沸点温度下,将被提纯物制成饱和溶液。
怎么制?然后再多加20%的溶剂。
(过多会损失,过少会析出。
有机溶剂需要回流装置)。
若溶液含有色杂质,要加活性炭脱色。
(用量为粗产品质量的1%—5%)——待溶液稍冷后加活性炭!!煮沸5~10分钟3、热过滤方法一:用热水漏斗趁热过滤,见装置。
(预先加热漏斗,叠菊花滤纸,准备锥形瓶接收滤液,减少溶剂挥发用的表面皿)。
若用有机溶剂,过滤时应先熄灭火焰或使用档火板。
方法二:可把布氏漏斗预先烘热,然后便可趁热过滤。
可避免晶体析出而损失。
上述两种方法在过滤时,应先用溶剂润湿滤纸,以免结晶析出而阻塞滤纸孔。
4、结晶滤液放置冷却,析出结晶。
静大动小(为得到颗粒大,晶形均匀的晶体,应使滤滤液任其自行冷却不要搅动。
5、抽滤介绍循环水泵,安全瓶,滤纸的直径应小于布氏漏斗内径!!抽滤后,打开安全伐停止抽滤。
用少量溶剂润湿晶体,继续抽滤,干燥。
五,实验操作1.称取3 g苯甲酸粗品, 放在150 ml的锥形瓶中, 加水80 ml放入几粒沸石,加热至沸腾,并用玻璃棒不断搅拌,使固体溶解。
.
;.
苯甲酸的重结晶
在250 mL锥形瓶中加入2 g粗苯甲酸、适量水和2粒沸石,加热至微沸。
在加热
过程中不断搅拌,使固体溶解。
若在沸腾状态下尚未完全溶解,可每次加入3~5 mL 水,加热搅拌至溶解,但要特别注意粗品中是否含有不溶杂质,以免溶剂加入过多。
待固体全部溶解后再多加20 %的水。
移去热源,稍冷后加入少量活性炭,继续加热煮沸5~10 min。
在加热溶解粗苯甲酸的同时,准备好热过滤用的布氏漏斗和吸滤瓶,使它们充分预热(可置于热水中),剪好滤纸备用。
待上述粗苯甲酸的沸腾溶液准备好后,迅速(1~2 min内)将抽滤装置安装连接好,并将滤纸用热水浸湿抽紧。
将溶解好的粗苯甲酸热溶液尽快倒入漏斗中,再迅速抽滤。
将滤液迅速转移到另一个干净的100 mL小烧杯中,放置冷却结晶。
如果希望得到颗粒较大的晶体,可将滤液重新加热至溶,再在室温下慢慢冷却。
充分冷却结晶后,抽滤出晶体,用空心塞挤压,以尽量除去母液。
停止抽滤,加少量水至漏斗中,使晶体完全润湿(可用玻棒或刮刀松动),然后重新抽干。
如此重复l~2次。
最后将晶体移到表面皿上,摊开放在红外灯下烘干。
称重并计算回收率。
测定已干燥的苯甲酸的熔点,纯苯甲酸为无色针状晶体,熔点是122.4 ℃。
苯甲酸在水中的溶解度。