聚乙二醇干扰素α-2b 注射剂说明书
- 格式:pdf
- 大小:558.69 KB
- 文档页数:15


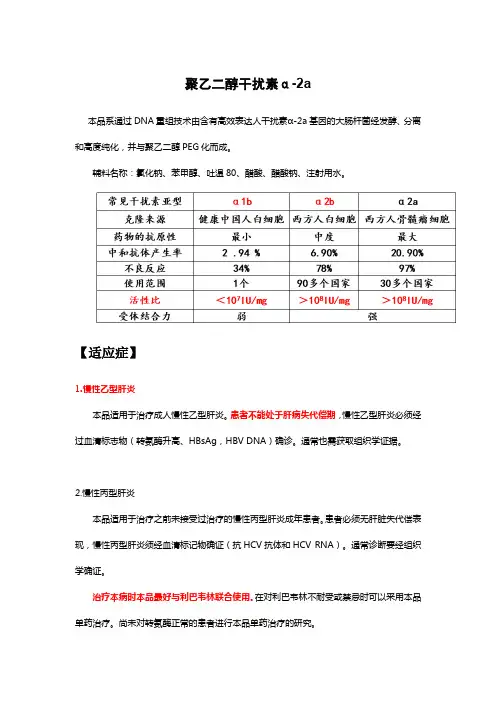
聚乙二醇干扰素α-2a本品系通过DNA重组技术由含有高效表达人干扰素α-2a基因的大肠杆菌经发酵、分离和高度纯化,并与聚乙二醇PEG化而成。
辅料名称:氯化钠、苯甲醇、吐温80、醋酸、醋酸钠、注射用水。
【适应症】1.慢性乙型肝炎本品适用于治疗成人慢性乙型肝炎。
患者不能处于肝病失代偿期,慢性乙型肝炎必须经过血清标志物(转氨酶升高、HBsAg,HBV DNA)确诊。
通常也需获取组织学证据。
2.慢性丙型肝炎本品适用于治疗之前未接受过治疗的慢性丙型肝炎成年患者。
患者必须无肝脏失代偿表现,慢性丙型肝炎须经血清标记物确证(抗HCV抗体和HCV RNA)。
通常诊断要经组织学确证。
治疗本病时本品最好与利巴韦林联合使用。
在对利巴韦林不耐受或禁忌时可以采用本品单药治疗。
尚未对转氨酶正常的患者进行本品单药治疗的研究。
【规格】135 μg/ 0.5 ml /支;180 μg/ 0.5 ml /支。
【用法用量】本品须由有经验的治疗慢性乙型和丙型肝炎的内科医师开始治疗。
与利巴韦林联合使用时请同时参阅利巴韦林的说明书。
1.标准剂量1.1 慢性乙型肝炎用于慢性乙型肝炎患者时本品的推荐剂量为每次180μg,每周1次,共48周,腹部或大腿皮下注射。
其他剂量和疗程尚未进行充分的研究。
1.2 慢性丙型肝炎本品单药或与利巴韦林联合应用时的推荐剂量为每次180μg,每周1次,腹部或大腿皮下注射。
联合治疗时同时口服利巴韦林。
与本品联合治疗的利巴韦林的剂量取决于病毒的基因型:基因型2或3型剂量为每日口服800mg;基因型1型剂量为根据体重每日口服1000-1200mg(见表10)。
利巴韦林应在进餐时服用。
2.发生不良反应时的剂量调整剂量调整的原则对于由于中度和重度不良反应(包括临床表现和/或实验室指标异常)必须调整剂量的患者,初始一般减至135μg,但有些病例需要将剂量减至90μg或45μg。
随着不良反应的减轻,可以考虑逐渐增加或恢复到初始剂量(见【注意事项】及【不良反应】)。

注射用重组人干扰素α2b说明书请仔细阅读说明书并在医师指导下使用警示语:1.对重组人干扰素α2b或该制剂的任何成份有过敏史者禁用。
2.患有严重心脏疾病者禁用\。
3.严重的肝、肾或骨髓功能不正常者禁用。
4.癫痫及中枢神经系统功能损伤者禁用。
5.有其他严重疾病不能耐受本品者,不宜使用。
[药品名称]通用名称:注射用重组人干扰素α2b商品名称:利分能英文名称:Recombinant Human Interferon α2b for Injection汉语拼音:Zhusheyong Chongzu Ren Ganraosu α2b[成份]主要成份为重组人干扰素α2b,由高效表达人干扰素α2b基因的腐生型假单孢菌,经发酵、分离和高度纯化制成。
辅料为人血白蛋白、甘露醇、磷酸氢二钠、磷酸二氢钠。
[性状]应为白色薄壳状疏松体,加入标示量注射用水后应迅速复溶为澄明液体。
[适应症]1.用于治疗某些病毒性疾病,如急慢性病毒性肝炎、带状疱疹、尖锐湿疣。
2.用于治疗某些肿瘤,如毛细胞性白血病、慢性髓细胞性白血病、多发性骨髓瘤、非何杰金氏淋巴瘤、恶性黑色素瘤、肾细胞癌、喉乳头状瘤、卡波氏肉瘤、卵巢癌、基底细胞癌、表面膀胱癌等。
[规格]3×106IU/支,复溶后体积1.0毫升。
[用法用量]本品可以肌肉注射、皮下注射和病灶注射。
1.慢性乙型肝炎:皮下或肌肉注射,3—6×106IU/日,连用四周后改为3次/周,连用16周以上。
2.急慢性丙型肝炎:皮下或肌肉注射,3—6×106IU/日,连用四周后改为3次/周,连用16周以上。
3.丁型肝炎:皮下或肌肉注射,4—5×106IU/日,连用四周后改为3次/周,连用16周以上。
4.带状疱疹:肌肉注射,1×106IU/日,连用6天,同时口服无环鸟苷。
5.尖锐湿疣:可单独应用,肌肉注射,1—3×106IU/日,连用四周。
也可与激光或电灼等合用,一般采用疣体基底部注射,1×106IU/次。

药品名称:通用名称:聚乙二醇干扰素α-2a注射液英文名称:Pegasys (Peginterferon alfa-2a Solution for Injection)商品名称:派罗欣成份:主要成份名称:聚乙二醇干扰素α-2a活性成份来源:本品系通过DNA重组技术由含有高效表达人干扰素α-2a基因的大肠杆菌经发酵、分离和高度纯化,并与聚乙二醇PEG化而成。
辅料名称:氯化钠、苯甲醇(10.0mg/ml)、吐温80、醋酸、醋酸钠、注射用水适应症:1.慢性乙型肝炎本品适用于治疗成人慢性乙型肝炎。
患者不能处于肝病失代偿期,慢性乙型肝炎必须经过血清标志物(转氨酶升高、HBsAg,HBVDNA)确诊。
通常也需获取组织学证据。
2.慢性丙型肝炎本品适用于治疗之前未接受过治疗的慢性丙型肝炎成年患者。
患者必须无肝脏失代偿表现,慢性丙型肝炎须经血清标记物确证(抗HCV抗体和HCVRNA)。
通常诊断要经组织学确证。
治疗本病时本品最好与利巴韦林联合使用。
在对利巴韦林不耐受或禁忌时可以采用本品单药治疗。
尚未对转氨酶正常的患者进行本品单药治疗的研究。
作用机制:聚乙二醇干扰素α-2a(以下称该品)是聚乙二醇(PEG)与重组干扰素α-2a(以下称普通干扰素)结合形成的长效干扰素。
干扰素可与细胞表面的特异性α受体结合,触发细胞内复杂的信号传递途径并激活基因转录,调节多种生物效应,包括抑制感染细胞内的病毒复制,抑制细胞增殖,并具有免疫调节作用。
该品具有非聚乙二醇结合的α-干扰素(普通干扰素)的体外抗病毒和抗增殖活性。
药效学:该品的药效学特点与天然的或普通的人α-干扰素相似,而药代动力学差别很大。
40 KD的PEG部分的结构直接影响临床药理学特点,因为PEG部分的大小和支链结构决定了药物的吸收、分布和消除特点。
健康人单次皮下注射该品180 ug后3-6小时,抗病毒活性指标即(2,5,-oligoadenylate synthetase )血清2,5-寡腺苷酸合成酶(2,5-OAS)活性迅速升高。

抗乙型肝炎病毒药目前公认的抗乙肝病毒药物主要有两类:干扰素类和核苷类似物。
两者的优缺点核苷类似物聚乙二醇干扰素口服需皮下注射副作用少副作用常见仅有抗病毒作用同时具有抗病毒和免疫调节作用强力抑制HBVDNA HBVDNA抑制作用较弱HBsAg血清转换率低HBsAg血清转换更常见需要长期治疗疗程确定耐药率咼无耐药风险干扰素(IFN):是机体细胞在病毒感染或受刺激后,体内产生的一类抗病毒的糖蛋白物质。
干扰素有三种(a,B,Y),分别由人体白细胞、纤维母细胞及致敏淋巴细胞产生,目前使用基因工程。
干扰素是美国食品与药品管理局批准的第一个抗肝炎病毒药物,干扰素a是国际公认的治疗慢性肝炎的抗病毒药。
干扰素在病毒感染的各个阶段都发挥一定的作用。
在防止再感染和持续性病毒感染中也有一定作用。
干扰素能激活宿主细胞的某些酶,降解病毒的mRNA,抑制蛋白的合成,翻译和装配。
与利巴韦林联合应用较单用效果更好。
我国已批准普通IFN-a和PeglFN-a用于治疗CHB。
普通IFN-a治疗CHB患者具有一定的疗效,PeglFN-a相较于普通IFN-a能取得相对较高的HBeAg血清转换率、HBVDNA抑制及生物化学应答率。
基于干扰素a,目前主要是聚乙二醇干扰素(PeglFN-a)的抗HBV治疗方案广泛应用。
与核苷(酸)类似物治疗相比,PegIFN治疗具有更低的HCC发生率。
但许多研究表明,干扰素在抑制HBVDNA方面效果欠佳,并且基因C型和D型的患者较A型和B型患者对干扰素反映较差。
另外,干扰素的副反应较明显,患者耐受性较差此类药物具有直接抗病毒及增强免疫双重作用。
聚乙二醇干扰素a-2a:180ug/次,每周1次,皮下注射,疗程1年。
聚乙二醇干扰素a-2b:1.0-1.5ug/kg/次,每周1次,皮下注射,疗程1年。
IFN-a治疗的禁忌证:IFN-a治疗的绝对禁忌证妊娠或短期内有妊娠计划、精神病史(具有精神分裂症或严重抑郁症等病史)、未能控制的癫痫、失代偿性肝硬化、未控制的自身免疫性疾病、伴有严重感染,视网膜疾病,心力衰竭和慢性阻塞性肺部等基础疾病。

派罗欣产品说明书【药品名称】通用名:聚乙二醇干扰素α-2a注射液商品名:派罗欣Pegasys英文名:Peginterferon alfa-2a Solution for Injection汉语拼音:Juyierchun Ganraosu α-2a Zhusheye本品主要组成成分:聚乙二醇干扰素α-2a【性状】无菌小瓶装液体制剂,供皮下注射用。
每小瓶含180μg(1.0ml)的聚乙二醇干扰素α-2a;赋形剂:氯化钠、吐温80、苯甲醇、乙酸钠、乙酸、注射用水溶液为透明无色至淡黄色液体【药理毒理】药理作用聚乙二醇干扰素α-2a是聚乙二醇(PEG)与重组干扰素α-2a结合形成的长效干扰素。
干扰素与细胞表面的特异性受体结合,触发细胞内复杂的信号传递途径并迅速激活基因转录,调节多种生物效应,包括抑制感染细胞内的病毒复制,抑制细胞增殖,并具有免疫调节作用。
健康人单次皮下注射PEG干扰素α-2a 180μg后3-6小时,血清2, 5-寡腺苷酸合成酶(2, 5-OAS,抗病毒活性指标)活性迅速升高。
PEG干扰素α-2a所引起的2, 5- OAS血清活性可维持1周以上,且比单次皮下注射300万单位和1800万单位干扰素的活性高。
与年轻人比较,62岁以上的老年人单次皮下注射PEG干扰素α-2a 180μg ,所产生的血清2, 5-OAS 活性强度和持续时间有所减低。
【适应症】用于治疗以下慢性丙型肝炎患者:-无肝硬化病人-肝硬化代偿期病人【用法用量】常规剂量推荐剂量为180μg每周一次皮下注射使用,共48周。
特殊剂量指导剂量调整总则对于中度和重度不良反应(包括临床表现和/或实验室指标异常)的患者应给予调整剂量,初始剂量一般减至135μg,但有些病例需要将剂量减至90μg或45μg。
随着不良反应的减轻,可以考虑逐渐增加或恢复至常规使用剂量(见警告、注意事项及不反应章节)。
血液学指标当中性粒细胞计数(ANC)小于750个/mm3时,应考虑减量;当中性粒细胞计数(A NC)小于500个/mm3时,应考虑暂时停药,直到ANC恢复至大于1000个/mm3时,可再恢复治疗。




聚乙二醇干扰素α-2a注射液【药品名称】通用名称:聚乙二醇干扰素α-2a注射液英文名称:Peginterferon alfa-2a Solution for Injection【成份】主要成份名称:聚乙二醇干扰素α-2a ;辅料名称:氯化钠、苯甲醇(10.0mg/ml)、吐温80、醋酸、醋酸钠、注射用水【适应症】1.慢性乙型肝炎,派罗欣适用于治疗成人慢性乙型肝炎。
2.慢性丙型肝炎,派罗欣适用于治疗之前未接受过治疗的慢性丙型肝炎成年患者。
【用法用量】1.常规剂量推荐剂量为180μg每周一次皮下注射使用,共48周。
2.特殊剂量对于中度和重度不良反应(包括临床表现和/或实验室指标异常)的患者应给予调整剂量,初始剂量一般减至135μg,但有些病例需要将剂量减至90μg或45μg。
随着不良反应的减轻,可以考虑逐渐增加或恢复至常规使用剂量(见警告、注意事项及不反应章节)。
血液学指标当中性粒细胞计数(ANC)小于750个/mm3时,应考虑减量;当中性粒细胞计数(A NC)小于500个/mm3时,应考虑暂时停药,直到ANC恢复至大于1000个/mm3时,可再恢复治疗。
重新治疗开始应使用90μg,并应监测中性粒细胞计数。
当血小板计数小于50,000个/mm3时,应将派罗欣?剂量减低至90μg;当血小板计数低于25,000个/mm3时,应考虑停药。
肝脏功能:慢性丙型肝炎患者,肝功能经常出现波动。
与其它α干扰素相同,使用本品治疗后,也会发生ALT升高,包括有病毒应答的患者。
当出现ALT的持续升高时,应考虑将剂量减至90μg。
减量后,如ALT仍持续升高,或发生胆红素升高或肝功能失代偿时,应考虑停药。
特殊说明:应用和处置,作为皮下注射药物,使用前必须肉眼观察注射剂中有无颗粒和颜色变化。
在家中使用时,应向病人提供可以用来丢弃用过的注射器和针头的抗穿刺容器;应向病人说明正确处理用过的注射器和针的重要性,绝对不能重复使用针和注射器;整个空容器应依据医生的要求处理。
Sylatron(聚乙二醇干扰素α- 2b[ peginterferon alfa-2b])使用说明书2011年版皮下注射用SYLATRON™( peginterferon alfa-2b)汤教授注:经核查本品与SCHERING公司的PEGINTRON(PEGINTERFERON ALFA-2B)2011年3月29日美国FDA批准的修改说明书完全一样。
只是商品名不同。
故也可理解为增加新适应证。
这在美国FDA批准的其它生物制品中也有其它实例如FD A曾批准AMGEN公司的狄诺塞麦denosumab的商品名Prolia治疗骨质疏松症绝经后妇女和商品名Xgeva在有实体瘤骨转移患者中预防骨骼相关事件。
批准日期:2011年4月11日;公司:Merck和先灵子公司处方资料重点这些重点不包括安全和有效使用SYLATRON所需的所有资料。
请参阅SYLATRO N完整处方治疗。
美国最初批准:2011适应证和用途SYLATRON是一种α干扰素适用于显微镜或大体肉眼累及淋巴结黑色素瘤与84天内最终手术切除包括完整的淋巴结清扫术的辅助治疗。
(1)剂量和给药方法(1)6 μg/kg/周皮下共8剂随后;(2)3 μg/kg/周皮下直至5年。
(2.1)剂型和规格(1)296 μg冻干粉每单次使用小瓶(2)444 μg冻干粉每单次使用小瓶(3)888 μg冻干粉每单次使用小瓶禁忌证(1)已知对聚乙二醇干扰素α-2b或干扰素α-2b严重超敏反应。
(4)(2)自身免疫性肝炎。
(4)(3)肝失代偿(Child-Pugh评分 >6 [类别B和C])。
(4)警告和注意事项(1)抑郁和其它严重神经精神不良反应。
(5.1)(2)重要或不稳定心脏病史。
(5.2)(3)视网膜疾病。
(5.3)(4)Child-Pugh评分>6(类别B和C)。
(4, 5.4)(5)不能用药物有效治疗的甲状腺功能减退,甲状腺功能亢进,高血糖,糖尿病。
(4, 5.5)不良反应最常见不良反应(>60%)是:疲乏,ALT增高,AST增高,发热,头痛,厌食,肌肉痛,恶心,畏寒,和注射部位反应。
peginterferon alfa-2b 结构式Peginterferon alfa-2b是一种蛋白质药物,用于治疗乙型肝炎病毒和丙型肝炎病毒感染。
它是通过将聚乙二醇(PEG)与干扰素-α-2b 结合而产生的长效配方。
结构式如下所示:Peginterferon alfa-2b的分子量约为31,000道尔顿,并且由165个氨基酸残基组成。
其结构是一个单链的多肽链,并且通过二硫键连接。
该药物的结构具有高度特异性,因为其长效特性使其可以持久地对病原体进行作用。
Peginterferon alfa-2b是一种人工合成的干扰素,是α-干扰素(IFN-α)家族中的一员。
干扰素是人体内天然产生的蛋白质,作为免疫系统的一部分,可以抑制病毒的复制和传播。
通过模拟天然的干扰素,Peginterferon alfa-2b可以增强机体的免疫能力,从而抵抗乙型肝炎和丙型肝炎病毒的感染。
聚乙二醇(PEG)是一个聚合物,通常被用作药物的添加剂,以增强其药效和稳定性。
它可以改善药物的水溶性,并延长药物在体内的半衰期。
在Peginterferon alfa-2b中,PEG与干扰素-α-2b的氨基酸残基之间形成了酯键。
这种结合方式使得药物能够在体内释放慢,提供持久的疗效。
Peginterferon alfa-2b的用途主要是治疗乙型肝炎和丙型肝炎病毒感染。
乙型肝炎和丙型肝炎是两种常见的肝脏疾病,都由病毒感染引起,可以导致肝脏炎症、纤维化和肝硬化等严重后果。
Peginterferon alfa-2b通过增强免疫系统的反应,抑制病毒的复制和传播,从而减轻肝脏的炎症和病变。
Peginterferon alfa-2b的使用方法是通过皮下注射给药。
注射后,药物会逐渐释放出来,提供持续的治疗效果。
根据临床研究的结果,该药物通常需要使用6个月至1年的时间来治疗乙型肝炎和丙型肝炎。
然而,Peginterferon alfa-2b也存在一些副作用。
聚乙二醇干扰素α-2b注射液(CXSS1300028)国家食品药品监督管理总局药品审评中心2016年10月目录一、基本信息 (5)(一)申请人信息 (5)(二)原料药及制剂基本情况 (5)(三)审评程序及审评与审核人员信息(略) (6)(四)审评经过 (6)(五)其他 (7)二、研制现场核查与检验等情况 (7)三、综合审评意见 (8)(一)适应症/功能主治 (9)(二)药理毒理评价 (9)(三)原料和/或制剂评价(略) (10)(四)支持上市申请的临床数据及评价 (10)1.注册临床试验汇总及概述 (10)2. 临床药理学研究 (10)3. 剂量探索研究 (11)4. 关键性临床试验 (14)5.风险分析与控制 (26)6. 获益与风险评估 (29)(五)评价过程中发现的主要问题及处理 (30)四、三合一审评情况 (34)(一)生产现场检查情况 (34)(二)抽样检验情况 (34)(三)临床试验数据核查情况 (35)(四)遗留问题的解决情况 (38)(五)技术审评的总体评价 (38)五、技术审评意见 (38)(一)技术结论 (38)(二)上市后要求 (39)(三)上市后风险控制 (39)(四)提请注册司关注的相关问题(略) (39)批准日期:2016 年9 月 2 日批准文号:国药准字S2*******聚乙二醇干扰素α-2b注射液(CXSS1300028)申请上市技术审评报告一、基本信息(一)申请人信息(二)原料药及制剂基本情况(三)审评程序及审评与审核人员信息(略)(四)审评经过总局受理日期:2013年12月23日药审中心承办日期:2014年1月17日2014年9月17日应企业申请,CDE与其召开了沟通会。
经审评于2015年2月27日发出补充资料通知,2015年3月20日补回资料。
2015.9.22完成技术审评建议批准本品生产,需要进行生产现场检查并发出生产现场检查通知。
2015.10.8,企业递交了生产现场检查申请书。