立体化学基础
- 格式:pdf
- 大小:17.84 KB
- 文档页数:3

有机化学基础知识点整理立体化学基础概念有机化学基础知识点整理——立体化学基础概念引言:有机化学是研究碳元素化合物的构造、性质和变化的一门学科,而立体化学则是有机化学中重要的基础概念之一。
在有机化学中,分子的立体构型对于反应性、性质和生物活性有着重要影响。
本文将着重整理一些有机化学中的立体化学基础概念,以帮助读者更好地理解有机化学中的立体结构,进而对有机化学进行深入学习。
一、手性与手性中心手性是指分子或物体与其镜像体不可重合的性质。
在有机化学中,手性分子是指拥有手性中心或手性轴的分子。
手性中心是指一个碳原子上连接着四个不同基团的碳原子,它使得分子无法与自身的镜像体重合。
手性分子在光学活性、药物作用和化学性质等方面具有独特的特性。
二、立体异构与构象异构1. 立体异构立体异构是指分子的空间排列方式不同而产生的异构体。
常见的立体异构有以下两种类型:(1) 旋转异构:由于单键的自由旋转,骨架构型可以发生一定程度的旋转,产生旋转异构体。
(2) 互变异构:由于键的旋转受到某些限制,使分子无法通过旋转达到立体异构体之间的互变。
2. 构象异构构象异构是指分子在空间中采取不同的构象,但化学键没有发生断裂或形成新的键。
构象异构分为以下几种类型:(1) 键的旋转构象异构:分子在有某些限制的情况下,通过键的旋转而形成的构象异构。
(2) 环的变形构象异构:分子中含有环系统,通过环的弯曲或平面变形产生的构象异构。
(3) 键的翻转构象异构:分子中存在于键的两个端点之间的三个最佳位置,通过在这三个位置间进行翻转形成的构象异构。
三、立体化学的表示方法1. 常用的立体表示方法(1) 空间结构式:通过笛卡尔坐标系中的三维坐标表示分子的立体构型。
(2) 键切式:通过表示分子和化学键之间关系的切面图形来表示立体构型。
(3) 投影式:通过投影方式来表示立体构型,包括斜投影式、哈维利投影式等。
2. 立体异构体的命名方法(1) IUPAC命名法:使用希腊字母(R和S)来表示手性异构体,其中R表示顺时针方向,S表示逆时针方向。

《有机化合物的结构》立体化学基础在有机化学的广袤世界里,有机化合物的结构就如同是一座精巧构建的大厦,而立体化学则是其中至关重要的基石。
理解有机化合物的立体结构,对于深入探究其性质、反应以及在各种领域中的应用都具有不可估量的意义。
首先,让我们来认识一下什么是有机化合物的结构。
简单来说,它指的是构成有机分子的原子在空间的排列方式。
这可不仅仅是原子的简单连接,而是有着极其精妙的规律和特点。
原子之间通过化学键相互结合,形成了有机分子的骨架。
常见的化学键包括共价键,比如单键、双键和三键。
这些键的类型和长度,以及它们之间的角度,都对有机化合物的结构和性质产生着深远的影响。
以最简单的有机化合物甲烷为例,它的分子结构是正四面体。
碳原子位于正四面体的中心,四个氢原子分别位于正四面体的四个顶点。
这种空间排列使得甲烷分子具有特定的对称性和稳定性。
当我们谈到有机化合物的立体化学基础时,不得不提到手性这个重要的概念。
手性就好像是我们的左右手,虽然看起来相似,但却不能完全重合。
在有机化学中,存在着许多手性分子,它们具有对映异构体。
对映异构体在物理性质上,如熔点、沸点、溶解度等,往往非常相似,但在生物活性和化学反应性方面却可能有着天壤之别。
比如,某些药物的一种对映异构体可能具有良好的治疗效果,而另一种可能不仅无效,甚至还会产生副作用。
再来看一下碳的四面体构型。
当碳原子与四个不同的原子或基团相连时,就会形成手性中心。
这四个基团在空间上的不同排列,就产生了一对对映异构体。
那么,如何确定一个分子是否具有手性呢?这就需要用到一些方法和规则。
比如,可以通过观察分子是否存在对称面或对称中心来判断。
如果不存在对称面和对称中心,那么这个分子很可能就是手性分子。
除了手性,有机化合物的构象也是立体化学中的一个重要方面。
构象是指由于单键的旋转而导致分子中原子在空间的不同排列方式。
以乙烷为例,它的构象可以有无数种,但最常见的是交叉式和重叠式。
交叉式构象能量较低,比较稳定;而重叠式构象能量较高,相对不稳定。




有机化学基础知识点整理立体化学的基本概念与应用在有机化学中,立体化学是一个重要的分支领域,它研究的是分子和化合物的三维结构及其对化学性质的影响。
立体化学的概念和应用在有机化学领域具有举足轻重的地位。
本文将对有机化学中的立体化学进行基本概念的整理,并探讨其在化学研究与应用中的重要性。
一、立体化学的基本概念1. 手性:手性是立体化学的一个重要概念,指的是分子或离子的不可重合的镜像异构体。
手性分子无法通过旋转或挪动使其镜像与原分子完全重合,就好像左手和右手无法完全重合一样。
2. 构象异构体:构象异构体指的是同分子式、同结构式但不同空间构型的异构体。
构象异构体的存在是由于分子的键旋转或自由转位所引起的。
典型的构象异构体如反式异构体和顺式异构体等。
3. 立体异构体:立体异构体指的是具有不同立体构型的分子或化合物。
常见的立体异构体有立体异构体、顺反异构体、环异构体等。
立体异构体的存在表明分子或化合物在空间上具有多种不同的构型。
4. 立体中心:立体中心是指一个分子中与不同基团相连的一个原子。
立体中心通常是由于其所连接的基团不对称而导致的。
一个分子可以有一个或多个立体中心。
5. 伪旋光体系:伪旋光体系是一种没有旋光性质的化合物与另一种旋光体系混合而形成的旋光体系。
这种混合体系的旋光性质来源于两个(或多个)异构体存在的旋光性质的合成。
二、立体化学的应用1. 手性药物:手性药物是指那些由手性分子构成的药物。
由于手性药物和其镜像异构体具有不同的生物活性,所以对于手性药物的合成和分离有着重要的意义。
立体化学在药物研发和制备中发挥着重要作用。
2. 光学活性物质:光学活性物质是指那些能够旋转平面偏振光的化合物。
通过立体异构体的性质,光学活性物质可以用于制备偏光镜、偏振片等光学器件,同时也广泛应用于化学分析和手性分离等领域。
3. 反应立体化学:立体化学对于有机反应的研究和理解具有重要意义。
通过研究反应的立体选择性、选择性和环境中对于反应物立体异构体的识别能力,可以更好地设计有机反应和催化剂的设计。



大一立体化学知识点化学是一门研究物质组成、性质和变化的科学,立体化学作为化学的一个重要分支,研究的是分子和它们之间的空间排列关系对化学性质的影响。
在大一学习化学的过程中,也会接触到一些立体化学的基础知识点。
本文将介绍一些大一阶段的立体化学知识点。
1. 手性与不对称在化学中,分子的手性与不对称性是非常重要的概念。
手性是指分子或物体与它的镜像非重合的性质。
分子的手性可以通过一个实验室常见的手性溶剂 - 果糖来研究。
果糖能够使光线偏振,而具有手性的分子可以使光线旋转。
手性分子中手性中心的数量与分子的手性有关。
2. 立体异构体立体异构体是指化学结构相同但空间构型不同的分子。
立体异构体包括构象异构体和对映异构体。
构象异构体是由于分子构型的空间旋转或振动引起的。
例如,环状化合物的构象异构体就是由于分子内部环的扭曲导致的不同构型。
对映异构体则是指立体异构体中,分子的镜像不重合。
对映异构体对许多化学现象有着重要的影响,例如药物效果和生物活性。
3. 构象表示法为了方便描述分子的构象,化学家发展了许多构象表示法。
其中最常用的是Newman投影式、Haworth式等。
Newman投影式适用于描述直线分子的构象,将分子按照键轴的不同方向展示。
Haworth式主要用于描述糖类化合物的构象,将分子呈环状结构,通过短线和长线表示不同的取向。
4. 立体化合物的合成在有机化学中,立体化合物的合成是一个重要的研究领域。
合成立体化合物的方法主要包括手性合成和对映选择性反应。
手性合成主要用于合成具有特定手性的分子,常用的手性合成方法包括对映选择性催化剂、手性求核试剂等。
对映选择性反应则是指在反应中选择性地生成对映异构体。
5. 立体化学在生物学中的应用立体化学在生物学中有着广泛的应用。
生物体内的许多分子都具有手性,手性的差异可以导致生物活性的差异。
例如,药物的对映异构体可能具有不同的药效和毒性。
另外,生物体内的酶对手性分子也具有高度的选择性,这种立体选择性对于生物反应的发生起着关键的作用。

有机化学基础知识点立体化学的基本概念立体化学是有机化学中非常重要的一个概念,它涉及到分子的空间结构和构象。
在有机化学反应中,分子的立体构型对反应的速率和产物的选择性有着重要的影响。
本文将介绍立体化学的基本概念,包括立体异构、手性分子、构象等知识点。
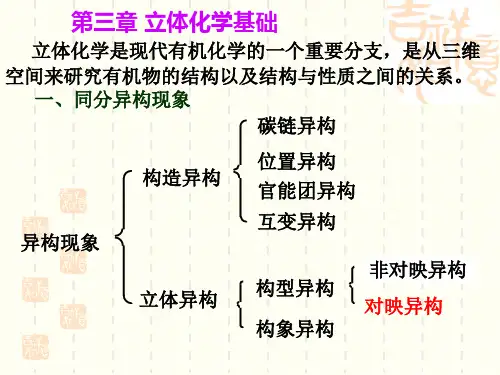
1. 立体异构立体异构是指化学物质的分子在空间中的排列方式不同,从而导致其化学性质与物理性质的差异。
立体异构可以分为构造异构和空间异构两种类型。
1.1 构造异构构造异构是指分子结构的连接方式不同,分为链式异构、官能团异构和位置异构三种类型。
链式异构:同分子式下,碳骨架的排列方式不同,如正丁烷和异丁烷就是一对链式异构体。
官能团异构:同分子式下,分子中的官能团位置不同,如乙醇和甲醚就是一对官能团异构体。
位置异构:同分子式下,官能团位置相对于主链排列的位置不同,如2-丁醇和3-丁醇就是一对位置异构体。
1.2 空间异构空间异构是指分子在空间中的三维排列方式不同,分为立体异构和对映异构两种类型。
立体异构:分子中存在非自由旋转的键,由于旋转受限,使得分子结构不同,如顺式-反式异构。
对映异构:对称分子具有镜像关系,不能通过旋转重叠,如手性分子。
2. 手性分子手性分子是指与其镜像物不可重叠的化合物,也称为不对称分子。
手性分子通常包含一个或多个手性中心,手性中心是一个碳原子,与四个不同的基团连接。
手性分子的最重要特征是其对映异构体的存在。
对映异构体具有相同的分子式、相同的化学键,但是无法通过旋转或平移重叠。
这种现象称为手性体。
手性分子有很多实际应用,如生物活性物质、药物、拆分光等。
同时,手性分子还涉及到光学活性、旋光度等概念。
3. 构象构象是指分子在空间中的不同取向,由于化学键的旋转、振动等运动而引起的。
构象是立体化学中的重要概念之一,它与立体异构密切相关。
分子的构象由于化学键的自由旋转而产生,通常与键长、键角、键的取代基团等因素有关。
构象的改变可能会导致分子性能的变化。
有机化学基础知识点立体化学基础概念与手性化合物立体化学基础概念与手性化合物有机化学是研究有机物的结构、性质、合成及其在生物、化工、医学等领域中应用的学科。
其中,立体化学是有机化学的重要基础概念之一。
本文将对立体化学的基础概念以及手性化合物进行介绍。
一、立体化学基础概念1. 手性和对映异构体:在有机化合物中,当它们的空间结构不能通过旋转、平移相互重合时,这些化合物被称为手性化合物。
手性化合物存在对映异构体现象,即它们的立体异构体成对出现,并且互为镜像关系。
例如,人的左右手就是对映异构体。
这两个异构体被称为左旋体(S体)和右旋体(R 体)。
2. 手性中心:手性中心是指化合物中的一个碳原子,它与四个不同的官能团或原子键相连。
由于它的四个取代基在空间上的排列不同,使得它的对映异构体产生。
手性中心常用希腊字母α、β、γ等表示。
3. 还原混合原则:还原混合原则用来判断手性中心的对映异构体的数量。
当一个化合物中有n个手性中心且各个手性中心均是不对称的,那么该化合物的对映异构体数量为2^n。
二、手性化合物手性化合物具有重要的生物活性和光学活性,对人体和环境有着重要的影响。
以下是一些常见的手性化合物和它们的应用:1. 丙氨酸:丙氨酸是一种α-氨基酸,它是生物体内合成蛋白质所必需的。
丙氨酸具有手性中心,存在左旋体(L-丙氨酸)和右旋体(D-丙氨酸)。
它们在构型上相似,但在生物活性上却有很大差别。
2. 扑热息痛:扑热息痛是一种常见的退烧镇痛药。
它的左旋体(S-扑热息痛)具有镇痛和退烧的作用,而右旋体(R-扑热息痛)则没有这种作用。
这也是为什么在合成和制药过程中要求生产单一对映异构体的原因之一。
3. 手性催化剂:手性催化剂是一类广泛应用于有机合成领域的手性化合物。
它们能够在催化反应中选择性地促使某个位点的反应,从而获得高产率和高对映选择性的产物。
手性催化剂对于药物合成和农业化学品的合成具有重要的意义。
三、总结立体化学基础概念与手性化合物是有机化学中的重要内容。
有机化学基础知识点立体化学基础概念有机化学中的立体化学是研究有机分子空间构型和立体化学性质的重要分支。
立体化学关注分子中的空间排列方式,包括分子的手性、立体异构体和立体反应等内容。
本文将介绍有机化学中的一些基础立体化学概念。
1. 手性手性是指分子或物体与其镜像光学异构体不重合的性质。
一个手性分子可以分为左旋体和右旋体两种形式。
在化学中,手性分子的存在对于药物合成和酶催化反应等非常重要。
手性分子的手性来源于其分子结构中的手性中心,即一个碳原子上连接着四个不同取代基团。
2. 立体异构体立体异构体是指分子在空间中构型不同而又无法通过旋转单键使其相互转变的异构体。
立体异构体包括构象异构体和对映异构体两种类型。
2.1 构象异构体构象异构体是由于分子内部化学键的旋转而产生的不同构型的异构体。
构象异构体之间的转换是不需要断裂化学键的,只需要旋转共轭化学键即可。
其中最常见的构象异构体是顺反异构体,即环状化合物中取代基团的位置不同。
2.2 对映异构体对映异构体是指分子在空间中有镜像对称性,但不能通过旋转或挪移使其重合的异构体。
对映异构体分为手性对映异构体和平面对映异构体两种形式。
3. 立体反应立体反应是指在反应中发生分子构型的改变或从一个立体异构体转变为另一个立体异构体的反应。
立体反应可以是顺反异构体之间的互变,也可以是对映异构体之间的互变。
在立体反应中,空间位阻是一个关键的因素。
分子中的取代基团会引起空间位阻,从而影响分子的反应性质和选择性。
例如,在烷基化反应中,取代基团的位置对于反应速率和产物构型具有重要影响。
4. 立体化学表示法为了方便描述分子的立体构型,化学家们提出了多种立体表示法。
常见的立体化学表示法包括:4.1 立体式投影图立体式投影图是将分子在平面上投影成线条的方式,用来表示分子的立体构型。
在立体式投影图中,立体中心用一个交叉表示,取代基团则通过水平或垂直线条连接到立体中心。
4.2 锥式投影图锥式投影图是一种三维表示法,将分子在空间中呈锥形展开。
第五章 立体化学基础(手性分子)
一、选择题
1.下列化合物具有旋光性的是( )。
CH 2OH
HO H
2OH
3
H
A .
B .
C .
D .
3
3COOH
H
2.3-氯-2,5-二溴己烷可能有的对映体的个数是( )。
A .3对 B .1对 C .4对 D .2对
3.下列羧酸最稳定的构象是( )。
COOH
CH 3H 3C H 3C
COOH
CH 3A .B .
C .
D .
4.下列化合物构型为S 型的是( )。
A .
B .
C .
D .CH 3
Br
H
2
CH 3
HO
H 2CH 3
CH 2OH
Cl
H COOH
HO
H 2OH
5.具有手性碳原子,但无旋光活性的是( )。
A.E-1,2-二甲基环丁烷
B.Z-1,2-二甲基环丁烷
C.1,2-二氯丁烷
D.1,3-二氯丁烷
E.1,4-二氯丁烷 6.下列化合物的绝对构型为( )。
COOH H OH
2CH 3
A .
B .
C .
D .D-L-R-S-型
型型型
7.下列化合物构型为S 型的是( )。
A .
B .
C .
D .CH 3
Br
H
2
CH 3
HO
H 2CH 3
CH 2OH
Cl
H COOH
HO
H 2OH
8.下列互为对映体的是( )。
H HO COOH H OH COOH
H OH
H COOH H
HOOC
OH H HO COOH OH
H COOH HO
COOH (1)(3)
(4)
(2)(1)(3)(4)(2)(1)(3)(2)和和和和(3)A .
B .
C .
D .
9.3R ,4R-3,4-二苯基戊酸的最稳定构象是( )。
A .
B .
C .
D .
3
C 6H 5
6H 5
HOOCH 2
3
C 6H
6H 5
3
C 6H H C 6H
65
H 3H C 6H
10.下列分子没有手性的是( )。
A .顺-1-甲基-3-乙基环戊烷
B .反-1-甲基-3-乙基环戊烷
C .顺-1-甲基-2-乙基环丙烷
D .反-1-甲基-3-乙基环丁烷 11.下列化合物的Newman 式对应的费歇尔投影式为( )。
CH 2Cl H OH 2Cl
H OH
A
.B .C .D .2ClH 2CH 2Cl
HO
H 2Cl
HO
H CH 2Cl
HO H
2Cl H OH
CH 2Cl
H OH 2Cl
HO H
12.下列化合物的立体异构体数目为( )。
CH 2CH=CHCH 3
H OH 3H
OH
A .4
B .8
C .16
D .32 二、 是非题
1.凡是有其镜像的分子都是手性分子。
( ) 2.对映异构体的比旋光度应大小相等、旋光方向相反。
( ) 3.手性分子中必定含有手性碳原子。
( ) 4.含有一个手性碳的分子一定是手性分子。
( ) 5.含有两个手性碳原子的分子也一定是手性分子。
( ) 6.手性分子与其镜像互为对映异构体。
( ) 7.没有手性碳原子的的分子一定是非手性分子,必定无旋光性。
( ) 8.光学异构体的构型与旋光方向无直接关系。
( ) 9.对映异构体可通过单键旋转而相互重合。
( ) 10.如果一个化合物没有对称面,它必然是手性的。
( ) 三、推导结构
某链状化合物A 的分子式为C 5H 9Cl ,有旋光性,经催化加氢后得到B ,B 仍有旋光性。
试写出A 和B 的可能的结构式。
四、计算题
20。
C时,用钠光灯光源测得1L含50克果糖的水溶液的旋光度为-4.64。
,计算其比旋光度。
(李兆楼编)。