蛋白质的理化性质(一)
- 格式:docx
- 大小:13.50 KB
- 文档页数:2





蛋白质的理化性质第四节蛋白质的理化性质一、两性离解和等电点蛋白质是由氨基酸组成的,在其分子表面带有很多可解离基团,如羧基、氨基、酚羟基、咪唑基、胍基等。
此外,在肽链两端还有游离的α-氨基和α-羧基,因此蛋白质是两性电解质,可以与酸或碱相互作用。
溶液中蛋白质的带电状况与其所处环境的pH 有关。
当溶液在某一特定的pH 条件下,蛋白质分子所带的正电荷数与负电荷数相等,即净电荷数为零,此时蛋白质分子在电场中不移动,这时溶液的pH 称为该蛋白质的等电点,此时蛋白质的溶解度最小。
由于不同蛋白质的氨基酸组成不同,所以蛋白质都有其特定的等电点,在同一pH 条件下所带净电荷数不同。
如果蛋白质中碱性氨基酸较多,则等电点偏碱,如果酸性氨基酸较多,等电点偏酸。
酸碱氨基酸比例相近的蛋白质其等电点大多为中性偏酸,约在5.0 左右。
1、两性解离蛋白质可以在酸性环境中与酸中和成盐,而游离成正离子,即蛋白质分子带正电,在电场中向阴极移动;在碱性环境中与碱中和成盐而游离成负离子,即蛋白质分子带负电,在电场中向阳极移动。
以“P”代表收集于网络,如有侵权请联系管理员删除收集于网络,如有侵权请联系管理员删除蛋白质分子,以―NH 2 和―COOH 分别代表其碱性和酸性解离基团,随pH 变化,蛋白质的解离反应可简示如下:(pH>pI ) (pH=pI ) (pH<pI )移向阳极 不移动 移向阴极2、等电点沉淀和电泳①等电点沉淀蛋白质在等电点时,以两性离子的形式存在,其总电荷数为零,这样的蛋白质颗粒在溶液中因为没有相同电荷而相互排斥的影响,所以极易借静电引力迅速结合成较大的聚集体,因而易发生沉淀析出。
这一性质常在蛋白质分离、提纯时应用。
在等电点时,除了蛋白质的溶解度最小外,其导电性、粘度、渗透压以及膨胀性均为最小。
②电泳蛋白质颗粒在溶液中解离成带电的颗粒,在直流电场中向其所带电荷相反的电极移动。
这种大分子化合物在电场中定向移动的现象称为电蛋白质的阴离子蛋白质的阳离子蛋白质的兼性离子(等电点)NH 3+COO -P NH 3+P COOHNH 2COO-P泳。


蛋白质的理化性质蛋白质是一类高分子生物大分子化合物,由氨基酸分子结合而成。
下面将从化学、物理、生化等方面来介绍蛋白质的理化性质。
1. 氨基酸的性质氨基酸是蛋白质的基本组成单位,其分子结构具有酸性和碱性两部分,分别是羧基和氨基。
氨基酸的酸性和碱性反应性决定蛋白质的异性和电性。
氨基酸的酸性基团和碱性基团在不同的环境下会存在不同的离子形式,从而影响蛋白质的电性质。
2. 构象的性质蛋白质的构象是指氨基酸之间的立体构型,决定了蛋白质的特殊结构和功能。
蛋白质的构象主要由五种不同层次的结构组成,包括原生构象、二级构象、三级构象、四级构象和超级结构。
每一层次的构象都有一定的稳定性和特殊结构,是蛋白质功能和特性的决定因素。
3. 溶解和凝固的性质蛋白质在水中具有一定的溶解性,但可能会因为温度、pH值、离子强度等因素的改变而发生凝固。
这种溶解或凝固的性质取决于蛋白质的特殊结构以及其所处环境。
当蛋白质分子与水分子之间的相互作用受到破坏或受到特定溶剂或离子的作用时,蛋白质分子会转化为凝胶态或沉淀态。
4. 热力学性质蛋白质分子的热力学性质涉及其结构及其所处溶液环境的物理化学性质,可用于研究蛋白质折叠和复性过程。
蛋白质的热力学性质包括热容量、热稳定性、相转化、热解离等。
这些性质的变化与蛋白质结构的稳定性和功能密切相关。
蛋白质的光学性质主要表现为它们具有的吸收、发射光线的光学行为。
蛋白质的吸收和发射光束涉及其分子内的色团,这些分子内的色团主要由氨基酸的芳香族侧链所构成。
蛋白质的光学性质可以利用光谱分析来研究蛋白质的结构和功能。
综上所述,蛋白质的理化性质是多方面的,包括氨基酸的性质、构象的性质、溶解和凝固的性质、热力学性质以及光学性质等,这些性质的变化都会导致蛋白质的性质和功能的变化。
因此,对蛋白质的理化性质进行研究对于理解蛋白质的结构、功能与机制具有重要意义。

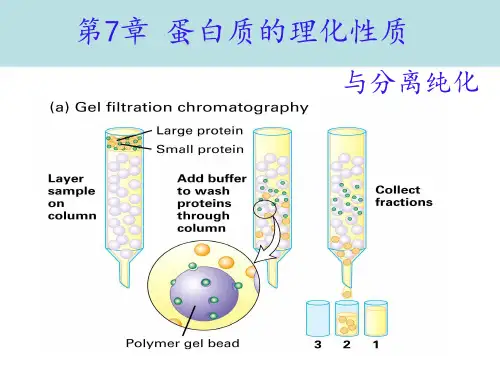
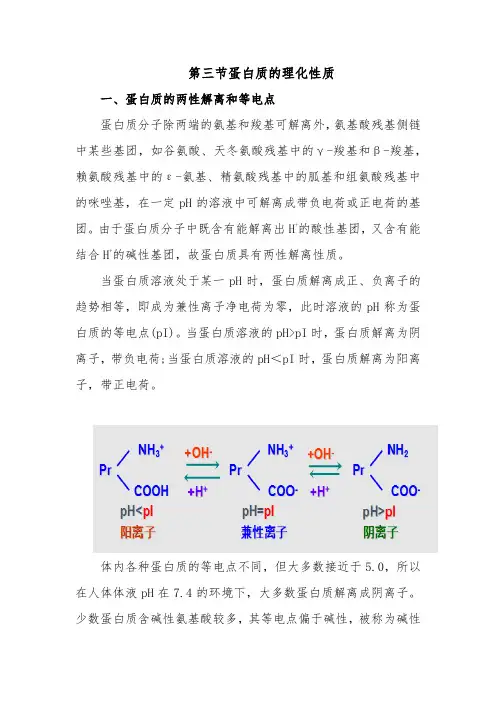
第三节蛋白质的理化性质一、蛋白质的两性解离和等电点蛋白质分子除两端的氨基和羧基可解离外,氨基酸残基侧链中某些基团,如谷氨酸、天冬氨酸残基中的γ-羧基和β-羧基,赖氨酸残基中的ε-氨基、精氨酸残基中的胍基和组氨酸残基中的咪唑基,在一定pH的溶液中可解离成带负电荷或正电荷的基团。
由于蛋白质分子中既含有能解离出H+的酸性基团,又含有能结合H+的碱性基团,故蛋白质具有两性解离性质。
当蛋白质溶液处于某一pH时,蛋白质解离成正、负离子的趋势相等,即成为兼性离子净电荷为零,此时溶液的pH称为蛋白质的等电点(pI)。
当蛋白质溶液的pH>pI时,蛋白质解离为阴离子,带负电荷;当蛋白质溶液的pH<pI时,蛋白质解离为阳离子,带正电荷。
体内各种蛋白质的等电点不同,但大多数接近于5.0,所以在人体体液pH在7.4的环境下,大多数蛋白质解离成阴离子。
少数蛋白质含碱性氨基酸较多,其等电点偏于碱性,被称为碱性蛋白质,如鱼精蛋白、组蛋白等。
也有少量蛋白质含酸性氨基酸较多,其等电点偏于酸性,被称为酸性蛋白质,如胃蛋白酶和丝蛋白等。
由于组成蛋白质的氨基酸种类和数量不同,其蛋白质的等电点也各不相同。
在同一pH条件下,不同蛋白质所带净电荷的性质及电荷量不同。
因此,利用蛋白质两性解离性质,可通过电泳、层析等方法将不同蛋白质分离、纯化。
二、蛋白质的高分子性质蛋白质属于生物大分子,分子量在104-106D,其分子的直径可达1-100nm,在胶粒范围之内。
在蛋白质颗粒中,疏水基团大多位于分子内部,而亲水基团多分布于分子表面,在溶液中与水发生水合作用,颗粒表面形成一层水化膜,相互不会聚集。
此外,在非等电点的溶液中,同种性质的蛋白质颗粒表面都带有同种的电荷,相互排斥,使蛋白质颗粒相互隔开,不易聚集沉淀。
因此,蛋白质分子表面的水化膜和同种电荷是蛋白质胶体溶液稳定的两个重要因素。
蛋白质是高分子化合物,蛋白质溶液具有胶体溶液的性质,不能透过半透膜,是某些蛋白质分离纯化方法的基础。

蛋白质的理化性质(一)蛋白质的两性解离及等电点1.蛋白质的等电点(pI):当蛋白质溶液处于某一pH时,蛋白质上可解离基团解离成正、负离子的趋势相等,净电荷为零时溶液的pH。
➢等电点时溶解度最小可使蛋白质沉淀。
➢蛋白质pI要用等电聚焦等方法测定。
(二)蛋白质的胶体性质1.胶体溶液的三个条件:①大小在1-100nm范围内:蛋白质分子量很大,属胶体颗粒范围。
②同种电荷互相排斥:相同蛋白质颗粒带有同性电荷,与周围的反离子构成稳定的双电层。
③质点外围有水化层:多肽链上的极性基团极易吸附水分子,使蛋白质颗粒外围形成一层水化膜。
蛋白质可以形成稳定的胶体溶液。
2.利用胶体溶液性质,可用透析法将蛋白质中小分子杂质除去。
(三)蛋白质的沉淀1.定义:蛋白质在溶液中的稳定性是有条件的、相对的。
如果加入适当的试剂使蛋白质分子处于等电点状态或破坏其水化层和双电层,蛋白质胶体溶液因不再稳定而产生沉淀。
此现象即为蛋白质的沉淀作用。
2.类型:分可逆沉淀与不可逆沉淀。
➢可逆沉淀▁非变性沉淀定义:在温和条件下,改变溶液的pH或电荷状况,蛋白质结构和功能没有发生变化。
如等电点沉淀法、盐析法和有机溶剂沉淀法等。
是分离和纯化的基本方法。
a.等电点沉淀法:用弱酸或弱碱调节蛋白质溶液的pH等于pI,破坏蛋白质表面净电荷使蛋白质沉淀。
b.盐析沉淀法:1.盐析:通过加入大量高浓度中性盐如硫酸铵、氯化钠等,破坏蛋白质分子表面的水化层,中和它们的电荷,而使蛋白质沉淀析出的现象。
2.各种蛋白质亲水性及荷电均有差别,因此通过调节中性盐浓度,可使混合蛋白质溶液中的不同蛋白分别沉淀析出,这种方法称为分段盐析。
3.盐溶:加入低浓度盐导致蛋白质溶解度增加的现象。
c.有机溶剂沉淀法定义:加入能与水互溶的有机溶剂如乙醇、丙酮等,破坏蛋白质的水化膜使蛋白质产生沉淀。
注意:通常在低温条件下进行,否则有机溶剂与水互溶产生的溶解热会使蛋白质发生变性。
➢不可逆沉淀▁变性沉淀定义:沉淀条件剧烈,破坏了蛋白质胶体溶液稳定性,同时也破坏了蛋白质结构和功能。
蛋白质的理化性质(一)引言:蛋白质是生物体内重要的有机化合物,不仅在构建细胞和组织结构中起关键作用,还参与许多生物化学过程。
了解蛋白质的理化性质对于深入理解其功能和应用具有重要意义。
本文将从五个方面介绍蛋白质的理化性质。
一、蛋白质的结构特点1. 蛋白质组成:蛋白质由氨基酸组成,氨基酸的序列决定了蛋白质的结构和功能。
2. 蛋白质的层次结构:蛋白质包括原始结构、二级结构、三级结构和四级结构,不同结构层次决定了蛋白质的功能。
3. 蛋白质的稳定性:蛋白质的稳定性受到氨基酸组成、离子强度和温度等因素的影响。
二、蛋白质的溶解性1. 水溶性蛋白质与脂溶性蛋白质:根据溶解性可将蛋白质分为水溶性和脂溶性两类。
2. 溶解度的影响因素:蛋白质的溶解度受到pH值、温度、离子强度和化学修饰等因素的影响。
3. 不溶性蛋白质的结构:某些蛋白质在特定条件下会失去溶解性,并形成聚集体或沉淀。
三、蛋白质的电荷性质1. 酸碱性: 蛋白质中的氨基酸残基可以具有酸性或碱性特性,决定了蛋白质的电荷性质。
2. 等电点:蛋白质在特定pH值下呈现电中性状态,该pH值被称为蛋白质的等电点。
3. 离子交换作用:蛋白质的电荷性质会影响其与其他离子或分子之间的交互作用。
四、蛋白质的热力学性质1. 热稳定性:蛋白质在不同温度下具有不同的热稳定性,可通过热力学参数如熔点和热容量等进行描述。
2. 热不变性:某些蛋白质在高温下具有一定的稳定性,可在热表面活性剂条件下进行研究。
3. 热变性:蛋白质在高温下会发生热变性,导致其结构和功能的改变。
五、蛋白质的光谱特性1. 紫外-可见吸收光谱:蛋白质在紫外-可见光谱范围内有特征吸收峰,可用于蛋白质的浓度测定和结构研究。
2. 红外光谱:蛋白质的红外光谱可以提供关于氨基酸残基吸收峰和蛋白质结构的信息。
3. 荧光光谱:蛋白质在特定荧光激发下会发出荧光信号,可用于蛋白质的检测和分析。
总结:蛋白质是生物体中重要的有机化合物,其理化性质在其功能和应用中起着重要作用。
【生物知识点】简述蛋白质的理化性质1、具有两性;2、可发生水解反应;3、溶水具有胶体的性质;4、加入电解质可产生盐析作用;5、蛋白质的变性;6、颜色反应,蛋白质可以跟许多试剂发生颜色反应;7、气味反应。
两性蛋白质是由α-氨基酸通过肽键构成的高分子化合物,在蛋白质分子中存在着氨基和羧基,因此跟氨基酸相似,蛋白质也是两性物质。
水解反应蛋白质在酸、碱或酶的作用下发生水解反应,经过多肽,最后得到多种α-氨基酸。
蛋白质水解时,应找准结构中键的“断裂点”,水解时肽键部分或全部断裂。
胶体性质有些蛋白质能够溶解在水里(例如鸡蛋白能溶解在水里)形成溶液。
蛋白质的分子直径达到了胶体微粒的大小(10-9~10-7m)时,所以蛋白质具有胶体的性质。
沉淀原因:加入高浓度的中性盐、加入有机溶剂、加入重金属、加入生物碱或酸类、热变性少量的盐(如硫酸铵、硫酸钠等)能促进蛋白质的溶解。
如果向蛋白质水溶液中加入浓的无机盐溶液,可使蛋白质的溶解度降低,而从溶液中析出,这种作用叫做盐析。
这样盐析出的蛋白质仍旧可以溶解在水中,而不影响原来蛋白质的性质,因此盐析是个可逆过程。
利用这个性质,采用分段盐析方法可以分离提纯蛋白质。
变性在热、酸、碱、重金属盐、紫外线等作用下,蛋白质会发生性质上的改变而凝结起来。
这种凝结是不可逆的,不能再使它们恢复成原来的蛋白质。
蛋白质的这种变化叫做变性,蛋白质变性之后,紫外吸收,化学活性以及粘度都会上升,变得容易水解,但溶解度会下降。
蛋白质变性后,就失去了原有的可溶性,也就失去了它们生理上的作用。
因此蛋白质的变性凝固是个不可逆过程。
造成蛋白质变性的原因物理因素包括:加热、加压、搅拌、振荡、紫外线照射、X射线、超声波等。
化学因素包括:强酸、强碱、重金属盐、三氯乙酸、乙醇、丙酮等。
颜色反应例如在鸡蛋白溶液中滴入浓硝酸,则鸡蛋白溶液呈黄色。
这是由于蛋白质(含苯环结构)与浓硝酸发生了颜色反应的缘故。
还可以用双缩脲试剂对其进行检验,该试剂遇蛋白质生成紫色络合物。
简述蛋白质的理化性质。
蛋白质是一种具有生物活性的有机物质,是生物体的重要组成部分,是构成活体机体大部分亚细胞组织的重要物质。
它由氨基酸构成,包括20种氨基酸,每一种氨基酸的个体比例不定,形成了特异的蛋白质分子结构。
蛋白质具有种种特殊理化性质,它不仅能反映生物活体的特性,而且能用于科学实验室对生物材料进行分析和定量。
一、理化性质1、蛋白质结构蛋白质具有独特的三级结构,它由氨基酸组成,可以根据氨基酸序列和链构象形成复杂的空间构象。
以水解机理和非水解机理为基础,蛋白质的结构和功能的作用是相互关联的,即已知功能的蛋白质结构,也可以通过其结构推断出其功能。
2、蛋白质的水溶性大多数蛋白质具有特定的极性,所以它们能与水发生双范本作用作用,能够以很好的m比例溶解。
一般来说,极性和表面活性有关,活性质和水溶性有关,因此,蛋白质的水溶性和其本身的理化性质和结构有关。
3、pH值和温度蛋白质具有调节体内环境的重要作用,体内环境的温度和pH值的变化可以影响蛋白质的结构和活性。
它的敏感性比较大,当温度发生变化时,它会发生一定程度的改变,当α结构因温度变化而稳定时,蛋白质相对沉淀可能会发生。
此外,在体外制备蛋白质时,其pH值也可能影响其活性和稳定性。
因此,在实验检测过程中,可以通过预先调整温度和pH值来维持生物体状态。
4、脱水或催化作用蛋白质在一定的条件下,它可能会透过脱水反应的作用,或者由酶的催化活性,被活化或改变活性,以达成较大的化学反应,影响生物体的正常运作。
此外,蛋白质的部分残基也参与激酶活性的转换,从而影响蛋白质的结构和功能。
二、结论蛋白质是一种独具特性的物质,它不仅是活体组成的重要物质,而且具有独特的理化性质,例如温度、pH值、蛋白质结构以及脱水作用等。
这些理化特性既能反映到生物体的本质特性,又能在实验室中用于分析和定量。
因此,研究植物蛋白质的理化性质具有重要的理论和应用价值。
蛋白质的理化性质(一)
关键词:蛋白质蛋白质是由氨基酸组成的大分子化合物,其理化性质一部分与氨基酸相似,如两性电离、等电点、呈色反应、成盐反应等,也有一部分又不同于氨基酸,如高分子量、胶体性、变性等。
一、蛋白质的胶体性质
蛋白质分子量颇大,介于一万到百万之间,故其分子的大小已达到胶粒1~100nm范围之内。
球状蛋白质的表面多亲水基团,具有强烈地吸引水分子作用,使蛋白质分子表面常为多层水分子所包围,称水化膜,从而阻止蛋白质颗粒的相互聚集。
与低分子物质比较,蛋白质分子扩散速度慢,不易透过半透膜,粘度大,在分离提纯蛋白质过程中,我们可利用蛋白质的这一性质,将混有小分子杂质的蛋白质溶液放于半透膜制成的囊内,置于流动水或适宜的缓冲液中,小分子杂质皆易从囊中透出,保留了比较纯化的囊内蛋白质,这种方法称为透析(dialysis)。
蛋白质大分子溶液在一定溶剂中超速离心时可发生沉降。
沉降速度与向心加速度之比值即为蛋白质的沉降系数S。
校正溶剂为水,温度20℃时的沉降系数S20·w可按下式计算:式中X 为沉降界面至转轴中心的距离,W为转子角速度,W2X为向心加速度,dX/dt为沉降速度。
单位用S,即Svedberg单位,为1×1013秒,分子愈大,沉降系数愈高,故可根据沉降系数来分离和检定蛋白质。
二、蛋白质的两性电离和等电点
蛋白质是由氨基酸组成的,其分子中除两端的游离氨基和羧基外,侧链中尚有一些解离基,如谷氨酸、天门冬氨酸残基中的γ和β-羧基,赖氨酸残基中的ε-氨基,精氨酸残基的胍基和组氨酸的咪唑基。
作为带电颗粒它可以在电场中移动,移动方向取决于蛋白质分子所带的电荷。
蛋白质颗粒在溶液中所带的电荷,既取决于其分子组成中碱性和酸性氨基酸的含量,又受所处溶液的pH影响。
当蛋白质溶液处于某一pH时,蛋白质游离成正、负离子的趋势相等,即成为兼性离子(zwitterion,净电荷为O),此时溶液的pH值称为蛋白质的等电点(isoelectricpoint,简写pI)。
处于等电点的蛋白质颗粒,在电场中并不移动。
蛋白质溶液的pH 大于等电点,该蛋白质颗粒带负电荷,反之则带正电荷。
各种蛋白质分子由于所含的碱性氨基酸和酸性氨基酸的数目不同,因而有各自的等电点。
凡碱性氨基酸含量较多的蛋白质,等电点就偏碱性,如组蛋白、精蛋白等。
反之,凡酸性氨基酸含量较多的蛋白质,等电点就偏酸性,人体体液中许多蛋白质的等电点在pH5.0左右,所以在体液中以负离子形式存在。
三、蛋白质的变性
天然蛋白质的严密结构在某些物理或化学因素作用下,其特定的空间结构被破坏,从而导致理化性质改变和生物学活性的丧失,如酶失去催化活力,激素丧失活性称之为蛋白质的变性作用(denaturation)。
变性蛋白质只有空间构象的破坏,一般认为蛋白质变性本质是次级键,二硫键的破坏,并不涉及一级结构的变化。
变性蛋白质和天然蛋白质最明显的区别是溶解度降低,同时蛋白质的粘度增加,结晶性破坏,生物学活性丧失,易被蛋白酶分解。
引起蛋白质变性的原因可分为物理和化学因素两类。
物理因素可以是加热、加压、脱水、搅拌、振荡、紫外线照射、超声波的作用等;化学因素有强酸、强碱、尿素、重金属盐、十二烷基磺酸钠(SDS)等。
在临床医学上,变性因素常被应用于消毒及灭菌。
反之,注意防止蛋白质变性就能有效地保存蛋白质制剂。
变性并非是不可逆的变化,当变性程度较轻时,如去除变性因素,有的蛋白质仍能恢复或部分恢复其原来的构象及功能,变性的可逆变化称为复性。
例如,前述的核糖核酸酶中四对二硫键及其氢键。
在巯基乙醇和8M尿素作用下,发生变性,失去生物学活性,变性后如
经过透析去除尿素,巯基乙醇,并设法使疏基氧化成二硫键,酶蛋白又可恢复其原来的构象,生物学活性也几乎全部恢复,此称变性核糖核酸酶的复性。
许多蛋白质变性时被破坏严重,不能恢复,称为不可逆性变性。
四、蛋白质的沉淀
蛋白质分子凝聚从溶液中析出的现象称为蛋白质沉淀(precipitation),变性蛋白质一般易于沉淀,但也可不变性而使蛋白质沉淀,在一定条件下,变性的蛋白质也可不发生沉淀。
蛋白质所形成的亲水胶体颗粒具有两种稳定因素,即颗粒表面的水化层和电荷。
若无外加条件,不致互相凝集。
然而除掉这两个稳定因素(如调节溶液pH至等电点和加入脱水剂)蛋白质便容易凝集析出。
从图1-0可以看出,如将蛋白质溶液pH调节到等电点,蛋白质分子呈等电状态,虽然分子间同性电荷相互排斥作用消失了。
但是还有水化膜起保护作用,一般不致于发生凝聚作用,如果这时再加入某种脱水剂,除去蛋白质分子的水化膜,则蛋白质分子就会互相凝聚而析出沉淀;反之,若先使蛋白质脱水,然后再调节pH到等电点,也同样可使蛋白质沉淀析出。
引起蛋白质沉淀的主要方法有下述几种:
(一)盐析(SaltingOut)
在蛋白质溶液中加入大量的中性盐以破坏蛋白质的胶体稳定性而使其析出,这种方法称为盐析。
常用的中性盐有硫酸铵、硫酸钠、氯化钠等。
各种蛋白质盐析时所需的盐浓度及pH不同,故可用于对混和蛋白质组分的分离。
例如用半饱和的硫酸铵来沉淀出血清中的球蛋白,饱和硫酸铵可以使血清中的白蛋白、球蛋白都沉淀出来,盐析沉淀的蛋白质,经透析除盐,仍保证蛋白质的活性。
调节蛋白质溶液的pH至等电点后,再用盐析法则蛋白质沉淀的效果更好。
(二)重金属盐沉淀蛋白质
蛋白质可以与重金属离子如汞、铅、铜、银等结合成盐沉淀,沉淀的条件以pH稍大于等电点为宜。
因为此时蛋白质分子有较多的负离子易与重金属离子结合成盐。
重金属沉淀的蛋白质常是变性的,但若在低温条件下,并控制重金属离子浓度,也可用于分离制备不变性的蛋白质。