有机化学考研复习全资料-卤代烃
- 格式:doc
- 大小:393.00 KB
- 文档页数:16


《卤代烃》讲义一、卤代烃的定义和分类卤代烃是烃分子中的氢原子被卤素原子取代后所形成的化合物。
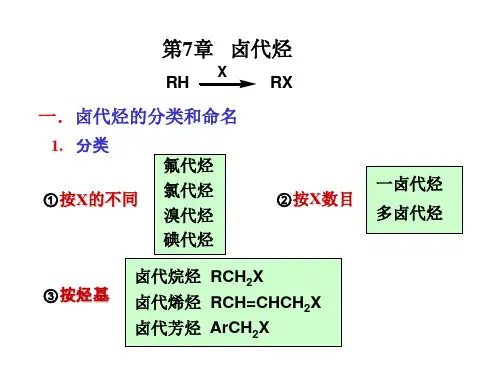
根据卤素原子的种类,可以分为氟代烃、氯代烃、溴代烃和碘代烃。
根据分子中卤素原子的数目,又可以分为一卤代烃和多卤代烃。
常见的一卤代烃有氯甲烷(CH₃Cl)、溴乙烷(C₂H₅Br)等。
多卤代烃如二氯甲烷(CH₂Cl₂)、三氯甲烷(CHCl₃)等。
从烃基的结构来看,卤代烃还可以分为饱和卤代烃(如卤代烷烃)、不饱和卤代烃(如卤代烯烃、卤代炔烃)和芳香卤代烃。
二、卤代烃的物理性质卤代烃的物理性质通常与其结构和分子间作用力有关。
在常温常压下,一氯甲烷、氯乙烷等是气体,其余的一卤代烃多为液体,而高级卤代烃则是固体。
卤代烃的沸点随碳原子数的增加而升高。
同碳原子数的卤代烃,沸点的高低顺序为:RI>RBr>RCl>RF。
这是因为相对分子质量越大,分子间的范德华力越大,沸点也就越高。
卤代烃的密度通常大于相应的烃。
一氯代烃的密度一般小于水,而多氯代烃的密度则大于水。
卤代烃大多不溶于水,能溶于有机溶剂,如乙醇、乙醚等。
三、卤代烃的化学性质卤代烃的化学性质比较活泼,这是由于卤素原子的电负性较大,使得碳卤键具有较强的极性。
1、取代反应卤代烃中的卤素原子可以被其他原子或基团取代。
例如,溴乙烷与氢氧化钠水溶液共热时,发生水解反应,生成乙醇:C₂H₅Br +NaOH → C₂H₅OH + NaBr这是一个典型的亲核取代反应,氢氧化钠中的羟基(OH⁻)作为亲核试剂进攻卤代烃中的碳原子,取代了卤素原子。
2、消去反应在一定条件下,卤代烃分子中的卤素原子和相邻碳原子上的氢原子可以脱去,生成不饱和烃。
例如,溴乙烷与氢氧化钠的乙醇溶液共热时,发生消去反应,生成乙烯:C₂H₅Br + N aOH → C₂H₄↑ + NaBr + H₂O消去反应的发生需要满足一定的结构条件,即与卤素原子相连的碳原子的相邻碳原子上必须有氢原子。
3、与金属反应卤代烃可以与金属镁在无水乙醚中反应,生成格氏试剂。


卤代烃一定义卤代烃:烃分子中的氢原子被卤素取代。
卤原子(F、Cl、Br、I)是卤代烃的官能团。
δ+δC X 二、卤代烃的分类1、按卤原子分类:氟、氯、溴、碘代烃。
2、按烃基结构分类:饱和卤代烃、不饱和卤代烃、卤代芳烃。
3、按与卤原子相连的碳原子级数分类:伯、仲、叔卤代烃。
4、按X 的数目:一卤代烃多卤代烃三、卤代烃的命名1.普通命名法:按与卤素相连的烃基来命名,称为“某基卤”2.系统命名(规则:卤原子做取代基。
)卤素取代芳环氢时,以芳烃作母体.四、卤代烃的物理性质卤代烃的密度一般比水大,分子中卤原子越多密度越大五、卤代烃的化学性质1亲核取代反应(常见亲核试剂:H2O , NH3 , OH-, RO-, CN-等。
)(一)水解:卤代烃与NaOH 水溶液共热,生成醇。
例:C 5H 11Cl +NaOHH 2OC 5H 11OH +NaCl(二)醇解反应(R-X一般为伯RX。
)例:CH3Br+CH3CH3CCH3ONa CH3CH3CCH3OCH3+NaBr(三)氨解反应例:C4H9Br+2NH3(四)氰解反应C4H9NH2+NH4Br 例:C2H5Br+NaCNEtOHC2H5CN+NaBr丙腈(五)与硝酸银反应R-X + AgNO3醇R-O NO2 + AgX硝酸酯室温下立即产生AgX沉淀者,为活性卤,即苄卤、烯丙卤、叔卤、碘代烃加热后才出现AgX沉淀者,为仲和伯卤代烷加热后仍不反应者,为惰性卤,即芳卤和乙烯卤(六)、消除反应(卤代烃与强碱的醇溶液加热作用时,发生消除反应)从含H较少的β-C上脱氢,称为Saytzeff规则即雪上加霜(七)、与金属反应卤代烃可以与金属(Li、Na、K、Mg、Al、Cd ....)反应生成金属有机化合物。
R XR+MgH无水乙醚RMgXR H+Mg(OH)XH+H2O水R格氏试剂易与含活泼H的化合物如H2O、R-OH、R-NH2反应生成相应的烃。
MgX+OH格氏试剂还易与含羰基的化合物发生亲核加成反应,制备醇和羧酸R MgX+CO2RCHO+R'Mg无水乙醚RCOOMgXOMgXR CHR'RCOOHOHCHR'六、取代反应与消除反应的竞争(一)卤代烃的结构影响消除增加R-X = CH3-X,1o,2o,3o取代增加(二)温度的影响(升高温度有利于消除)CH3CHCH3+ OHBr-80%C2H5OHOH OC2H5ECH3CHCH3+ CH3CHCH3+ CH3CH=CH2S N50o C 42% 58%80o C 39% 61%100o C 34% 66%(三)试剂的碱性强碱、位阻碱或增加碱的浓度,有利于消除反应一般规律是:伯卤烷、稀碱、低温有利于取代反应叔卤烷、浓的强碱、高温有利于消除反应。

卤代烃知识点总结一、概念介绍卤代烃是指分子中含有卤素原子(氟、氯、溴、碘)的有机化合物,也称为卤代烷。
其分子式为CnH2n+1X,其中X表示卤素原子。
二、命名规则1. 找到主链:选择含有最多碳原子的连续链作为主链。
2. 确定取代基位置:用最小的数来表示取代基在主链上的位置。
3. 确定取代基种类:用前缀表示取代基种类,如氯代(chloro-)、溴代(bromo-)、碘代(iodo-)等。
4. 组合前缀和主名:将前缀和主名组合在一起即可得到完整的化合物名称。
三、物理性质1. 沸点和熔点:随着分子量的增加,沸点和熔点逐渐增加。
2. 密度:通常情况下,卤代烃比水密度大。
3. 溶解性:卤代烃在非极性溶剂中易溶解,在极性溶剂中不易溶解。
四、化学性质1. 取代反应:由于卤素原子具有较强的电负性,因此容易被亲电试剂取代,如氢氧化钠、氢氧化钾等。
2. 消除反应:卤代烃在碱性条件下可以发生消除反应,生成烯烃或炔烃。
3. 氢化反应:卤代烃可以与氢气在催化剂存在下发生加氢反应,生成相应的饱和烃。
4. 氧化反应:卤代烃可以被强氧化剂如高锰酸钾、过硫酸钾等氧化,生成相应的醇、醛、羧酸等。
五、毒性与环境影响1. 毒性:由于卤素原子的电负性和惰性,使得卤代烷比相应的烷基化合物具有更大的毒性。
长期暴露于卤代烷中会导致神经系统损害、肝脏损伤等。
2. 环境影响:卤代烷具有较强的毒性和不良环境影响。
其中最为典型的是三氯乙烯(C2HCl3),它是一种广泛使用的工业溶剂,对水体和土壤污染严重。
六、应用领域1. 医药领域:卤代烷作为一种重要的有机合成中间体,广泛应用于医药领域,如氯霉素、盐酸利多卡因等。
2. 农业领域:卤代烷作为杀虫剂和除草剂的主要原料,广泛应用于农业生产中。
3. 工业领域:卤代烷作为溶剂和清洗剂的主要原料,在化工、电子、纺织等行业得到广泛应用。

有机化学卤代烃知识点有机化学中,卤代烃是一类以卤素取代烃基的有机化合物。
常见的卤素包括氟、氯、溴和碘。
卤代烃是许多化学反应的重要试剂和中间体,并且在药物、农药和材料科学等领域中具有广泛的应用。
本文将介绍卤代烃的合成方法、反应性质和应用。
一、合成方法:1.卤代烃可以通过卤素与饱和烃反应得到。
反应条件包括温度、反应物摩尔比例和反应时间等。
以氯化亚铜作为催化剂,可以加速卤化反应的进行。
2.卤代烃还可以通过卤素与不饱和烃反应得到。
不饱和烃中的双键或三键易于被卤素攻击,形成卤代烃。
这种反应通常需要光照或加热条件。
3.邻位和对位取代反应也是一种重要的合成卤代烃的方法。
邻位和对位取代反应可以通过亲电体取代或自由基置换反应实现。
亲电体取代适用于反应物中含有活泼卤素的情况,自由基置换适用于反应物中含有活泼氢原子的情况。
二、反应性质:1.亲电取代反应:卤代烃中卤素与亲电试剂发生反应,取代掉卤素原子。
常见的亲电试剂包括亲核试剂和亲电试剂。
例如,卤代烃与亲核试剂氢氧根离子(OH-)反应生成醇;卤代烃与亲电试剂亚硫酰氯(SOCl2)反应生成亚硫酰卤。
2.消除反应:卤代烃中相邻的两个碳原子之间存在α-和β-位关系。
当α-位和β-位上存在不同的官能团时,消除反应可能发生。
例如,卤代烃与碱反应可以生成烯烃。
3.重排反应:卤代烃在适当的条件下,可以发生重排反应,产生更稳定的碳碳键排列方式。
重排反应对于有机合成具有重要的意义,可以实现环化反应或产生特定官能团。
三、应用:1.药物和医疗领域:卤代烃常被用作抗菌药物、抗病毒药物和麻醉药物的前体。
例如,卤代烃被用作植物中药物提取物的酯化试剂,可以增强其生物活性。
2.材料科学:卤代烃可用于合成具有特定结构和性质的聚合物。
例如,氟代烃可以用于制备具有超低表面张力和耐热性的涂料材料。
3.农药和防腐剂:卤代烃具有杀虫和防腐的特性,常被用于制备农药和木材防腐剂。
总结:卤代烃是一类重要的有机化合物,具有丰富的合成方法和多样的反应性质。


第九章卤代烃一、基本内容1. 定义和分类烃分子中的一个或多个氢原子被卤原子取代所形成的化合物称卤代烃。
本章重点讨论单卤代烃。
单卤代烃用通式RX表示,R为烃基;X为卤原子(F、Cl、Br、I),是卤代烃的官能团。
用RX 表示单卤代烷烃时,R 为烷基,如:1-溴丁烷、2-氯丙烷、氟代环己烷等。
其结构特征为和卤原子成键的碳原子是sp3杂化的。
X连结在烯烃碳碳双键碳原子(sp2杂化)上的称作乙烯基卤代烃(简称烯卤),如氯乙烯、1-氯丙烯等。
X连结在芳基上的称作卤代芳烃(简称芳卤),如溴苯。
卤原子连结在烯丙基的亚甲基碳原子(sp3杂化)上的卤代烃被称为烯丙基卤代烃,如:3-溴丙烯(简称烯丙基溴)、苄基氯等。
在单卤代烷烃中(氯甲烷除外) ,将卤原子分别连结在伯、仲、叔碳原子上的卤代烷分别称作伯、仲、叔卤代烷。
2. 反应卤代烃可以用于多种反应,如碳碳键的形成和官能团的转换等。
因此,卤代烃多用作有机合成试剂或有机合成的中间体,在有机合成中起着重要的作用。
卤代烃的主要反应有:亲核取代反应、消除反应、和活泼金属的反应、还原反应等。
单卤代烷烃的反应活性为:RI>RBr>RCl>RF (请注意,和其他卤代烃相比,氟代烃的性质比较特殊)。
卤原子相同时, 不同烃基的单卤代烃的反应的活性为:烯丙基卤代烃 >卤代烷烃〉乙烯基卤代烃或卤代芳烃。
3. 制备主要制备方法:烯烃和卤化氢及卤素(CI2、B「2)的加成;烃的卤代;醇与氢卤酸、卤化磷、及与亚硫酰氯的反应;卤原子互换;芳烃的亲电取代等。
二、重点与难点评述本章的重点是卤代烃的重要反应及其应用和亲核取代反应历程。
重要反应有亲核取代反应、消除反应、和活泼金属的反应等。
历程主要是指S N1 和S N2 历程。
难点是对结构与性质的关系、影响亲核取代反应的因素、亲核取代和消除反应的竞争等的认识和理解。
1.结构与性质卤代烃的性质主要取决于碳卤键和烃基的结构。
碳卤键越容易断裂,愈易发生反应。

有机化学基础知识点整理卤代烃的消除和亲电取代反应有机化学基础知识点整理卤代烃的消除和亲电取代反应在有机化学中,卤代烃是一种重要的化合物,它们可以发生多种反应,其中包括消除和亲电取代反应。
本文将对卤代烃的消除和亲电取代反应进行整理和讨论。
一、卤代烃的消除反应1. 反应机制卤代烃的消除反应是指在适当的条件下,卤代烃中的卤素原子与相邻碳原子之间的化学键断裂,产生烯烃和卤化氢。
消除反应通常按照双键的生成方式可以分为两种类型:β-消除和α-消除。
β-消除反应指的是在β位(相对于卤素原子的位置)发生消除反应,生成双键。
α-消除反应指的是在α位(相对于卤素原子的位置)发生消除反应,生成双键。
2. 常见的消除反应类型(1)卤代烃的脱氢消除反应脱氢消除反应是指卤代烃分子中的卤素原子与相邻碳原子之间的化学键断裂,同时分子中的氢原子与碳原子之间的化学键形成,产生烯烃。
常见的脱氢消除反应包括醇的脱水反应、酸的脱水反应等。
(2)卤代烃的脱卤反应脱卤反应是指卤代烃分子中的卤素原子与相邻碳原子之间的化学键断裂,同时形成碳-碳双键,产生烯烃。
脱卤反应通常需要加热或使用碱性条件。
3. 反应条件和机理卤代烃的消除反应通常需要适当的反应条件和催化剂。
例如,氢氧化钠(NaOH)和醇可以促进卤代烃的脱卤反应。
消除反应的机理通常涉及碱性条件下的亲核取代和质子转移等步骤。
二、卤代烃的亲电取代反应亲电取代反应是指卤代烃中的卤素原子被亲电试剂(如卤化钠、卤化铜等)取代的反应。
1. 反应机制卤代烃的亲电取代反应是指卤素原子与亲电试剂之间发生化学反应,断裂卤素原子与相邻碳原子之间的化学键,同时形成新的化学键。
2. 常见的亲电取代反应类型(1)醇与卤代烃的亲电取代反应醇与卤代烃的亲电取代反应通常需要使用酸性催化剂,如盐酸、硫酸等。
反应机制涉及到醇分子的质子化和亲电取代等步骤。
(2)亲电试剂与卤代烃的亲电取代反应除了醇之外,其他亲电试剂也可以与卤代烃发生亲电取代反应。
有机化学基础知识点整理卤代烃的发生与取代反应有机化学基础知识点整理卤代烃的发生与取代反应有机化学是研究碳与其它元素之间的化学反应的科学,其中烃是其中最基本的有机化合物。
卤代烃是一类重要的有机化合物,具有广泛的应用领域。
本文将整理卤代烃的发生与取代反应的基本知识点,帮助读者更好地理解和掌握这个领域的内容。
首先,我们来了解卤代烃的定义。
卤代烃是含有卤素原子(如氯、溴、碘等)取代了烃分子中的一个或多个氢原子的有机化合物。
卤代烃可以按照卤素原子取代的数量分为单卤代烃、二卤代烃、三卤代烃等。
一、卤代烃的发生反应1. 卤代烃的制备方法卤代烃可以通过直接将卤素与烃反应来制备。
常用的方法包括氯化、溴化和碘化等。
例如,将氯气通入已经饱和的烃溶液中,可以制备单卤代烃。
制备二卤代烃时,通常首先制备单卤代烃,再进行进一步反应。
2. 卤代烃的饱和与不饱和度卤代烃可以是饱和的或不饱和的。
饱和的卤代烃中,烃分子中所有氢原子都被卤素原子取代了;而不饱和的卤代烃中,烃分子中仍存在着未被卤素取代的氢原子。
3. 卤代烃的亲核取代反应卤代烃是一种非常重要的化合物,因为它们可以进一步发生亲核取代反应。
亲核取代反应是指有机分子中的一个亲核试剂与卤代烃反应,取代其中的卤素原子。
这种反应是有机化学中最常见的反应类型之一。
二、卤代烃的取代反应1. 构成卤代烃的成键方式卤代烃中的碳-卤键(C-X)是该化合物的特点之一。
在卤代烃中,碳原子与卤素原子之间通过共价键相连。
这种成键方式决定了卤代烃的化学性质和反应性质。
2. 卤代烃的亲电取代反应亲电取代反应是卤代烃的一种重要反应类型。
在亲电取代反应中,卤代烃的卤素原子被另一亲电试剂取代。
亲电试剂可以是其他有机化合物,如醇、酚、胺等。
这种反应通常是通过催化剂的存在下进行,以促进反应的进行。
3. 卤代烃的亲核取代反应亲核取代反应是卤代烃的另一种常见反应类型。
在亲核取代反应中,卤代烃的卤素原子被一个亲核试剂取代。
有机化学基础知识点整理卤代烃的消除和亲电取代反应机理有机化学基础知识点整理卤代烃的消除和亲电取代反应机理在有机化学中,卤代烃是一类重要的化合物,其具有较高的反应活性,可以经历多种反应。
其中,卤代烃的消除反应和亲电取代反应是常见的反应类型。
本文将对卤代烃的消除反应和亲电取代反应进行基础知识点整理和机理解析。
一、卤代烃的消除反应卤代烃的消除反应是指在适当的反应条件下,卤代烃中的卤素原子(如氯、溴)与相邻的氢原子发生反应,并释放出卤化氢。
此反应类型广泛应用于有机合成中,常用于合成烯烃和炔烃化合物。
1. β-消除反应β-消除反应指的是卤代烃中卤素原子与分子内的β-碳原子(即相邻的碳原子)之间发生反应,生成烯烃或炔烃。
常见的β-消除反应有醇醚消除反应和醇醚消除脱水反应。
(1)醇醚消除反应醇醚消除反应是指卤代烃与醇或醚反应后脱去一个分子的水或醚分子,生成烯烃或炔烃。
这种反应常用碱性条件,如氢氧化钠(NaOH)、氢氧化钾(KOH)等碱催化剂。
示例反应:R-X + OH- → R-H + X-(溴代烷→烷烃)(2)醇醚消除脱水反应醇醚消除脱水反应是指卤代烃与醇反应生成烯烃或炔烃,并同时脱去一个分子的水分子。
这种反应通常在酸性条件下进行,并使用热催化剂如硫酸(H2SO4)、磷酸(H3PO4)等。
示例反应:R-X + alcohol → R-H + X-(卤代烷→ 烷烃)2. α-消除反应α-消除反应指的是卤代烃中卤素原子与分子内的α-碳原子(即距离卤素原子最近的碳原子)之间发生反应,生成烯烃或炔烃。
α-消除反应通常需要较高的反应温度和碱性或酸性催化剂的存在。
示例反应:R-X → R-C≡C-X(卤代烃→ 炔烃)二、卤代烃的亲电取代反应亲电取代反应是指卤代烃中的卤素原子(如氯、溴)与亲电试剂发生反应,取代卤素原子的位置,生成新的官能团或化合物。
亲电取代反应是有机合成中最常见的反应类型之一。
1. 氢化反应氢化反应是指卤代烃中的卤素原子被氢原子取代,生成相应的烷烃。
有机化学基础知识点卤代烃的命名和结构有机化学基础知识点:卤代烃的命名和结构有机化学是研究有机化合物结构、性质以及它们之间的反应的学科。
其中,卤代烃是一类重要的有机化合物,它们在生物体系、合成有机化学和药物领域中有着广泛的应用。
本文将重点介绍卤代烃的命名和结构。
一、卤代烃的定义和特点卤代烃是指分子中含有卤素(氟、氯、溴、碘)取代烃基的有机化合物。
它们的分子结构通常较简单,且具有明确的取代位置。
卤代烃可以根据卤素在烃分子中的取代位置分类为: 1度卤代烃、2度卤代烃和3度卤代烃。
其中,1度卤代烃是指只有一个碳原子与卤素原子相连;2度卤代烃是指两个碳原子与卤素原子相连;3度卤代烃则是指三个碳原子与卤素原子相连。
二、卤代烃的命名规则卤代烃的命名主要基于以下原则:确定主链、编号、指定卤素取代位置和名称。
1. 确定主链在一个分子中,选取有机碳链最长的一条作为主链。
2. 编号以主链上最近的一个官能团为起点,逐个编号各个碳原子。
3. 指定卤素取代位置用数字表示卤素取代碳原子的位置,并在碳原子编号之前加上相应的前缀。
氟代烃用"F-"表示,氯代烃用"Cl-"表示,溴代烃用"Br-"表示,碘代烃用"I-"表示。
4. 命名将所有取代官能团按字母顺序排列,列在化合物名称的前面。
此外,如果主链中有重复的取代基,则用相应的前缀表示其个数。
三、结构示例以下是几个常见的卤代烃的命名和结构示例。
1. 1-氯丙烷 (1-Chloropropane)结构示意图:CH3CH2CH2Cl2. 2,2-二氯丙烷 (2,2-Dichloropropane)结构示意图:CH3CHClCH33. 1,2,3-三溴戊烷 (1,2,3-Tribromopentane)结构示意图:CH2CH2CH2CHBrCH2Br以上示例展示了不同取代位置和不同卤素的卤代烃的命名和结构。
通过了解卤代烃的命名规则和结构特点,我们可以更好地理解和应用有机化学在实际问题中。
第九章卤代烃一、基本容1.定义和分类烃分子中的一个或多个氢原子被卤原子取代所形成的化合物称卤代烃。
本章重点讨论单卤代烃。
单卤代烃用通式RX表示,R为烃基;X为卤原子(F、Cl、Br、I),是卤代烃的官能团。
用RX表示单卤代烷烃时,R为烷基,如:1-溴丁烷、2-氯丙烷、氟代环己烷等。
其结构特征为和卤原子成键的碳原子是sp3杂化的。
X连结在烯烃碳碳双键碳原子(sp2杂化)上的称作乙烯基卤代烃(简称烯卤),如氯乙烯、1-氯丙烯等。
X连结在芳基上的称作卤代芳烃(简称芳卤),如溴苯。
卤原子连结在烯丙基的亚甲基碳原子(sp3杂化)上的卤代烃被称为烯丙基卤代烃,如:3-溴丙烯(简称烯丙基溴)、苄基氯等。
在单卤代烷烃中(氯甲烷除外),将卤原子分别连结在伯、仲、叔碳原子上的卤代烷分别称作伯、仲、叔卤代烷。
2.反应卤代烃可以用于多种反应,如碳碳键的形成和官能团的转换等。
因此,卤代烃多用作有机合成试剂或有机合成的中间体,在有机合成中起着重要的作用。
卤代烃的主要反应有:亲核取代反应、消除反应、和活泼金属的反应、还原反应等。
单卤代烷烃的反应活性为:RI>RBr>RCl>RF(请注意,和其他卤代烃相比,氟代烃的性质比较特殊)。
卤原子相同时,不同烃基的单卤代烃的反应的活性为:烯丙基卤代烃>卤代烷烃>乙烯基卤代烃或卤代芳烃。
3.制备主要制备方法:烯烃和卤化氢及卤素(Cl2、Br2)的加成;烃的卤代;醇与氢卤酸、卤化磷、及与亚硫酰氯的反应;卤原子互换;芳烃的亲电取代等。
二、重点与难点评述本章的重点是卤代烃的重要反应及其应用和亲核取代反应历程。
重要反应有亲核取代反应、消除反应、和活泼金属的反应等。
历程主要是指S N1和S N2历程。
难点是对结构与性质的关系、影响亲核取代反应的因素、亲核取代和消除反应的竞争等的认识和理解。
1.结构与性质卤代烃的性质主要取决于碳卤键和烃基的结构。
碳卤键越容易断裂,愈易发生反应。
1卤原子的电负性为F>Cl>Br>I,均大于碳原子的电负性。
碳卤键是极性共价键,成键电子偏向于卤原子,碳原子显部分正性。
富电子的亲核试剂进攻显正性的碳原子或碳正离子,卤原子带着一对电子离去的反应称为亲核取代反应。
卤原子的可极化性为I>Br>Cl>F,反应物与反应物、溶剂或亲核试剂间的相互极化作用使碳卤键的成键电子对更加偏向于卤原子,极化作用有助于碳卤键的异裂。
卤原子中,碘原子的原子半径最大、电负性最小,因而碳碘键最易被极化。
氟原子的原子半径最小、电负性最大,碳氟键最难被极化。
因此,单卤代烷烃的亲核取代反应的活性为:RI>RBr>RCl>RF。
单卤代烷烃的碳卤键中,碳氟键最短、键能最大、最难被极化,因此,一氟代烷烃不易发生反应。
卤原子相同时,乙烯基卤代烃和卤代芳烃不如卤代烷活泼。
在乙烯基卤代烃和卤代芳烃中,和sp2杂化的碳原子成键的卤原子与碳碳Π键间的PΠ共轭作用使碳卤键键能增强(和卤代烷相比),反应活性降低。
因此,乙烯基卤代烃和卤代芳烃不如卤代烷烃活泼。
卤原子相同时,烯丙基卤代烃比卤代烷活泼。
这是因为碳卤键断裂的过程中,渐显正性的碳原子上的正电荷可被相邻碳碳双键上的电子部分中和,降低了反应的活化能的缘故。
这里需要再次指出的是,性质和活性与反应物的结构和反应条件密切相关,不可仅仅根据某支键的特点枉下结论。
例如,2,4-二硝基氯苯易与氨反应生成2,4-二硝基苯胺,氯苯则不能;2,4-二硝基氟苯能与氨基酸的氨基反应,氟苯则不能(祥见氨基酸一章)。
2.亲核取代反应和亲核取代反应的历程2.1 S N2反应S N2反应中没有中间体生成,反应过渡态的能量决定了反应的速度,过渡态的能量低、反应速度快;过渡态的能量高、反应速度慢。
过渡态的能量主要取决于如下因素:(1)烃基的结构。
(2)亲核试剂的性质。
(3) 离去基团的性质。
(4) 进攻原子的电负性。
(5) 进攻原子的可极化性。
(6) 溶剂的影响。
卤代烃的烃基和亲核试剂的体积增大均不利于亲核试剂从碳卤键的背向向碳原子进攻,对反应不利。
进攻原子的电负性大,不利于亲核试剂向碳卤键的碳原子进攻时提供电子,对反应不利。
离去基团的可极化性强,有利于离去基团的离去;进攻原子的可极化性强(即变形大,如从近于球形变成雪茄形),有利于亲核试剂从碳卤键的背向向碳原子进攻,对反应有利。
溶剂对反应的影响比较复杂,我们将结合习题对此加以讨论。
2.2S N1反应S N1反应是单分子反应,反应速率取决于反应条件下卤代烃的碳卤键断裂的难易。
碳卤键断裂后所形成的碳正离子中间体的稳定性决定了碳卤键断裂时所经历的过渡态的能量。
所形成的碳正离子越稳定,碳卤键断裂时所经历的过渡态的能量越低,反应速度快、容易进行。
可见亲核试剂的亲核性对反应速率的影响不大,而离去基团和烃基的结构及溶剂的性质对反应速率有重要影响。
由上面的讨论可总结出:(1)离去基团的可极化性强,对按S N1和S N2历程进行的反应均有利。
(2)在卤代烷烃中,按S N1历程进行的反应的速率为:30>20>10>CH3X(和碳正离子的稳定性顺序一致);按S N2历程进行的反应的速率2与此相反(主要考虑烃基的体积)。
对某个具体的反应加以分析时,要将影响反应的因素加以综合考虑才能得出合理的推测。
但是,抓住影响反应的主要因素不失为一种更为合理的思考问题的方法。
2.3一元化离子对机理反应过程中的立体化学研究对推测反应历程是非常重要的。
S N2历程的立体化学特征是产物的构型和反应物的构型相反(Walden 瓦尔登转化)。
S N1历程的立体化学特征是产物的部分外消旋化,这和前述的反应机理难以完全吻合。
若碳正离子采取平面三角形构型,亲核试剂从平面两侧进攻的几率应该相等,产物应全部外消旋化,这和大多数实验事实不符。
实际上,S N1和S N2机理是两种极限情况,便于理解、用起来比较容易,是必须掌握的容。
一元化离子对机理则可用来解释更多的亲核取代反应。
这一机理的优点是不但考虑到了更多的影响反应的因素(如溶剂的影响等),而且可用于解释更多的反应事实。
事实上,要想弄清或逼近反应进行的真实情况,需得到从反应物到产物变化过程中每一刻的状态及其能量。
测试仪器的进步(已能测到皮秒级)和理论的完善已经使许多反应的机理更为清晰,许多问题还有待于同学们今后用创造性地工作和辛勤劳动来解决。
3.亲核取代和消除反应的竞争卤代烃的亲核取代和消除反应中均涉及到两个共性问题:(1).亲核试剂和碱都是富电子物种。
(2).反应中均涉及到碳卤键的断裂。
因此,亲核取代反应和消除反应间存在竞争。
一般来说,碱性强有利于消除反应,亲核性强有利于亲核取代反应。
若要对这些问题加以详细地探讨,需要对反应机理加以理解。
有关消除反应的机理将在下一章加以介绍,这里仅对亲核性和碱性的关系做一概括。
粗略地看,碱性越强、亲核性也越强。
但需注意,亲核性和碱性是两个不同的概念。
碱性是一种热力学现象,亲核性则仅仅用于动力学的研究中。
在这里,碱性的强弱可理解为拔取氢原子的能力;亲核性可视为亲核试剂提供一对电子和反应物的某一原子(主要是碳原子)之间成键的能力。
由此可见,空间因素对亲核性有着更为重要的影响。
例如,叔丁醇钠是一种强碱,但却是一种弱的亲核试剂。
这是由于将叔丁醇钠作为亲核试剂时,体积较大的叔丁基阻碍了其向反应物分子中的碳原子接近的缘故,因此常将其称为不亲核碱。
可极化性是影响亲核性的另一重要因素。
例如,氢硫酸或硫醇(RSH)的酸性分别比水和醇的酸性强,因尔硫氢根负离子和烷硫基负离子的碱性分别比氢氧根负离子和烷氧基负离子的碱性弱。
这可从它们的电离常数的比较中看出(热力学性质)。
但是,因硫原子的可极化性比氧原子的大,硫氢根负离子和烷硫基负离子的亲核性分别比氢氧根负离子和烷氧基负离子的亲核性强得多。
考虑到各种影响亲核试剂的因素,排出的对S N2 反应的亲核次序如下:RS > ArS > (H2N)2CS > I > CN > SCN > RO > OH > N3 > Br > ArO> Cl > C5H5N > AcO > H2O三、精选题及其解1.写出一溴代丁烯的各种构型异构体、将其命名、并从结构上加以归类。
3解:(提示:本题用来练习命名、分类等。
)先写出丁烯的各种构型异构体,既有如下四种。
化合物1各个碳上的氢原子均不相同,分别被溴取代后得化合物5、6、7和 8。
化合物6有一手性碳原子,可写出一对对映体。
化合物8中碳碳双键的两个碳原子上分别连有两个不同的原子或基团,可写出两个顺反异构体(请同学自己写出)。
在5、6、7和8中,5为卤代烯烃、6为烯丙式卤代烃、7和8为乙烯式卤代烃(余下的请同学自己写出)。
2.用反应式分别表示正丁基溴、α-溴代乙苯与下列试剂反应的主要产物并指出主要反应的类型。
NaOH(水) (2) KOH(醇) (3)镁,乙醚; 然后加入乙炔 (4) NaI/丙酮 (5) NH 3 (6) NaCN (7) AgNO 3,醇 (8) 丙炔钠 解:(括号的解释为提示容)(1) 正丁醇;水解反应,S N 2。
(2) 1-丁烯;消除反应(强碱性条件,氢氧化钾醇溶液的碱性比氢氧化钾水溶液的碱性强得多)。
(3) 乙炔基溴化镁;氢交换反应(先生成正丁基溴化镁,乙炔的酸性相对较大,和正丁基溴化镁发生氢交换,本反应是制备炔基溴化镁的一种方法)。
(4) 正丁基碘;S N 2(NaI 溶于丙酮,NaBr 不溶于丙酮,生成溴化钠是反应的驱动力)。
(5) 溴化正丁铵;S N 2 。
(6) CH 3(CH 2)2CH 2CN ;S N 2。
(7) CH 3(CH 2)2CH 2NO 3;S N 1(生成不容于醇的溴化银是反应的驱动力)。
(8) 2-庚炔;S N 2 (偶联反应)。
α-溴代乙苯的反应请同学自己写出。
3.写出下列反应的产物。
4CHClCH 3Br2C CH 2CH CH 2H 3C CH 2CBrCH 2H 3C CHBrCH CH 2H 3C CH 2CH CHBr5678H 3CCH 2CH CH 2C C3HH 3C H CC 3HHH 3CC CH 3CH 3H H12345解(括号的解释为提示容):(1) 1-对氯苯基乙醇(亲核取代,苄基氯活泼; 苯基氯不活泼。
)。
(2) 3-氯-1-溴丙烷(亲核取代,和氢溴酸反应时,羟基质子化后使碳氧键易于异裂。
该反应是从伯醇制备伯卤代烃的一种方法。
)(3)参见2题中(4)的解。
(4) 对氯苯基溴化镁。
(5) 3-溴环己烯(NBS 为溴化剂,可使烯烃发生α-溴代反应。
)(6) 对甲基苄基氯(氯甲基化反应,是向具有推电子基的芳环上引入氯甲基的一种方法。