有机化学考研资料 反应式(浙江大学)
- 格式:ppt
- 大小:1.54 MB
- 文档页数:288

有机化学反应方程式1. 烷烃的氧化反应2. 甲烷的氯代反应(游离基的链反应)3. 烷烃的卤代反应(卤代反应活性:叔氢>仲氢>伯氢F2 > Cl2 > Br2 > I2)4. 环烷烃的自由基取代反应5. 环烷烃的加成反应1)催化加氢(催化加氢易到难:环丙烷>环丁烷>环戊烷。
≥6环烷烃更难。
)2)加卤素CH2C CH2+Br2CH2—CH2—CH2H2Br Br3)加卤化氢环丙烷的烷基取代物与HX 开环加成, 环的开裂总是在含最多H 和最少H 的碳原子间进行, 氢加到含氢多的碳原子上。
6. 烯烃的亲电加成反应 1)加卤素卤素的活泼性次序:F 2>Cl 2>Br 2>>I 2 (不反应);烯烃与氟加成太剧烈,往往使反应物完全分解,与碘则难发生加成反应。
溴水褪色,可用于鉴别不饱和键:鉴别烷烃和烯、炔。
该加成反应一定是分步进行的 2)加卤化氢烯烃与卤化氢同样发生分步的、亲电性加成反应HX 对烯烃加成的相对活性:HI > HBr > HCl (与极化度有关)+Br 2BrBr+ HBrCH 3CH 2CH 2Br+ HICH 3CH 2CH 2CH 2IC +X 2C C C X X C +C C C XHHX实验证明主要产物是(Ⅰ)不对称烯烃与卤化氢等极性试剂加成时,氢原子总是加到含氢较多的双键碳原子上。
这就是马尔可夫尼可夫最初提出的规则,简称马氏规则。
3)加硫酸将产物水解,是工业制备醇的一个方法(间接法)4)加水通常烯烃不易与水直接反应,但在硫酸等强酸存在下,烯烃可与水加成生成醇。
7. 烯烃的催化加氢主要得顺式加成产物。
用途主要有将汽油中的烯烃转化为烷烃;不饱和油脂的加氢;用于烯烃的化学分析8.烯烃的自由基加成反应主要产物是反马氏规则的这种现象又称为过氧化物效应,只局限于烯烃与溴化氢的反应。
这时烯烃与溴化氢发生是自由基加成反应。

第一部分名校考研真题第11章酚和醌一、选择题1.下列化合物碱性最强的是()。
[中国科学院-中国科学技术大学2001研]【答案】(A)【解析】酚的碱性与酚羟基上氧的孤对电子有关,氧原子上的电子云密度越大,碱性越强。
氰基、溴原子都为吸电子基,使氧原子上电子云密度降低。
2.下列化合物中,酸性最强的是()。
[天津大学2000研]【答案】(D)【解析】硝基为吸电子基,使邻、对位的电子云密度降低,使酚羟基的酸性增强。
3.下列物种作为离去基团时最易离去的是()。
[大连理工大学2004研]【答案】(A)【解析】硝基为吸电子基,使负电荷得以分散,故(A)最稳定,作为离去基团,最易离去。
二、简答题1.为什么?[上海大学2004研]答:甲氧基的给电子共轭效应使对位电子云密度增大,从而使对位酚羟基的酸性减弱,而间位甲氧基只有吸电子的诱导效应而无给电子的共轭效应,故间甲氧基苯酚的酸性比对甲氧基苯酚强。
2.从反应机理说明为什么烷芳混合醚(ArOR)在与氢碘酸共热时,只得到RI和ArOH,而不是ArI和ROH。
[南京大学2002研]答:醚与氢碘酸共热时先生成烊盐,然后发生碳氧键的断裂,生成醇和碘代烷。
对于混合醚,碳氧键断裂的顺序为:三级烷基>二级烷基>一级烷基>芳基,芳基与氧的孤对电子共轭,因此烷芳混合醚与氢碘酸共热时,芳基与氧相连的碳氧键没有断裂,烷基与氧相连的碳氧键断裂,产物为酚和碘代烷。
3.化合物(A)和(B)中哪个酸性较强?(C)和(D)相比较呢?简述理由。
[华东理工大学2003研]答:硝基的吸电子共轭效应,使邻、对位电子云密度降低,酚羟基的酸性增强,故酸性(B)>(A);甲基的立体效应使(C)中硝基的π-π共轭效应减弱。
化合物(A)和(B)中酸性(B)>(A);化合物(C)和(D)中酸性(D)>(C)。
甲基的立体效应使(C)中硝基的共轭效应减弱。
4.以苯以及必要的有机、无机试剂为原料合成3,4,5-三溴苯酚。
[武汉大学2002研]答:酚羟基为邻对位定位基,若先合成苯酚,再溴化将得到2,4,6一三溴苯酚,而题目要求合成3,4,5一三溴苯酚,故必须借助氨基的定位效应来定位,然后通过重氮化来完成目标产物的合成。

有机化学基础反应方程式汇总1. 甲烷(烷烃通式:C n H 2n +2)甲烷的制取:CH 3CaO △2CO 3+CH 4↑(1)氧化反应甲烷的燃烧:CH 4+2O 2 点燃CO 2+2H 2O甲烷不可使酸性高锰酸钾溶液及溴水褪色。
(2)取代反应CH 4+Cl 光照3Cl(一氯甲烷)+HClCH 3Cl+Cl 光照2Cl 2(二氯甲烷)+HClCH 2Cl 2+Cl 光照3(三氯甲烷)+HCl (CHCl 3又叫氯仿)CHCl 3+Cl 光照4(四氯化碳)+HCl(3)分解反应甲烷分解:CH 高温22. 乙烯(烯烃通式:C n H 2n )乙烯的制取:CH 3CH 2浓硫酸170℃2=CH 2↑+H 2O(消去反应)(1)氧化反应乙烯的燃烧:CH 2=CH 2+3O 点燃2+2H 2O乙烯可以使酸性高锰酸钾溶液褪色,发生氧化反应。
(2)加成反应与溴水加成:CH 2=CH 2+Br 2Br —CH 2Br与氢气加成:CH 2=CH 2+H 2催化剂CH 3CH 3 与氯化氢加成:CH 2=CH 2+HCl 催化剂CH 3CH 2Cl 与水加成:CH 2=CH 2+H 2O催化剂CH 3CH 2OH(3)聚合反应 乙烯加聚,生成聚乙烯:n CH 2=CH 2催化剂 [CH 2—CH 2 ] n 适当拓展:CH 3CH =CH 2+Cl 3׀ Cl CH -׀ ClCH 2 CH 3CH =CH 2+H 2催化剂CH 3CH 2CH 3 CH 3CH =CH 2+HCl 催化剂CH 3CH 2CH 2Cl 或CH 3׀ ClCHCH 3 CH 3CH =CH 2+H 2O 催化剂CH 3CH 2CH 2OH 或CH 3׀ OHCHCH 3 n CH 2=CH -CH 3催化剂 [CH 2—׀ CH 3CH ] n (聚丙烯) 3. 乙炔(炔烃通式:C n H 2n-2)乙炔的制取:CaC 2+2H 2 CH ↑+Ca(OH)2(1)氧化反应乙炔的燃烧:HC ≡CH+5O 点燃2+2H 2O乙炔可以使酸性高锰酸钾溶液褪色,发生氧化反应。

【6A文】大学有机化学反应方程式总结(较全)有机化学一、烯烃1、卤化氢加成(1)【马氏规则】在不对称烯烃加成中,氢总是加在含碳较多的碳上。
【机理】【本质】不对称烯烃的亲电加成总是生成较稳定的碳正离子中间体。
【注】碳正离子的重排(2)【特点】反马氏规则【机理】自由基机理(略)【注】过氧化物效应仅限于HBr、对HCl、HI无效。
【本质】不对称烯烃加成时生成稳定的自由基中间体。
【例】2、硼氢化—氧化【特点】不对称烯烃经硼氢化—氧化得一反马氏加成的醇,加成是顺式的,并且不重排。
【机理】【例】3、G2加成【机理】【注】通过机理可以看出,反应先形成三元环的溴鎓正离子,然后亲和试剂进攻从背面进攻,不难看出是反式加成。
不对称的烯烃,亲核试剂进攻主要取决于空间效应。
【特点】反式加成4、烯烃的氧化1)稀冷高锰酸钾氧化成邻二醇。
2)热浓酸性高锰酸钾氧化3)臭氧氧化4)过氧酸氧化5、烯烃的复分解反应【例】6、共轭二烯烃1)卤化氢加成2)狄尔斯-阿德尔(Diels-Alder)反应【描述】共轭二烯烃和烯烃在加热的条件下很容易生成环状的1,4加成产物。
【例】二、脂环烃1、环丙烷的化学反应【描述】三元环由于张力而不稳定,易发生加成反应开环,类似碳碳双键。
【特点】环烷烃都有抗氧化性,可用于区分不饱和化合物。
【注】遵循马氏规则【例】2、环烷烃制备1)武兹(Wurtz)反应【描述】通过碱金属脱去卤素,制备环烷烃。
【例】2)卡宾①卡宾的生成A、多卤代物的α消除B、由某些双键化合物的分解②卡宾与烯烃的加成反应【特点】顺式加成,构型保持【例】③类卡宾【描述】类卡宾是一类在反应中能起到卡宾作用的非卡宾类化合物,最常用的类卡宾是ICH2ZnI。
【特点】顺式加成,构型保持【例】三、炔烃1、还原成烯烃1)、顺式加成2)、反式加成2、亲电加成1)、加G2【机理】中间体【特点】反式加成2)、加HG(一摩尔的卤化氢主要为反式加成)3)、加H2O【机理】【特点】炔烃水合符合马式规则。

浙江省考研化学复习资料无机化学与有机化学重要反应机理解析一、无机化学重要反应机理解析无机化学研究的是不含碳的化合物以及它们之间的反应机制。
在考研化学中,对于无机化学的学习和理解是非常重要的。
下面将介绍一些无机化学中的重要反应机理。
1. 晶体生长机理晶体生长机理是无机化学领域中的重要研究方向之一。
晶体的生长机理一般通过溶液中成核、晶体生长和晶体聚集过程来进行解析。
在晶体的生长过程中,溶液中的离子以及其他杂质的存在往往会影响晶体的生长速率和形貌。
研究晶体生长机理对于合成高质量的晶体材料具有重要的意义。
2. 电化学反应机理电化学反应是指化学物质在电解质溶液中通过电化学反应转化为其他物质的过程。
电化学反应机理的研究涉及到电化学平衡、电化学动力学等方面的内容。
在电化学反应中,我们需要了解电极的构成、电解质的选择以及电化学实验条件对反应速率的影响等方面的知识。
3. 配合物的形成与分解机理配合物是由中心离子和配体(通常是有机物)通过配位作用形成的化合物。
在配合物的形成与分解机理中,我们需要了解配位作用的原理、配位数的确定以及配合物的稳定性等方面的内容。
配位作用的机理解析对于理解配合物的性质和应用具有重要的意义。
二、有机化学重要反应机理解析有机化学是研究碳相关化合物以及它们之间的反应机理的学科。
在考研化学中,对于有机化学的学习和理解同样是至关重要的。
下面将介绍一些有机化学中的重要反应机理。
1. 反应机理的推理与解析有机化学反应的机理推理和解析是有机化学研究的核心内容之一。
通过分析反应物、产物以及反应条件,我们可以推导出反应的机理和路径。
常用的有机反应机理有亲核取代反应机理、电子位移反应机理等,对于解析有机反应机理,我们需要掌握反应的条件和特点。
2. 共轭体系的稳定性与共轭体系的反应机理共轭体系是由具有交替单双键的有机分子构成的一种特殊的分子结构。
共轭体系具有较高的稳定性,并且在反应中表现出不同寻常的性质。
对于共轭体系的稳定性和反应机理的解析,我们需要了解共轭体系的能级结构以及共轭体系中的电子云排布等方面的内容。
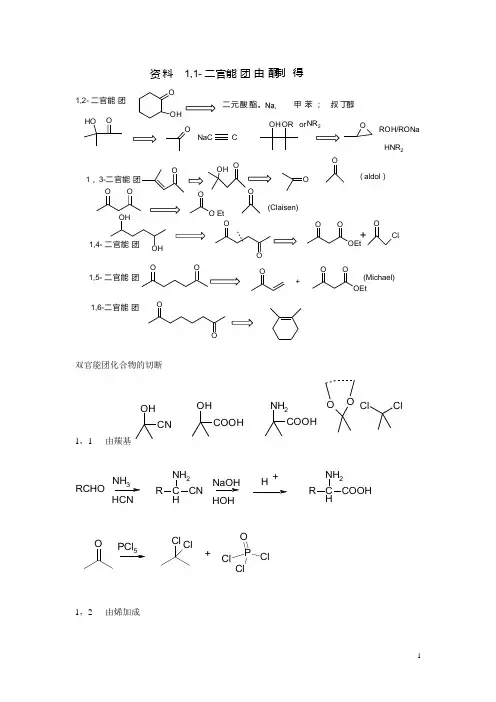
资料1,1- 二官能团由酮制得OHOOO OEtClOOOOO OOEtOOOH OOOOO O EtO OOOHONaCOH OOH OR NR 2OROH/RONa HNR 2+1,4- 二官能团1,5- 二官能团+(Michael)1,6-二官能团1,3-二官能团(aldol )(Claisen)1,2- 二官能团二元酸酯。
甲苯; 叔丁醇Cor双官能团化合物的切断1,1- 由羰基OHCNOHCOOHNH 2COOHOO ClClRCHONH 3HCNNH 2H R CNHOHH +NH 2HR COOHOPCl Cl Cl+ClP OCl Cl1,2- 由烯加成O OHCOOEtCOOEt(Na,,heat )在足够的供质子试剂(如乙醇)作用下,金属钠还原酯得伯醇(经过碳负离子自由基) 在无供质子试剂存在时(通常溶剂为乙醚,甲苯,二甲苯;最后一步用醋酸或无机酸),金属钠与酯作用得到双分子还原产物羟基酮(即酮醇),叫酮醇缩合。
也是经过碳负离子自由基。
OH OO+ Na CCOH OO+ Na CCOHHgSO 4H 2SO 4HOHOHO+OR -ROH/OH2O+HNR 2邻二醇由酮双分子还原。
1,3-, (如β-羟基酮,1,3-二酮)O由羟醛缩合,Claisen 酯缩合。
OHOOOOO OO EtO O++1,4-OHOHOOOClOCOOEt +这是乙酰乙酸乙酯制一取代丙酮XOOOHOOCOOEt +这也是乙酰乙酸乙酯制一取代丙酮XCOOEt+-这仍是乙酰乙酸乙酯制一取代丙酮COOEt Br +-O OOEtOH -H+heatOOHPBr 3Br1,5 - Michael 加成OO+-OO+O OOO+EtONa EtOHO COOEtOOH-H+heat1,6- 由环己烯的臭氧化还原水解HOOEtOMeO -OMe钠液氨叔丁醇HOOEt OMe钠液氨叔丁醇OMe1 mol H 2NiOMeO Zn HOHOMe HO OEtOH HOO2008浙江大学合成题五KMnO 4OPhMgX H 3OOHPh考点:格氏试剂制醇类AlCl3NO2 NBSNO2Br硝化,烷基苯alpha溴代SO3H SO3HBr BrBr2FeBr BrF-C烷基化,苯环上引入磺基KMnO 4COOHOF-C 酰基化,羰基还原为亚甲基。

?有机总结?有机化学一、烯烃1、卤化氢加成〔1〕XHXRCHCH2CHCH3R【马氏规那么】在不对称烯烃加成中,氢总是加在含碳较多的碳上。
【机理】快H3CX+CHCH3+ H3CCH3主XH3CCH2++H慢H3CX+H3CX+CH2次【本质】不对称烯烃的亲电加成总是生成较稳定的碳正离子中间体。
【注】碳正离子的重排〔2〕HBrRCHCH2RCH2CH2BrROOR【特点】反马氏规那么【机理】自由基机理〔略〕【注】过氧化物效应仅限于HBr、对HCl、HI无效。
【本质】不对称烯烃加成时生成稳定的自由基中间体。
【例】BrHBrH3CHCH2BrCC H3CH2CH2BrH3CHBrCH2+H +H3CCHCH3BrH3CCH CH3Br2、硼氢化—氧化1)B2H6RCHCH2RCH2CH2OH-2)H2O2/OH【特点】不对称烯烃经硼氢化—氧化得一反马氏加成的醇,加成是顺式的,并且不重排。
【机理】1H3C H3C H3CCHCH2CHCH3CHCH3HBH2HBH2BH2HH3CCHCH2CH3CH=CH2(CH3CH2CH2)3B-O OHH3CH2CH2CCH2CH2CH3-B OOHHBH2CH2CH2CH3H3CH2CH2CCH2CH2CH3BO-+HO H3CH2CH2CCHCHCH223-B OCH2CH2CH3 -HOOCH2CH2CH3O OH CH2CH2CH3HOO -BOCH2CH2CH3B(OCH2CH2CH3)3 OCH2CH2CH3B(OCH2CH2CH3)3+3NaOH3NaOH3HOCH 2CH2CH33+Na3BO3【例】1)BH3OHH-2)H2O2/OHCH3H CH33、X2加成Br2/CCl4B rCCCCBr【机理】CC BrBr Br+C CBr+CC-BrB rCCBrBr+ CC H2OB rCC+-HB rCC+H2OH O2【注】通过机理可以看出,反响先形成三元环的溴鎓正离子,然后亲和试剂进攻从反面进攻,不难看出是反式加成。

有机化学反应式
一、酯变换反应
1、酯变换反应(ester exchange reaction)是一种常见的有机化学反应,反应原理是在反应溶液中将酯的取代基交换,从而形成新的酯分子。
主要包括烷基交换反应(alkyl exchange reactions)、氧基交换反应(alkoxide exchange reactions)和醇交换反应(alcohol exchange reactions)等。
2、烷基交换反应:烷基交换反应指的是烷基取代基间的交换,即使用不同的取代基进行烷基的交换,可以获得酯的不同取代基的酯,通常所说的烷基交换反应是指反应本身的过程,即表基(烷基取代基)的交换过程,其中的溶剂可以是任意的溶剂。
烷基和甲烷取代基的交换可以使用甲醛溶液,也可以使用其它的溶剂,只要活性基间的交叉反应可以有效地实现就可以。
3、氧基交换反应:氧基交换反应指的是氧基取代基间的交换,也就是利用溶剂中的乙醇或者乙醛溶解分子中氢键结合的甲醇或乙醇,并用另一种氢键结合的甲醇或乙醇进行交换,从而形成新的醇基取代基。
通常都需要碱性溶液来促进反应,有时也可以使用有机酸作为溶剂,如乙酸、醋酸等。
4、醇交换反应:醇交换反应的基本原理是将原来的醇基取代基进行酯化反应,然后与具有不同取代基的醇溶液发生反应,将原有的取代基与具有不同取代基的醇溶液中的取代基进行交换,从而形成新的醇基取代基的醇。
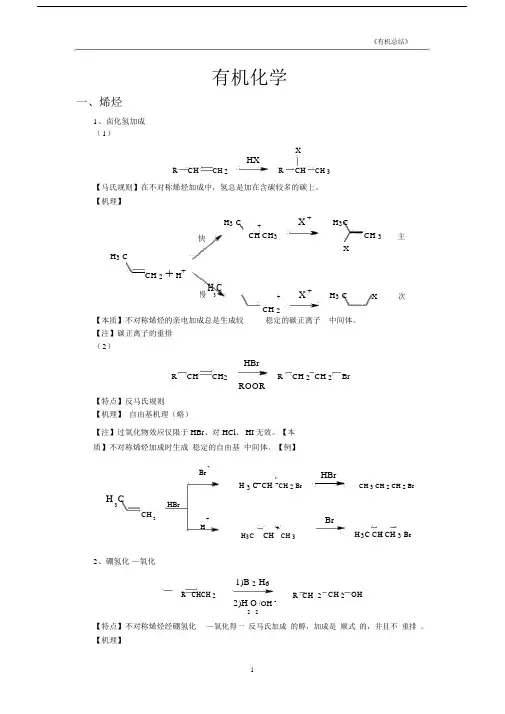
有机化学一、烯烃1、卤化氢加成 ( 1)XHXRCHCH 2R CHCH 3【马氏规则】在不对称烯烃加成中,氢总是加在含碳较多的碳上。
【机理】H 3 C+X +H 3CCH 3主快CH CH 3XH 3 CCH 2+ H +慢H 3C+X +H 3 CX次CH 2 【本质】不对称烯烃的亲电加成总是生成较稳定的碳正离子 中间体。
【注】碳正离子的重排( 2)HBrR CHCH 2 R CH 2 CH 2 BrROOR【特点】反马氏规则 【机理】 自由基机理(略)【注】过氧化物效应仅限于 HBr 、对 HCl 、 HI 无效。
【本质】不对称烯烃加成时生成 稳定的自由基 中间体。
【例】BrH 3 C CH CH 2 BrH 3CHBrCH2+H+H 3CCH CH 3HBrCH 3 CH 2 CH 2 BrBrH 3C CH CH 3 Br2、硼氢化 —氧化1)B 2 H 6R CHCH 2R CH 2 CH 2 OH2)H O /OH -2 2【特点】不对称烯烃经硼氢化 —氧化得一 反马氏加成 的醇,加成是 顺式 的,并且不 重排 。
【机理】H 3CH 3CH 3CCHCH 2CHCH 3CHCH 3HBH 2HBH 2HBH 2H 3CCH 3CH=CH 2-CH 2CH 2CH 3O OH-CH CH 2(CH 3 CH 2 CH 2 )3BH 3 CH 2CH 2C BO OHHBH 2CH 2CH 2CH 3CH 2CH 2CH 3CH 2 CH 2 CH 3+-H 3 CH 2 CH 2 C BOHOH 3CH 2CH 2 C -OCH 2CH 2CH 3B-CH CH CH3OOHHO O22CH 2CH 2CH 3HOO -B(OCH 2CH 2CH 3)3BOCH 2 CH 2CH 3OCH 2CH 2CH 3B(OCH 2 CH 2 CH 3 )3+3NaOH 3NaOH3HOCH 2CH2CH33+Na 3BO3【例】1)BH 3OH H2)H 2O 2/OH -CH3HCH33、 X 2 加成BrBr 2 /CCl 4CCCC Br【机理】Br BrBrBr -Br+C +C BrCCC CC CBrBr H 2OBr +BrC+C C-HCC C+2【注】通过机理可以看出,反应先形成三元环的溴鎓正离子,然后亲和试剂进攻从背面进攻,不难看出是反式加成。

1.某化合物分子式为C 6H 12O ,不能起银镜反应,但能与羟胺作用生成肟,在铂催化下加氢可生成一种醇,该醇经去水,臭氧分解后,得到两种液体,其中之一能起碘仿反应但不能与菲林试剂反应,另一种则能起银镜反应,但不起碘仿反应。
试写出该化合物结构式。
(CH 3)2CHCOCH 2CH 32.分子式为C 8H 14O 的化合物A ,与NH 2OH 作用、并可以很快使溴褪色。
A 被热KMnO 4氧化后可生成丙酮及另一化合物B 。
B 具有酸性,和NaOCl 反应可生成氯仿及丁二酸,试写出A 、B 的结构式。
A : (CH 3)2C=CCH 2CH 2CHOB : CH 3COCH 2CH 2COOH3.某醇经氧化脱氢生成一种酮。
该酮分子式为C 5H 10O ,经氧化后可生成乙酸和丙酸。
试推导该醇的结构。
CH 3CH 2CH(OH) CH 2CH 34.某化合物A 的分子式为C 5H 12O 、经K 2Cr 2O 7、H 2SO 4氧化后生成分子式C 5H 10O 的化合物B 。
B 不能起碘仿反应,亦不起银镜反应,B 与金属镁作用生成C 10H 22O 2化合物C ,C 能与高碘酸作用又可生成B 。
C 与浓H 2SO 4作用生成C 10H 20O 化合物D 。
D 能与氨基脲(NH 2NHCONH 2)作用生成结晶,D 不能起银镜反应。
试写出A 、B 、C 、D 结构及相关反应式。
CH 3CH 2CH(OH) CH 2CH 3 CH 3CH 2COCH 2CH 3 (CH 3CH 2)3CCOCH 2CH 35.分子式为C 12H 18N 2的苯腙用盐酸处理后生成的羰基化合物,不与多伦试剂、亚硫酸氢钠作用。
试写出该苯腙的可能结构。
6.分子式为C 8H 16化合物A ,经臭氧分解后生成B 、C 两种化合物。
B 能起银镜反应,但不起碘仿反应。
C 能与苯肼作用,但不与NaHSO 3作用。
试推导A 、B 、C 的结构。

光照光照 光照 光照 高温 CaO △ 催化剂加热、加压催化剂 △ 催化剂有机化学方程式汇总1. CH 4 + Cl 2 CH 3Cl + HCl2. CH 3Cl + Cl 2 CH 2Cl 2 + HCl3. CH 2Cl + Cl 2 CHCl 3 + HCl4. CHCl 3 + Cl 2 CCl 4+ HCl5. CH 4 C +2H 26. C 16H 34 C 8H 18 + C 8H 167. CH 3COONa + NaOH CH 4↑+ Na 2CO 38. CH 2 = CH 2 + Br 2 CH 2Br —CH 2Br 9. CH 2 = CH 22OH10. CH 2 = CH 23—CH 2Br 11. CH 2 = CH 2CH 312. nCH 2 = CH 2 ] n13. nCH 22-CH=CH-CH 2] n 14. 2CH 23CHO 15. CH ≡CH + Br 2 CHBr = CHBr 16. CHBr = CHBr+ Br 2 CHBr 2-CHBr 2 17. CH ≡CH + HCl H 2C = CHCl 18. nCH 2 = CH [ CH 2-CH ] n Cl Cl 19. CH ≡CH + H 2O CH 3CHO20. CaC 2 + 2H 2O CH ≡CH ↑+ Ca(OH)2 + Br 222. + HO 2 +H 2O23. + HO 3H+H 2O催化剂△浓硫酸170℃浓硫酸140℃催化剂△24.+ 3H2-NO22O26. 3CH≡C H27. CH3CH2Br + H228. CH3CH229. CH3CH22O30. 2CH3CH2OH+2Na 2CH3CH2ONa + H2↑31. 2CH3CH2OH+O2 2CH3CHO + 2H2O32. CH3CH2OH CH2 = CH2↑+ H2O33.C2H5OH+C2H5OH C2H5OC2H5+H2O34. 2O35. 2O -+H3O+2337+3HBr38. CH339. 2CH340. CH34+2Ag↓+3NH3+H2O 41CH32O↓+2H2O42. 2CH3COOH+2Na 2CH3COONa+H2↑43.2CH3COOH+Na2CO32CH3COONa+H2O+CO2↑44. CH3COOH+NaHCO3 CH3COONa+H2O+CO2↑45. CH3COOH + NaOH CH3COONa + H2O浓硫酸△催化剂催化剂催化剂催化剂催化剂△催化剂加热、加压+ 浓硫酸△+ 2H2OO OC —CO OCH2-CH246. 2CH3COOH + Cu(OH)2 (CH3COO)2Cu + 2H2O47.CH3COOH+CH3CH2OH CH3COOCH2CH3 +H2O48. CH3COOCH2CH3+NaOH CH3COONa+CH3CH2OH49. nOHCH2CH2COO H→[ OCH2CH2C ] n +H2O50. C6H12O6 (s) + 6O2 (g)6CO2 (g) + 6H2O (l)51. C6H12O62CH3CH2OH + 2CO252. C12H22O11+H2O C6H12O6+ C6H12O6蔗糖葡萄糖果糖53. C12H22O11 + H2O2C6H12O6麦芽唐葡萄糖54. (C6H10O5)n + nH2O n C6H12O6淀粉葡萄糖55. (C6H10O5)n + nH2O n C6H12O6纤维素葡萄糖56.C17H33COO-CH2C17H35COO-CH2C17H33COO-CH +3H2 C17H35COO-CHC17H33COO-CH2C17H35COO-CH257. C17H35COO-CH2CH2-OHC17H35COO-CH +3NaOH3C17H35COONa+ CH-OHC17H35COO-CH2CH2-OH58. CH2OH COOHCH2OH COOH1.HClClCHClCH+−→−+324光HClClCHClClCH+−→−+2223光2.3.4.5.6.7.8.222Br CH CH CH CH +=-=9.10.11.12. 13. 14.15.16.17.OH NH Ag CHO CHOH HOCH 2342)(2)(+O H NH Ag COONH CHOH HOCH 2344232)(++↓+−→−∆18.19.20.21.高中有机化学知识点总结 1.需水浴加热的反应有:(1)、银镜反应(2)、乙酸乙酯的水解(3)苯的硝化(4)糖的水解 (5)、酚醛树脂的制取(6)固体溶解度的测定凡是在不高于100℃的条件下反应,均可用水浴加热,其优点:温度变化平稳,不会大起大落,有利于反应的进行。