一 铅的基本性质
- 格式:doc
- 大小:30.00 KB
- 文档页数:4

十大常见的危险化学物质,你知道多少(一)引言概述:危险化学物质在日常生活中随处可见,它们对人体健康和环境造成潜在威胁。
本文将介绍十大常见的危险化学物质,并深入探讨它们的性质、应用领域以及潜在的风险。
通过了解这些化学物质,我们可以更好地保护自己和周围的环境,确保安全与健康。
正文:1. 甲醛- 基本性质:甲醛是一种无色、刺激性气味的气体,可溶于水和其他有机溶剂。
- 应用领域:广泛用于建筑材料、纺织品、绝缘材料等制造过程中。
- 潜在风险:长期暴露于甲醛可导致呼吸系统和皮肤疾病,甚至增加癌症风险。
2. 苯- 基本性质:苯是一种无色液体,具有特殊的芳香气味,易挥发。
- 应用领域:广泛用于化学制品、塑料、橡胶等行业。
- 潜在风险:长期接触苯可导致贫血、免疫系统损伤以及白血病等严重后果。
3. 氨- 基本性质:氨是一种无色气体,有刺激性气味,极易溶于水。
- 应用领域:广泛用于化学工业、农业等领域。
- 潜在风险:高浓度的氨气可导致呼吸道刺激、肺水肿,甚至危及生命。
4. 苯酚- 基本性质:苯酚是一种白色晶体,具有酚类特有的麻醉性和杀菌性。
- 应用领域:用于制造染料、消毒剂、防腐剂等产品。
- 潜在风险:接触苯酚可引起中枢神经系统抑制,影响肝脏和肾脏功能。
5. 铅- 基本性质:铅是一种重金属,具有毒性,常见为灰色金属。
- 应用领域:广泛用于电池、冶金、涂料等产业。
- 潜在风险:长期接触铅可导致神经系统受损、血液疾病,对儿童和妊娠妇女尤为危险。
总结:以上所介绍的五种危险化学物质只是冰山一角,我们应该了解并遵守有关的安全操作规范,减少暴露风险。
选择环保产品和加强个人防护意识也是保护自身健康的关键。
在日常生活中,我们要时刻保持警惕,与危险化学物质保持距离,做到安全使用和妥善处理。

世上无难事,只要肯攀登
铅的性质和用途
铅是蓝灰色的金属,新的断口具有灿烂的金属光泽。
固态密度为11.35 克/厘米3,熔点为327.4 ℃,沸点为1525℃,纯铅在金属中是最柔软的,莫氏硬度为1.5。
铅具有很好的展性,但其延性甚小,不耐拉力。
铅的导热度很低,
相当于银的7.5%,导电度也很差,仅及银的7.77%。
铅具有高度的化学稳定性,常温时在干燥空气中不起化学变化。
铅易溶于稀硝酸,室温下铅不溶于硫酸和盐酸。
常温时盐酸和硫酸的作用仅及铅的表面,因为生成的PbCl2 及PbSO4 几乎是不溶解的,附着在铅的表面上,使内部的金属不受腐蚀。
铅与含碱、氨、氯的溶液和有机酸、酯均不起反应。
由于铅具有抗酸、碱腐蚀的性质,因此用途较广,如可以利用他来制造化工设备的各种构件,冶金工厂的电解槽,通讯电缆铠装材料,以及做蓄电池等;还可做成巴比特合金—铅基合金
轴承,由于铅能吸收放射性射线,故用于X—光工业及原子能工业;铅的化合
物用在颜料、陶瓷、玻璃、橡胶、石油精炼等工业部门;还可用于焊料、印刷合金等。
铅最大的用途是生产铅蓄电池,约占60%以上,铅又称为蓄电池金属,铅的其他用途是制造各种合金、电缆套、塑料添加剂、颜料和汽油添加剂等。
下表为铅消费的比例。
铅消费的比例
用途
西方国家
中国
蓄电池
75
60。

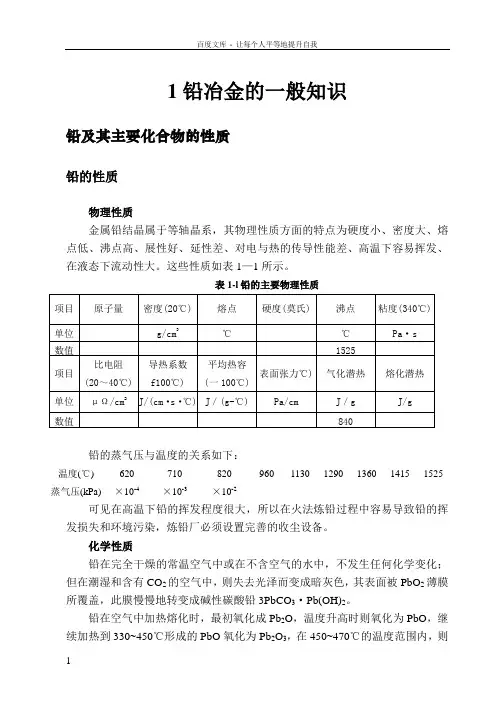
1铅冶金的一般知识铅及其主要化合物的性质铅的性质物理性质金属铅结晶属于等轴晶系,其物理性质方面的特点为硬度小、密度大、熔点低、沸点高、展性好、延性差、对电与热的传导性能差、高温下容易挥发、在液态下流动性大。
这些性质如表1—1所示。
表1-l铅的主要物理性质铅的蒸气压与温度的关系如下:温度(℃) 620 710 820 960 1130 1290 1360 1415 1525 蒸气压(kPa) ×10-4 ×10-3 ×10-2可见在高温下铅的挥发程度很大,所以在火法炼铅过程中容易导致铅的挥发损失和环境污染,炼铅厂必须设置完善的收尘设备。
化学性质铅在完全干燥的常温空气中或在不含空气的水中,不发生任何化学变化;但在潮湿和含有CO2的空气中,则失去光泽而变成暗灰色,其表面被PbO2薄膜所覆盖,此膜慢慢地转变成碱性碳酸铅3PbCO3·Pb(OH)2。
铅在空气中加热熔化时,最初氧化成Pb2O,温度升高时则氧化为PbO,继续加热到330~450℃形成的PbO氧化为Pb2O3,在450~470℃的温度范围内,则形成Pb3O4。
(即2PbO·PbO2,俗称铅丹)。
无论是Pb2O3,或Pb3O4在高温下都会离解生成PbO,因此PbO是高温下惟一稳定的氧化物。
CO2对铅的作用不大;浸没在水中(无空气)的铅很少腐蚀。
铅易溶于硝酸(HNO3)、硼氟酸(HBF4)、硅氟酸(H2SiF6)、醋酸(CH3COOH)及AgNO3等;盐酸与硫酸仅在常温下与铅的表面起作用而形成几乎是不溶解的PbCl2和PbSO4的表面膜。
可见,以工业上常用的“三酸”作为溶剂,都不太适宜用于湿法炼铅和粗金属铅的水溶液电解精炼,因为尽管硫酸、盐酸价廉易得,但生成的PbSO4、PbCl2在水溶液中溶解度小;而与硝酸形成的Pb(NO3)2在水溶液中不太稳定,容易生成挥发性的氧化氮。
这就是湿法炼铅工业化规模生产的困难所在,也是粗铅电解精炼不得不采用较昂贵的H2SiF6作电解质的缘故。

水体中重金属污染物——铅铅及其化合物的基本性质铅在地球上属分散元素,它的元素丰度在地壳中占第35位(13mg/kg),在海洋中居第46位(0.03μg/L)。
铅是淡黄带灰的柔软金属,切削面有金属光泽,但在空气中很快生成黯灰色氧化膜。
铅是除金和汞之外常见金属中最重的金属,它容易机械加工、熔点低、密度高、又能抗腐蚀,这些优良性质使它获得了广泛的应用。
铅在活泼性顺序中位于氢之上,能缓慢溶解在非氧化性稀酸中,也易溶于稀HNO3中,加热时溶于HCl和H2SO4;有氧存在的条件下,还能溶于醋酸,所以常用醋酸浸取处理含铅矿石。
易溶于水的铅盐有硝酸铅、醋酸铅等。
但大多数铅化合物难溶于水,如硫化物、氢氧化物、磷酸盐、硫酸盐等皆为难溶铅盐,它们的溶解度数据如表5-15所示。
作为汽车排气的一种重要成分,Pb x Cl y Br z在水中有较大溶解度,而且溶解度数据是一个十分重要的环境参数,它关系到空气中含铅化合物的湿降、土壤中含铅化合物的溶解迁移等环境过程,也关系到沉积在人体肺内铅化合物的生理特性等。
Pb x Cl y Br z在水中溶解度数据如表5-16所示。
这些卤化物的溶解度数据也可根据热力学关系式进行计算求得。
表5-15 能溶铅化合物的溶解度化合物溶解度(g/100gH2O)温度(℃)溶度积(Ksp)温度(℃)PbCO3 4.8×10-618 3.3×10-1418PbCrO4 4.3×10-618 1.8×10-1418Pb(OH)2 2.8×10-1625Pb3(PO4)2 1.3×10-520 1.5×10-3218 PbS 4.9×10-1218 3.4×10-2618PbSO4 4.5×10-318 1.1×10-818表5-16 PbxCIyBrz在水中的溶解度温度(℃)化合物溶解度(g/L)溶解度(mol/L)40PbC1214.5 5.21×10-2PbBr215.3 4.17×10-2PbBrCl9.55 2.96×10-220PbC129.9 3.56×10-2PbBr28.5 2.31×10-2PbBrCl 6.64 2.06×10-20PbCl2 6.73 2.42×10-3PbBr2 4.55 1.24×10-3PbBrCl 4.38 1.36×10-3铅在周期表中位于第Ⅳ族。

铅的物理化学性质 铅是柔软和延展性强的弱⾦属,有毒,也是重⾦属。
接下来店铺为你整理了铅的物理化学性质,⼀起来看看吧。
铅的物理性质 铅为带蓝⾊的银⽩⾊重⾦属,熔点327.502°C,沸点1740°C,密度11.3437克/厘⽶3,硬度1.5,质地柔软,抗张强度⼩。
没有氧化层的铅⾊泽光亮,密度⾼,硬度⾮常低,延伸性很强。
它的导电性能相当低,抗腐蚀性能很⾼,因此它往往⽤来作为装腐蚀⼒强的物质(⽐如硫酸)的容器。
加⼊少量锑或其它⾦属可以更加提⾼它的抗腐蚀⼒。
⾦属铅在空⽓中受到氧、⽔和⼆氧化碳作⽤,其表⾯会很快氧化⽣成保护薄膜; 在加热下,铅能很快与氧、硫、卤素化合; 铅与冷盐酸、冷硫酸⼏乎不起作⽤,能与热或浓盐酸、硫酸反应;铅与稀硝酸反应,但与浓硝酸不反应;铅能缓慢溶于强碱性溶液。
铅的化学性质 【元素名称】铅(lead) 【CAS号】7439-92-1 【元素符号】Pb 【原⼦序数】82 【周期序数】6 【族-序数】IVA 【晶体结构】晶胞为⾯⼼⽴⽅晶胞。
【相对原⼦质量】207.2 【元素类型】⾦属元素 【物理性质】带蓝⾊的银⽩⾊重⾦属,熔点327.502°C,沸点1740°C,密度11.3437克/⽴⽅厘⽶,⽐热容0.13 kJ/(kg·K),硬度1.5,质地柔软,抗张强度⼩。
【原⼦体积】18.17⽴⽅厘⽶/摩尔 【元素在太阳中的含量】0.01ppm 【元素在海⽔中的含量】太平洋表⾯ 0.00001ppm 【氧化态】Main Pb+2, Pb+4 【晶胞参数】 a = 495.08 pm b = 495.08 pm c = 495.08 pm α = 90° β = 90° γ = 90° 【莫⽒硬度】1.5 【声⾳在其中的传播速率】1190m/S 【电离能(kJ /mol) 】 M - M+ 715.5 M+ - M2+ 1450.4 M2+ - M3+ 3081.5 M3+ - M4+ 4083 M4+ - M5+ 6640 M5+ - M6+ 8100 M6+ - M7+ 9100 M7+ - M8+ 11800 M8+ - M9+ 13700 M9+ - M10+ 16700 铅的健康危害 ⼉童中毒 ⼉童发⽣铅中毒的概率是成年⼈的30多倍!其原因与⼉童正处在⽣长发育阶段,许多器官尚不成熟,解毒功能不完善,对铅较敏感,以及接触机会较多有关。

水体中重金属污染物——铅铅及其化合物的基本性质铅在地球上属分散元素,它的元素丰度在地壳中占第35位(13mg/kg),在海洋中居第46位(0.03μg/L)。
铅是淡黄带灰的柔软金属,切削面有金属光泽,但在空气中很快生成黯灰色氧化膜。
铅是除金和汞之外常见金属中最重的金属,它容易机械加工、熔点低、密度高、又能抗腐蚀,这些优良性质使它获得了广泛的应用。
铅在活泼性顺序中位于氢之上,能缓慢溶解在非氧化性稀酸中,也易溶于稀HNO3中,加热时溶于HCl和H2SO4;有氧存在的条件下,还能溶于醋酸,所以常用醋酸浸取处理含铅矿石。
易溶于水的铅盐有硝酸铅、醋酸铅等。
但大多数铅化合物难溶于水,如硫化物、氢氧化物、磷酸盐、硫酸盐等皆为难溶铅盐,它们的溶解度数据如表5-15所示。
作为汽车排气的一种重要成分,Pb x Cl y Br z在水中有较大溶解度,而且溶解度数据是一个十分重要的环境参数,它关系到空气中含铅化合物的湿降、土壤中含铅化合物的溶解迁移等环境过程,也关系到沉积在人体肺内铅化合物的生理特性等。
Pb x Cl y Br z在水中溶解度数据如表5-16所示。
这些卤化物的溶解度数据也可根据热力学关系式进行计算求得。
表5-15 能溶铅化合物的溶解度化合物溶解度(g/100gH2O)温度(℃)溶度积(Ksp)温度(℃)PbCO3 4.8×10-618 3.3×10-1418PbCrO4 4.3×10-618 1.8×10-1418Pb(OH)2 2.8×10-1625Pb3(PO4)2 1.3×10-520 1.5×10-3218 PbS 4.9×10-1218 3.4×10-2618PbSO4 4.5×10-318 1.1×10-818表5-16 PbxCIyBrz在水中的溶解度温度(℃)化合物溶解度(g/L)溶解度(mol/L)40PbC1214.5 5.21×10-2PbBr215.3 4.17×10-2PbBrCl9.55 2.96×10-220PbC129.9 3.56×10-2PbBr28.5 2.31×10-2PbBrCl 6.64 2.06×10-20PbCl2 6.73 2.42×10-3PbBr2 4.55 1.24×10-3PbBrCl 4.38 1.36×10-3铅在周期表中位于第Ⅳ族。


铅的基础知识1.1 铅的生产发展概述铅(Pb)在公元前7000—前5000年被人们发现, 其原因是由于氧化铅矿石易被还原成金属铅, 灼烧也容易使铅析出, 故铅是有史以来人类使用最早的六种金属之一。
由于铅的性质柔软, 强度不大, 在当时既不适合于制造生产工具, 又不适合于制造防御和进攻性武器, 并且铅在潮湿空气中表面极容易氧化而失去金属光泽, 故它也不适合制作各种装饰品, 所以铅在世界各民族的文化发展史上, 没有起到像铜、铁那样大的作用。
直到16世纪, 铅的生产才开始具有工业规模。
古时候, 铅的生产是以木柴为燃料的, 炉底用灰筑成的灰窑或是有倾斜炉底的闭式窑, 以后才逐渐发展成烧煤的反射炉和膛式炉。
到19世纪中叶以后, 人们发现了铅的抗酸、抗碱、防潮、密度大以及能够吸收放射性射线等性能, 并且还很容易与其他金属组成合金、制造蓄电池等新性质和新用途, 从此炼铅工业才获得重大的发展。
在我国, 铅的生产虽然也有2000余年的历史, 但过去一直没有什么发展。
新中国成立以前, 当时除极少数几处极端落后的手工开采和土法炼铅外, 根本没有工业化的炼铅工厂。
新中国成立以后, 我国的铅冶炼工业得到了发展。
特别是在改革开放以后, 新技术的开发、利用, 壮大了铅冶炼工业规模, 使我国铅冶炼工业走向一个全新的时代。
我国在建国初期大多数铅冶炼厂均采用传统的烧结-鼓风炉还原冶炼工艺从硫化铅精矿中生产粗铅, 如株洲冶炼厂、沈阳冶炼厂。
该工艺虽然具有产能大、渣含铅低、铅直收率高、烟尘率低等优点, 但由于在硫化铅精矿的烧结过程中产生大量的低浓度SO2烟气(SO2含量仅为0.8%~2%), 需要采用返烟鼓风烧结工艺、非稳态制酸等措施治理SO2环境污染, 且整个冶炼过程还存在能源消耗高、操作条件差、资源综合利用程度低等问题, 故该炼铅工艺被国家列为限期淘汰的生产工艺。
因此, 采用节能、环保的炼铅新工艺对我国炼铅企业进行技术改造成为当务之急。

铅及其化合物性质铅单质一、物理性质铅为暗灰色,重而软的金属,熔点600.7K,沸点2013K,密度11.35g·cm-3。
铅的层性相当好,可轧成极薄的铅箔。
铅有极高的锻接性能,但其延展性并不好。
二、化学性质铅是两性金属,其主要氧化态为+2和+4。
(1)与氧,水和二氧化碳的反应室温下,铅能与氧,水和二氧化碳的作用,在表面生成一层致密的碱式碳酸铅的保护膜而失去金属光泽。
4Pb +2O2+2CO2+2H2O2PbCO3·Pb(OH)2↓在有氧气存在的条件下,铅能与水缓慢反应生成Pb(OH)2。
2Pb +O2+2H2O2Pb(OH)2(2)与非金属的反应在加热下,铅能与氧,卤素,硫等非金属直接反应:Pb +X2PbX2(X=F,Cl,Br,I)2Pb +O22PbOPb +S PbS(3)与酸的反应铅可溶于热的浓盐酸或浓硫酸中,与稀HNO3反应,得到Pb(NO3)2。
由于Pb(NO3)2不溶于浓HNO3,Pb不与浓HNO3反应。
Pb +2HCl PbCl2↓+H2↑(反应很快终止)Pb +4HCl(浓)H2[PbCl4] +H2↑Pb +H2SO4(稀)PbSO4↓+H2↑(反应很快终止)Pb +3H2SO4(浓)Pb(HSO4)2+2SO2↑+2H2O3Pb +8HNO3(稀)3Pb(NO3)2+2NO↑+4H2O铅在有氧存在的条件下可溶于醋酸,生成易溶的醋酸铅。
这也就是用醋酸从含铅矿石中浸取铅的原理。
2Pb +O22PbOPbO +2CH3COOH Pb(CH3COO)2+H2O(4)与碱的反应铅能与强碱缓慢地反应得到亚铅酸盐,同时放出H2。
Pb +2NaOH Na2PbO2+H2↑或写成:Pb +NaOH +2H2O Na[Pb(OH)3] +H2↑铅除了有PbO和PbO2以外,还有常见的“混合氧化物”Pb3O4。
铅的氧化物一:一氧化铅一氧化铅PbO俗称“密陀僧”。
它是用空气氧化熔融的铅而制得的。

铅是最软的重金属,也是比重较大的金属之一,展性良好,易与其他金属形成合金。
铅最大的特性是能吸收效射线,如X射线和γ射线等。
常见的化合价+2、+4。
(一)铅的主要物理性质密度(20℃) 11.68 g/cm3熔点 327.4 ℃沸点 1750 ℃平均比热(0℃~100℃) 129.8 J/(kg·K)熔化热 4.98 kJ/mol汽化热 178.8 kJ/mol热导率(0℃~100℃) 34.9 W/(m·K)电阻率(20 ℃) 20.6 μΩ·cm(二)铅的主要化学性质在空气中铅表面会生成碱式碳酸铅,这些化合物阻止了铅的进一步氧化。
铅是两性金属,可形成各种铅酸盐。
铅能与H2SO4和HCl作用在表面形成几乎不溶的PbS04和低温下不溶的PbCl2,防止铅继续被腐蚀。
二价铅的标准电极电位为-0.128,电化当量为3.8657克/(安培·小时)。
铅的“资格”够老的了,人们早在几千年前便已认识铅了。
我国在殷代末年纣王时便已会炼铅。
古代的罗马人喜欢用铅作水管,而古代的荷兰人,则爱用它作屋顶。
铅是银白色的金属(与锡比较,铅略带一点浅蓝色),十分柔软,用指甲便能在它的表面划出痕迹。
用铅在纸上一划,会留下一条黑道道。
在古代,人们曾用铅作笔。
“铅笔”这名字,便是从这儿来的。
铅很重,一立方米的铅重达11.3吨,古代欧洲的炼金家们便用旋转迟缓的土星来表示它,写作“h”。
铅球那么沉,便是用铅做的。
子弹的弹头也常灌有铅,因为如果太轻,在前进时受风力影响会改变方向。
铅的熔点也很低,为327℃,放在煤球炉里,也会熔化成铅水。
铅很容易生锈——氧化。
铅经常是呈灰色的,就是由于它在空气中,很易被空气中的氧气氧化成灰黑色的氧化铅,使它的银白色的光泽渐渐变得暗淡无光。
不过,这层氧化铅形成一层致密的薄膜,防止内部的铅进一步被氧化。
也正因为这样,再加上铅的化学性质又比较稳定,因此铅不易被腐蚀。
在化工厂里,常用铅来制造管道和反应罐。
分析提高白酒中铅检测准确性的方法作者:苏芳来源:《食品安全导刊·下旬刊》2020年第04期摘要:在食品安全视域下,白酒中铅的检测方法及结果是白酒质量试金石,从检测实际需求出发,合理运用高准确性及稳定性检测方法完成检测任务,有利于提高白酒检测效率,并且检测结果具有参考价值。
该文首先介绍白酒铅含量检测的必要性,然后重点分析铅检测实验及结果结论,旨在为同行提供借鉴,全面保障白酒安全。
关键词:白酒;铅;检测方法近年来,白酒质量问题备受关注,影响白酒质量的因素较多,其中金属铅是重要影响因素。
要想准确获知白酒中铅含量,探究可行的、准确的检测方法是极为必要的,这对提高白酒安全水平、保障食用者健康权益有重要意义。
可见,该论题具有探究必要性和迫切性,具体论述如下。
1 检测白酒中铅含量的必要性1.1 铅的基本性质铅在金属类产品中具有双重属性,即弱金属和重金属。
铅含量过高,会一定程度上威胁人体健康,一般来说,食品中铅含量超过0.04 g会产生中毒风险,铅含量达到0.02 kg时存在生命危险。
铅金属短时间内不会从体内排出,如果食用者日常摄取8~9 mg铅,易出现头晕、疲倦、贫血、心态消极等现象[1]。
1.2 铅来源及检测要求食品铅污染现象较常见,并且铅对人体的危害较大,对此要掌握铅来源,并运用高效检测法,尽最大可能降低食品中的铅。
白酒中铅主要来自蒸馏水、原料、醋酸、冷凝导管、蒸馏器、锡制器与贮存器等,对于长期饮酒者来说,一旦饮用铅含量超标的白酒,随着时间的延长会慢性中毒,严重情况下威胁饮酒者生命安全。
检测白酒中铅含量时,依据国家《GB/T5009.12-2010食品中铅的测定》《GB 2762-2012重金属污染物标准》进行含量检测,经实验验证确定检测方法合理性和有效性,为铅含量控制工作提供依据,大大提高白酒安全性[2]。
2 白酒中铅检测实验及结果结论2.1 检测实验充分准备实验试剂及仪器,试剂包括铅标准溶液(1 000μg/mL)、硝酸(北京市刘店化学试剂有限公司)、高氯酸(浙江省工艺品进出口有限公司)、磷酸二氢铵(广州市鑫镁化工有限公司),均为优级纯。
铅 基础知识(元素符号: Pb )一、铅 基本性质:带蓝色的银白色重金属,它 有毒性,是一种 有延伸性 的主族金属。
熔点327.502°C ,沸点1740°C ,密度11.3437克/立方厘米,硬度1.5,质地柔软,抗张强度小。
空气中表面 易氧化而失去光泽,变灰暗。
溶于硝酸,热硫酸、有机酸和碱液。
不溶于稀酸和硫酸。
具有两性:既能形成高铅酸的金属盐,又能形成酸的铅盐。
二、铅 矿物来源铅锌伴生矿。
目前,在地壳上已发现的铅锌矿物约有250多种,大约1/3是硫化物和硫酸盐类。
方铅矿、闪锌矿等是冶炼铅锌的主要工业矿物原料。
氧化铅 黄色或略带红色的黄色粉末或细小片状结晶,遇光易变色;沸点 1535℃;熔点888℃,不溶于水,不溶于乙醇,溶于硝酸、乙酸、热碱液;相对密度(水=1)9.53。
空气中能逐渐吸收二氧化碳。
加热到300~500℃时变为四氧化三铅,温度再高时变为一氧化铅。
有毒!主要用途:用作颜料铅白、制造铅皂、冶金助溶剂、油漆催干剂、陶瓷原料、橡胶硫化促进剂、杀虫剂,铅盐塑料稳定剂原料,铅玻璃工业原料,铅盐类工业的中间原料。
少量用作中药和用于蓄电池工业,并用于制造防辐射橡胶制品。
还原法制 铅Pb : PbO+C == Pb+CO ↑ PbO+CO == Pb+CO2三、铅 用途:铅主要用于制造 铅蓄电池; 铅合金可用于 铸铅字,做 焊锡; 铅还用来制造 放射性辐射、X 射线的防护设备;铅被用作 建筑材料、乙酸铅电池中、枪弹、炮弹、奖杯、铅合金 。
四、铅 生产工艺铅冶金是白银生产的最佳载体:一般铅对金银的捕集回收率都在95%以上,因此金银的回收是与铅的生产状况直接相关的。
现在世界上约有80%的原生粗铅是采用传统的 烧结一鼓风炉熔炼工艺 方法生产的。
传统法技术成熟,较完善可靠,其不足之处在于脱硫造块的烧结过程中,烧结烟气的SO2浓度较低,硫的回收利用尚有一定难度,鼓风炉熔炼需要较昂贵的冶金焦炭。
一铅的基本性质
铅是一种化学元素,它的原子序数为82,化学符号为Pb。
铅是一种柔软、有弹性的金属,具有良好的耐腐蚀性。
铅通常呈蓝灰色,是一种相对密度较大的金属,其密度为11.34克/立方厘米。
铅是一种较稳定的元素,不会轻易发生化学反应,因此在自然界中很少存在游离的铅。
铅化合物广泛存在于自然界中,如铅矿石等。
铅的物理性质
铅的熔点为327.5℃,沸点为1750℃,相对密度为11.34。
铅具有良好的延展性和可塑性,能够被轻易地拉伸成细丝或被压成薄片,因此容易加工成各种形状。
铅导电性能不佳,热导率也较低,但铅的阻尼性能高,因此在一些工业应用中,铅制品被用作隔音材料。
铅的化学性质
铅属于IV A族元素,具有两个氧化态:+2和+4。
与空气接触时,铅会被氧化而变成氧化铅,其中氧化铅可以防止铅表面的进一步氧化。
铅也可以与酸和碱反应,产生相应的盐。
在正常的温度和压力下,铅通常不会与水反应,因此可以用于容器和水管的制造。
铅的生物毒性
铅对人类和动物的生物毒性很高,可以影响多个器官和系统,包括神经系统、血液系统、肝脏、肾脏等。
长期接触铅可以引起贫血、肾损害、神经系统损害等多种健康问题。
儿童和孕妇对铅的影响更为严重,可能导致智力退化、身体畸形等生长发
育问题。
因此,许多国家都采取了严格的措施来限制铅的使用和排放。
总之,铅是一种重要的金属,在工业和民生中有着广泛的应用。
然而,铅的生物毒性很高,对人类和环境的影响也非常严重,因此应当严格控制铅的使用和排放,保护人类和环境的健康。
世上无难事,只要肯攀登
铅、锌的性质和用途、类型
铅是兰灰色金属,硬度1.5,比重11.34,熔点327℃,沸点1525℃;能与锌、锡、锑、砷等金属组成合金。
铅的展性良好,延性甚微;在干燥空气中,铅不发生化学变化;在潮湿空气中,易形成氧化铅薄膜覆盖其表面;常温下,铅几乎不溶于稀盐酸和硫酸,但熔于硝酸,铅对碱、氨、氰酸及有机盐具有较好的防腐蚀能力。
锌是兰白色金属,硬度2.0,熔点419℃,沸点906℃,加热至100~150℃时,具有良好压延性,压延后比重为7.19,锌能与铅、锡、锑、镍、铜等金属组成合金。
在常温下的干燥空气中,锌不起变化;在潮湿空气中,其表面生成致密的碱性碳酸锌薄膜,可保护锌金属内部和镀锌金属表面不再氧化受腐蚀。
由于铅、锌具有上述特性,被广泛用于电气工业、机械工业、军事工业、冶
金工业、化学工业以及轻工业和医药工业部门,铅金属还在核工业和石油工业等部门,有所应用。
(二)铅、锌矿物及铅、锌矿石类型
1、主要的铅、锌矿物
我国目前常见的铅、锌矿物共18 种,它们均不同程度地为工业所利用,其
中尤以方铅矿、闪锌矿为最重要(表28)。
表28 主要铅、锌矿物结合矿石加工技术特征,划分矿石工业类型。
根据以往勘探和生产经验,铅锌矿石的工业类型有:
(1)按矿石氧化程度不同,可分为:
硫化矿石:铅或锌氧化率小于10%;
混合矿石:铅或锌氧化率10~30%;
氧化矿石:铅或锌氧化率>30%。
铅的化合价1. 引言在化学中,化合价是描述元素与其他元素结合时的电荷状态的数值。
铅是一种常见的金属元素,其化学符号为Pb,原子序数为82。
铅具有多种化合价,取决于与其他元素形成的化合物。
本文将详细介绍铅的不同化合价及其相关性质。
2. 铅的基本性质铅是一种重金属,在自然界中广泛存在。
它具有较高的密度、柔软性和延展性,是一种良好的导电材料。
由于其稳定性和廉价性质,铅广泛应用于建筑、电池、管道等领域。
3. 铅的常见化合价3.1 +2氧化态在+2氧化态下,铅形成了一系列稳定的离子和化合物。
最常见的+2氧化态是Pb2+离子,它具有两个正电荷,并且在水中稳定存在。
Pb2+离子可以与阴离子形成各种盐类,如PbCl_2(氯化铅)和PbSO_4(硫酸铅)。
3.2 +4氧化态在+4氧化态下,铅形成了一些较不稳定的化合物。
最常见的+4氧化态是Pb4+离子,它具有四个正电荷。
然而,Pb4+离子很容易被还原为Pb^2+离子,因此在实际应用中较少见。
3.3 其他氧化态除了+2和+4氧化态,铅还可以形成一些其他的氧化态。
例如,铅可以形成+1、+3和+5氧化态的离子和化合物。
然而,这些氧化态较为不稳定,在常规条件下很难存在。
4. 铅的主要化合物及其应用4.1 氯化铅(PbCl_2)氯化铅是一种白色结晶固体,在水中微溶。
它可以通过将Pb2+离子与Cl-离子反应制备而成。
氯化铅广泛应用于制备其他铅盐类、颜料和陶瓷材料等领域。
4.2 硫酸铅(PbSO_4)硫酸铅是一种白色沉淀物,在水中微溶。
它可以通过将Pb2+离子与SO_42-离子反应制备而成。
硫酸铅常用于电池的正极材料和颜料的制备。
4.3 氧化铅(PbO)氧化铅是一种红色或橙黄色固体,广泛应用于玻璃、陶瓷和焊接材料等领域。
氧化铅可以通过将Pb2+离子与O2-离子反应制备而成。
4.4 乙酸铅(Pb(C_2H_3O_2)_2)乙酸铅是一种无色结晶固体,在水中溶解度较高。
它常用于防腐剂、染料和催化剂的制备。
重金属铅的污染与防治
64090225 张建伟
铅是一种常见的毒物,其神经毒性早在1个世纪以前就已证实。
随着现代化工业、交通业的发展和铅在各领域的广泛使用,环境铅污染日趋严重,对人体造成很大的危害。
本文就铅污染及其防治做一个简单的介绍。
一铅的基本性质
1 铅为带蓝色的银白色重金属,熔点327.502°C,沸点1740°C,质地柔软,抗张强度小。
2 金属铅在空气中受到氧、水和二氧化碳作用,其表面会很快氧化生成保护薄膜;
3 在加热下,铅能很快与氧、硫、卤素化合;
4 铅与冷盐酸、冷硫酸几乎不起作用,能与热或浓盐酸、硫酸反应;
5 铅与稀硝酸反应,但与浓硝酸不反应;铅能缓慢溶于强碱性溶液。
6 铅主要用于制造铅蓄电池;铅合金可用于铸铅字,做焊锡;铅还用来制造放射性辐射、X射线的防护设备;铅及其化合物对人体有较大毒性,并可在人体内积累。
7 没有氧化层的铅色泽光亮,密度高,硬度非常低,延伸性很强。
它的导电性能相当低,抗腐蚀性能很高,因此它往往用来作为装腐蚀力强的物质(比如硫酸)的容器。
二铅在介质中的存在形式
1 水中的铅
天然水中铅主要以Pb2+状态存在,其含量和形态明显地受CO32-、SO42-、OH-和Cl-等含量的影响,铅可以Pb(OH)2、Pb(OH)3-、PbCl2等多种形态存在。
(1)吸附腐殖质对铅离子的吸附;粘土矿物质对铅离子的吸附等。
(2)溶解沉淀铅离子与相应的阴离子生成难溶化合物,大大限制了铅在水体中的扩散范围,使铅主要富集于排污口附近的底泥中,降低了铅离子在水中的迁移能力。
2 空气中的铅
来源其一是铅作业行业排出的大量含铅废气,如印刷业、机械制造业、金属冶炼业,蓄电池制造业等。
其二汽车尾气会排出大量的含铅废气,主要来自汽油中防爆剂四乙基铅。
其三家庭墙壁装饰所用的含铅涂料和油漆,可造成居室内铅污染
3 土壤中的铅
(1)来源自然原因:风化岩石中的矿物,例如方铅矿、闪锌矿。
人为原因:大气降尘、污泥、城市垃圾的土地利用、采矿和金属加工业。
(2)土壤中铅对生物的影响:
低浓度的铅对某种植物的生长起促进作用,而高浓度的铅除了在作物的食用部位积累残毒外,还表现为幼苗萎缩、生产缓慢,产量下降甚至绝收。
通过植物
的吸收、挥发、根际过滤、降解、稳定等作用,可以净化土壤中的污染物,达到净化环境的目的。
三铅污染及其主要来源
1 铅污染
铅在加热到400-500℃时会有铅蒸汽逸出形成铅烟,在用铅锭制造铅粉和极板的过程中都会有铅尘散发,污染空气,当空气中铅烟尘达到一定浓度形成铅污染。
水用含有的铅被人体吸收后也造成一定危害。
铅污染对人体造成的危害主要是致癌和致突变。
2 主要来源
(1)工业生产来源:工业生产过程例如采矿、冶炼和制造业等能够污染临近这些生产场所的土壤,这是因为金属矿山的开采、冶炼、重金属尾矿、冶炼废渣和矿渣堆放等,可以被酸溶出重金属离子的矿山酸性废水,随着矿山排水和降雨使之带入水环境(如河流等)或直接进入土壤,都可以间接或直接地造成土壤重金属污染。
而且在这些场所即使停止生产很久以后也还存在严重的污染问题。
(2)农业活动来源:农药、化肥和地膜是重要的农用物资,对农业生产的发展起着重大的推动作用,但长期不合理施用,也可以导致土壤铅等重金属污染。
绝大多数的农药味有机化合物,在其中个别农药的其组成中含有铅等重金属。
重金属元素是肥料中报道最多的污染物质。
氮、钾肥料中重金属含量较低,但是氮肥中铅含量较高。
磷肥中含有较多的有害重金属,施用含有铅等重金属的农药和不合理地施用化肥,都可以导致土壤中铅等重金属的污染。
而作为改善农田供给的另外一个途径就是施用污水污泥到土壤中,这样也会把铅等重金属带入到农田土壤中。
(3)城市生活来源:尽管越来越多选择施用无铅汽油,但是含铅汽油的使用仍然是人为排放到环境中最大的一个来源。
含铅汽油中含铅较高(400-1000mg/kg),致使交通工具排出的尾气中含有大量铅,积累于公路两旁的土壤中,也容易产生程度不同的铅污染。
据报道,一辆汽车平均每年排出约2.5kg铅。
而在城市固体垃圾中,铅含量在1000-50000 mg/kg之间,也可以通过垃圾浸出液渗入土壤中。
城市生活贡献铅污染还包括施用铅涂料:而这曾经认为这是儿童铅中毒最主要的来源,但是现在知道这只是许多种可能来源的一种而已。
四铅中毒及其危害
1 定义:环境中的铅经食物和呼吸途径进入人体,引起消化、神经、呼吸和免疫系统急性或慢性毒性影响,通常导致肠绞痛、贫血和肌肉瘫痪等病症,严重时可发生脑病甚至导致死亡的现象
2 铅入人体后,被吸收到血液循环中,主要以二盐基磷酸铅、铅的甘油磷酸盐、
蛋白复合物和铅离子等形态而循环。
血液中的铅约有95%左右分布在红细胞内。
血液和软组织中的铅浓度过高时,可产生毒性作用。
铅储存于骨骼时不发生中毒症状;由于感染、创伤、劳累、饮用含酒类的饮料或服酸性药物等而破坏体内酸碱平衡时,骨内不溶解的三盐基磷酸铅转化为可溶的二盐基磷酸铅移至血液;由于血液中铅浓度大量增加,可发生铅中毒症状。
五 2011年经媒体报道的铅污染事件
2011年1月安徽省怀宁县对高河镇新山社区儿童集体血铅超标事件发布了最新通报,据不完全统计,血铅超标儿童数量已达100多名。
2011年3月,台州上陶村等3个村庄共检测597人,血铅超标168人,其中儿童53人,需要驱铅治疗3人。
2011年5月浙江省德清县抽检群众1989人,已出监测结果的313人中29人血铅超标。
2011年5月卫生部门已对三威电池有限公司附近村民日前抽取的1468份血样检测完毕,结果是136份超标,其中达到铅中毒判定标准59人。
2011年6月浙江绍兴部分锡箔作坊人员及子女出现血铅超标。
2011年8月据不完全统计广西省河池市南丹县车河镇至少有103人被广西壮族自治区职业病防治研究院检出血铅水平超过了100微克/升。
2011年年9月初,上海康桥地区儿童在入园入学前进行体检当中,陆续发现部分儿童血液的含铅量超标,此后对当地1306名儿童进行血铅检测,发现有49名儿童血铅超标,其中以1-3岁儿童为主。
六铅污染的防治措施
铅污染问题的根本解决办法在与从源头着手,以预防为主,治理结合的路线,以下为一些建议:
1 加强燃煤废气、粉尘的排放标准以降低燃煤排放的铅含量。
而对于有色冶金、陶瓷等工业用铅,应尽量减少高温生产过程以减少大气铅污染的产生,如有色金属冶炼可尽量使用湿法代替火法、形材加工用冷加工代替热加工等。
持续加强无铅汽油的推广以减少汽车尾气排放造成的大气铅污染。
2 提高化学沉淀法、离子交换法、液膜法、电解法以及生物吸附法等各种含铅废水的治理技术,降低治理成本,加强各种工矿企业含铅废水的合理排放将有助于减少水体的铅污染。
另外,各种工业用铅可以通过提高技术减少用铅量或使用其它对环境无危害的材料代替铅,从源头上降低铅的使用。
3 由于土壤铅污染的来源复杂,可以从以下几方面加以控制:①严格控制含铅固废的杂乱堆放;②加强废旧蓄电池、铅管、铅板的回收循环再利用;③限制含铅污水的农业灌溉;④减少含铅农药、化肥的使用量,合理施肥;⑤针对大气铅污染造成的土壤铅污染,应加强燃煤废气、粉尘的排放管理以及推广无铅汽油的使用。
对于土壤铅污染的治理技术,目前国内有好多种,主要分成化学修复、物理修复以及生物修复3种。
其中,生物修复中的植物修复由于具有成本低、不破坏土壤与生态环境以及不引起二次污染等优点而成为目前土壤铅污染修复技术里最有前景的修复技术。
参考文献:《铅冶炼重金属污染现状及防治对策》作者北京矿冶研究总院《水泥窖铅镉等重金属的污染与防治》作者苏达根
《土壤铅污染及其治理措施》作者王卓。