△H1 =-Q1
2H2(g) + O2 (g)
= 2H2O(g) △H2 =-Q2 D. S(g) + O2(g) = SO2(g)
△H1 =-Q1
S(s) + O2(g) = SO2(g)
△H2 =-Q2
普通化学方程式
热化学方程式
化学计量数 整数,既表示微粒个数 又表示物质的量
整数或分数,只表示物质的量
2H2(g) +O2(g)
25 ℃ 101 kPa
2H2O (l)
ΔH= - 571.6 kJ/mol
物质状态不同,反应热不同
ΔH= -92.2kJ/mol
N2 + 3H2
2NH3
ΔH= +92.2kJ/mol
正向和逆向的△H 大小相等,符号相反
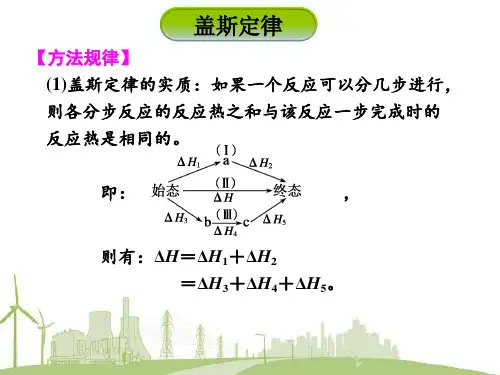
3.书写热化学方程式的注意事项 教材P9
(1)需注明反应的温度和压强,如不注明条件,即指: 25℃ 1.01×105Pa (2)各物质需标聚集状态(s、l、g、aq)反应条件如:高温、加热、催 化剂及“↑和↓”不用注明 (3)化学方程式的右边必须写上△H,并用“空格”隔开, △H吸热用“+”, 放热用“-”,单位是kJ/mol (4)热化学方程式中各物质化学计量数表示各物质的物质的量,可以为整 数、分数。若化学方程式中各物质的系数加倍,则△H 的数值也加倍。 (5)对可逆反应,正向和逆向的△H 大小相等,符号相反 (6)可逆反应中的△H 是指正反应完全进行时的反应热
聚集状态
ΔH 表达式 意义
不要求注明
必须注明
无
必须注明
化学计量数唯一
化学计量数不唯一
表明了物质变化 不仅表明了物质变化,也表明了能量变化