高中化学竞赛 无机化学
- 格式:ppt
- 大小:145.50 KB
- 文档页数:36


高中化学竞赛无机化学小结高中化学竞赛中的无机化学部分是一个知识体系庞大且富有深度的领域。
在这一部分的学习和竞赛准备中,我们需要对各种元素及其化合物的性质、结构、反应等有深入且全面的理解。
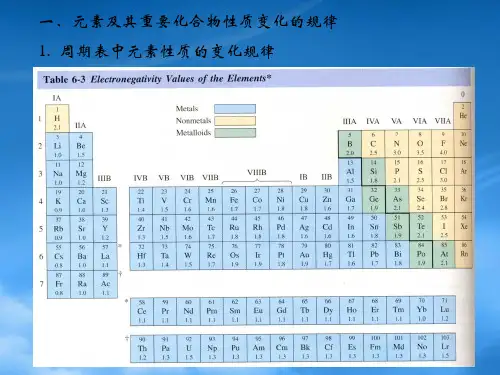
首先,元素周期表是无机化学的基石。
我们不仅要熟悉周期表的结构和排列规律,更要理解元素周期性的本质。
从原子半径、电离能、电子亲和能到电负性等性质的周期性变化,都反映了元素内在结构与外在性质的关联。
比如,同一周期从左到右,原子半径逐渐减小,电离能逐渐增大,元素的金属性逐渐减弱,非金属性逐渐增强。
对于主族元素,碱金属和碱土金属是比较常见的考点。
碱金属如钠、钾等,化学性质活泼,容易失去电子形成正离子,与水反应剧烈。
碱土金属如镁、钙等,相对碱金属来说,化学性质稍显温和,但在特定条件下也能发生强烈的化学反应。
卤族元素如氟、氯、溴、碘,它们的氧化性逐渐减弱,与氢气反应的条件也越来越苛刻。
氧族元素中的氧和硫,其化合物的性质多样,二氧化硫、三氧化硫以及各种含氧酸的性质和转化关系需要重点掌握。
过渡金属元素在无机化学中也占有重要地位。
它们具有可变的化合价和独特的配合物化学。
例如,铁元素常见的化合价有+2 和+3,在不同的环境下可以相互转化。
铜元素的+1 和+2 价化合物具有不同的颜色和性质。
配合物化学中,如六氰合铁(III)酸钾、四氨合铜(II)离子等,了解它们的形成条件、结构和稳定性对于解题至关重要。
无机化学中的化学热力学和化学动力学也是不容忽视的部分。
通过热力学定律,我们可以计算化学反应的焓变、熵变和自由能变化,从而判断反应的方向和可能性。
动力学则关注反应的速率和反应机制,比如通过碰撞理论和过渡态理论来解释反应速率的影响因素。
在无机化学实验方面,常见的实验操作和实验现象也是竞赛的重点。
比如物质的分离和提纯方法,如蒸馏、萃取、重结晶等;常见离子的检验方法,如氯离子用硝酸银溶液检验,硫酸根离子用氯化钡溶液检验等。
还有一些经典的无机化学实验,如制备氨气、氯气等,需要了解实验原理、装置、操作步骤和注意事项。

全国高中化学竞赛真题汇总高中化学竞赛是一项极具挑战性和专业性的学科竞赛,对于热爱化学、追求知识深度和广度的学生来说,是一个展示自己才华和实力的舞台。
以下是为大家汇总的一些全国高中化学竞赛的真题,希望能对准备参赛的同学们有所帮助。
一、无机化学部分真题 1:已知某元素 X 的原子序数为 25,其+2 价离子的电子构型为 Ar3d5。
请回答下列问题:(1)写出元素 X 的名称和元素符号。
(2)预测元素 X 的常见氧化态。
(3)比较元素 X 的+2 价离子和+3 价离子的稳定性,并说明原因。
这道题主要考查了原子结构和元素周期表的相关知识。
对于原子序数为 25 的元素,我们可以通过电子构型来确定其为锰(Mn)。
锰常见的氧化态有+2、+4、+6、+7 等。
在+2 价和+3 价离子中,由于+2 价离子的 3d 轨道半充满,结构相对稳定,所以+2 价离子比+3 价离子更稳定。
真题 2:给出下列化合物的名称:K2PtCl6、Co(NH3)6Cl3。
这道题考查了配合物的命名。
K2PtCl6的名称为六氯合铂(Ⅳ)酸钾,Co(NH3)6Cl3 的名称为三氯化六氨合钴(Ⅲ)。
二、有机化学部分真题 1:完成下列反应方程式:(1)CH3CH2CH=CH2 +HBr →(2)CH3CH2OH +PBr3 →对于第一个反应,根据马氏规则,氢原子会加到含氢较多的双键碳原子上,所以产物为 CH3CH2CHBrCH3。
第二个反应中,PBr3 可以将醇羟基转化为溴原子,产物为 CH3CH2Br。
真题 2:用化学方法鉴别以下化合物:苯甲醛、乙醛、丙酮。
鉴别这三种化合物可以利用醛基的特殊反应。
首先,分别加入银氨溶液(托伦试剂),能产生银镜反应的是苯甲醛和乙醛,无现象的是丙酮。
然后,向产生银镜反应的两种物质中加入斐林试剂,加热后产生砖红色沉淀的是乙醛,不产生沉淀的是苯甲醛。
三、物理化学部分真题 1:在 298 K 时,反应 2A +B → C 的速率常数 k = 10×10^(-3) L·mol^(-1)·s^(-1)。

高中化学竞赛无机化学6高中化学竞赛中的无机化学部分,是一个充满挑战与趣味的领域。
在这其中,第六部分的知识更是涵盖了众多关键的概念和原理。
首先,让我们来聊聊原子结构。
原子是构成物质的基本单位,了解其结构对于理解化学性质至关重要。
原子核位于原子的中心,由质子和中子组成,而电子则围绕着原子核高速运动。
质子的数量决定了元素的种类,而原子的质量主要由质子和中子共同决定。
电子在不同的能级轨道上运动,其分布遵循特定的规律。
比如,能层、能级、原子轨道等概念,都是理解电子运动状态的重要基础。
说到化学键,这可是无机化学中的重点。
离子键是通过阴阳离子之间的静电作用形成的,通常在活泼金属与活泼非金属之间形成。
共价键则是原子之间通过共用电子对形成的,分为极性共价键和非极性共价键。
金属键则存在于金属单质中,是由金属阳离子和自由电子之间的相互作用形成的。
这些不同类型的化学键决定了物质的物理性质和化学性质。
比如离子化合物通常具有较高的熔点和沸点,而共价化合物的性质则较为多样。
元素周期表是无机化学的重要工具。
在高中化学竞赛中,对元素周期表的深入理解是必不可少的。
同一周期的元素,从左到右,原子半径逐渐减小,金属性逐渐减弱,非金属性逐渐增强。
同一主族的元素,从上到下,原子半径逐渐增大,金属性逐渐增强,非金属性逐渐减弱。
这些规律有助于我们预测元素的性质和化合物的形成。
再来看看无机化合物。
氧化物是其中的一大类,包括酸性氧化物、碱性氧化物和两性氧化物等。
酸和碱的性质和分类也是重要的考点。
强酸强碱在溶液中完全电离,而弱酸弱碱则部分电离。
盐的种类繁多,有正盐、酸式盐和碱式盐等。
了解它们的水解规律对于判断溶液的酸碱性非常关键。
化学反应速率和化学平衡也是竞赛中的重点。
影响化学反应速率的因素有浓度、温度、压强、催化剂等。
而化学平衡则是一个动态平衡,当外界条件改变时,平衡会发生移动。
通过勒夏特列原理,我们可以判断平衡移动的方向。
在无机化学的实验部分,各种实验操作和实验现象需要我们熟练掌握。

精心整理无机化学计算题化学热力学:1.高价金属的氧化物在高温下容易分解为低价氧化物。
以氧化铜分解为氧化亚铜为例,估算反应分解的温度。
该反应的自发性是焓驱动的还是熵驱动的?温度升高对反应自发性的影响如何?解:4CuO===2Cu2O+O2△r Hθm(298K)=2△f Hθm(298K,Cu2O)+△f Hθm(O2)-4△f Hθm(298K,CuO)=-1△r Sθm=∴2.(1气?(2,该响如何?=-31.8-(-20.63)kJ·mol-1=-11.17kJ·mol-1△r S mθ=130.684+146-205.79--2×42.55J·K-1·mol-1=-14.206J·K-1·mol-1△r G mθ=△r H mθ-T△r S mθ=-6.94kJ·mol-1△r G m=△r G mθ+RT ln[(p(H2)/pθ)/(p(H2S)/pθ)]=△r G mθ=-6.94kJ·mol-1要使反应不发生,则△r G mθ≥0T≥△r H mθ/△r S mθ=787K即温度高于787K银器表面才不会因上述反应而变。
(2)2Ag(s)+H2S(g)+1/2O2(g)==Ag2S(s)+H2O(l)同理,298K时,△r H mθ=-285.83-31.8-(-20.63)kJ·mol-1=-297kJ·mol-1△r S mθ=-177.55J·K-1·mol-1△r G mθ=△r H mθ-T△r S mθ=-244.1kJ·mol-1当3△r△rp而△r G m=△r G m+RT ln(0.5×0.5)△r G mθ≈△r H mθ(298K)-T’△r S mθ(298K) ∴T’=△r H mθ(298K)/[△r S mθ(298K)-R ln(0.5×0.5)]=176.01×103)=594K4.试用热力学原理说明用一氧化碳还原三氧化二铝制铝是否可行?Al2O3COAlCO2已知:Δf G o/kJ?mol-1-1582-137.2-394.4Δf H o/kJ?mol-1-1676-110.5-393.5S o/J?mol-1?K-150.9197.628.3213.6解:Al2O3+3CO2Al+3CO2Δr G o=(-394.4)×3–3×(-137.2)–(-1582)=810.4(kJ?mol-1)因Δr G o>0,故298K时不能用CO还原Al2O3.Δr H o=(-393.5)×3-(-110.5×3)-(-1676)=827(kJ?mol-1)Δr S o=(213.6×3+28.3×2)–(197.6×3+50.9)=53.7(J?mol-1?K-1)o o,所以项目Na2SO4·10H2O Na2SO4H2O(g)△f G m?/(kJ·mol-1) -3644 -1267 -228.6解法1:△G?=-1267+10×(-228.6)-(-3644)=91(kJ·mol-1)K?=exp(-△r G m?/RT)=exp[(-91×103)/(8.315×298)]=1.1×10-16设Na2SO4·10H2O产生的水蒸气压为p1,则(p1/p?)10=K?=1.1×10-16p1=2.5(kPa)298K时空气的实际水的蒸汽压p2=3.17×60%=1.9(kPa)因p2<p1,所以Na2SO4·10H2O会风化。

高中化学竞赛推荐书目一、无机化学:1、基础教材类:《无机化学》(武汉大学、吉林大学,第三版,高教社,1994)很多人极崇拜的无机教材,的确很适合竞赛。
竞赛需要的元素知识大部分都在其中,编排思路也不错,但错误较多,看的时候需要慎重。
《无机化学》(吉林大学、武汉大学、南开大学,第四版,高教社,2004)我的启蒙教材啊。
普遍认为不如第三版,个人感觉理论部分还可以,条理比较清晰。
元素就不用看了,或者对照第三版找找新的东西就行。
《无机化学》(北京、华中、南京师范大学,第一版,人教社,1981)初中时查资料用的书。
感觉比第四版要好一些,不过很罕见。
《无机化学》(北京、华中、南京师范大学,第四版,高教社,2002)吴国庆的书,对于竞赛来说有一些参考价值。
理论部分很好,元素就是照格林伍德的书抄的,而且漏洞百出。
无机拓展知识部分值得一看,已经从中出过很多道竞赛题。
《普通化学原理》(华彤文、陈景祖等,第三版,北大,2005)北大普化教材,相当基础,相当细致,做启蒙教材比较适合。
《基础无机化学》(尹敬执、申泮文,第一版,人教社,1980)很老的一套教材,排版较乱,不过毕竟是院士的书,某些方面还是有值得借鉴之处的。
《基础无机化学》(F.A.科顿、G.威尔金森,南开大学译,第一版,科学,1984)当代著名无机化学家和诺贝尔化学奖得主共同编写的基础教材,有一些个人色彩,在有机金属化合物方面有较详尽的介绍。
2、元素化学类:《普通无机化学》(严宣申、王长富,第二版,北大,1999)与一般的教材思路不同,很有看的价值。
《化学元素周期系》(车云霞,申泮文,第一版,南开大学出版社,1999)书中有两个申老先生的科研成果,但整体较简略。
价值不大《大学普通化学》(傅鹰,人教社,1981)院士的书,其下册可以算是我看过的最经典的元素教材了。
语言相当风趣,讲述知识的同时也讲述科研方法、思想,而且适时地介绍做人的道理。
全书条理清晰,详略得当,对主要元素的介绍很到位,而且有一些独到的东西,看过之后大部分元素知识就不会再忘了。

化学竞赛无机化学绝密课件卤素一、卤素简介卤素,又称卤族元素,是元素周期表中第VIIA族元素,包括氟(F)、氯(Cl)、溴(Br)、碘(I)和砹(At)。
卤素元素在自然界中大多以无机盐形式存在,具有独特的化学性质和广泛的应用领域。
本课件旨在为化学竞赛选手提供卤素元素的系统性知识,帮助选手在竞赛中取得优异成绩。
二、卤素的物理性质1.氟:氟是卤素元素中最轻的一种,具有浅黄绿色,在常温常压下为气态,具有刺激性气味。
氟的熔点为-219.67℃,沸点为-188.1℃,密度约为0.0017g/cm³。
2.氯:氯是一种黄绿色气体,具有刺激性气味。
氯的熔点为-101.5℃,沸点为-34.04℃,密度约为3.21g/L。
3.溴:溴在常温常压下为液态,具有红棕色,具有刺激性气味。
溴的熔点为-7.2℃,沸点为58.78℃,密度约为3.12g/cm³。
4.碘:碘在常温常压下为固态,具有紫黑色,具有刺激性气味。
碘的熔点为113.7℃,沸点为184.3℃,密度约为4.93g/cm³。
5.砹:砹是一种放射性元素,具有多种同位素,其中^210At的半衰期最长,约为8.1小时。
砹的物理性质尚不明确,但一般认为其熔点、沸点较高,密度较大。
三、卤素的化学性质1.氧化性:卤素元素具有较强的氧化性,能与大多数金属和非金属发生反应。
氟的氧化性最强,可以与水反应氧气。
2.电子亲和能:卤素元素的电子亲和能较大,容易接受电子,形成负离子。
3.电负性:卤素元素的电负性较高,与碳、氢等元素形成的化合物中,卤素元素表现出较强的亲电子性。
4.反应符合性:卤素元素与氢、卤化氢、金属卤化物等化合物发生反应时,遵循相应的反应规律,如氟化反应、氯化反应、溴化反应、碘化反应等。
5.卤素互化反应:氟、氯、溴、碘之间可以发生互化反应,相应的卤化物。
四、卤素化合物卤素元素与金属、非金属、有机物等均可形成多种化合物,下面列举一些常见的卤素化合物:1.卤化氢:卤素元素与氢气反应,卤化氢(HX,X代表卤素元素)。

化学竞赛无机化学试题及答案一、选择题(每题2分,共20分)1. 以下哪种元素是地壳中含量最多的元素?A. 氧B. 硅C. 铝D. 铁2. 元素周期表中,第IA族元素的代表性特征是什么?A. 非金属性B. 金属性C. 稀有气体D. 放射性3. 根据元素周期律,同一主族元素的原子半径从上到下的变化趋势是什么?A. 逐渐减小B. 逐渐增大C. 先增大后减小D. 无规律变化4. 以下化合物中,哪一个是共价化合物?A. NaClB. CaOC. H2OD. FeS5. 金属晶体中,金属原子之间通过什么相互作用?A. 离子键B. 共价键C. 金属键D. 范德华力二、填空题(每空2分,共20分)6. 元素周期表中的第_______周期被称为长周期。
7. 原子序数为17的元素是_______。
8. 离子键通常存在于_______和_______之间。
9. 金属晶体的导电性是由于_______的存在。
10. 一个典型的离子晶体是_______。
三、简答题(每题10分,共30分)11. 描述什么是离子晶体,并给出一个例子。
12. 解释什么是配位数,并给出一个常见的配位化合物的例子。
四、计算题(每题15分,共30分)13. 已知某化合物的化学式为Fe2O3,计算其摩尔质量。
14. 假设有1.0摩尔的NaCl溶解在1升水中,计算溶液的摩尔浓度。
答案一、选择题1. A2. B3. B4. C5. C二、填空题6. 四7. 氯(Cl)8. 金属非金属9. 自由电子10. NaCl三、简答题11. 离子晶体是由正负离子通过静电吸引力结合形成的晶体。
例如,NaCl(氯化钠)就是一个典型的离子晶体。
12. 配位数是指一个中心原子或离子周围所连接的配体数量。
例如,[Fe(H2O)6]3+中,铁离子的配位数是6。
四、计算题13. Fe2O3的摩尔质量= 2 × 55.845(Fe的摩尔质量)+ 3 × 15.999(O的摩尔质量)= 159.688 g/mol。


化学竞赛无机化学方程式
今天是学校化学竞赛的日子,哇,好紧张呀!老师说,比赛的题目有点难,要写好多化学方程式呢。
我心里有点害怕,心跳“咚咚咚”地响,生怕做错了。
比赛开始啦,我看着题目,哎呀,这个题目好像是“氧化还原反应”!我想了想,记得老师讲过,氯化钠和银硝酸反应,得写成“NaCl+AgNO₃→AgCl+NaNO₃”,嗯,应该是这样吧!我赶紧把答案写下来,手也有点小抖呢。
接着还有一道题是硫酸和钠碳酸反应,“嘶啦”一声,我想起了这个方程式,应该是“Na₂CO₃+H₂SO₄→Na₂SO₄+CO₂+H₂O”!我用力写了出来,“咔嚓”一声笔尖戳在纸上,好像心里也没那么紧张了。
终于,比赛结束啦,我感觉自己好像学到了好多东西,虽然还有点小紧张,但是也很开心能参加!哎呀,老师说我做得挺好的,我也能继续努力,再多学一些化学知识,做个化学小专家!
—— 1 —1 —。
无机化学试题竞赛及答案一、选择题(每题5分,共40分)1. 下列元素中,属于金属元素的是:A. 碳(C)B. 氧(O)C. 钠(Na)D. 硫(S)答案:C2. 以下化合物中,属于共价化合物的是:A. 氯化钠(NaCl)B. 硫酸(H2SO4)C. 甲烷(CH4)D. 氢氧化钠(NaOH)答案:C3. 在化学反应中,氧化数增加的原子或离子被称为:A. 氧化剂B. 还原剂C. 氧化产物D. 还原产物答案:B4. 以下哪种物质是酸:A. 碳酸氢钠(NaHCO3)B. 氢氧化钠(NaOH)C. 硫酸(H2SO4)D. 氯化钠(NaCl)答案:C5. 根据周期表,下列元素中原子半径最大的是:A. 锂(Li)B. 钠(Na)C. 钾(K)D. 铯(Cs)答案:D6. 以下化合物中,属于离子化合物的是:A. 水(H2O)B. 二氧化碳(CO2)C. 氯化钠(NaCl)D. 氮气(N2)答案:C7. 根据勒夏特列原理,当一个可逆反应的系统受到外部条件变化时,系统会如何反应:A. 向产生更多能量的方向移动B. 向减少变化的方向移动C. 向产生更少能量的方向移动D. 没有变化答案:B8. 以下哪种反应类型是放热反应:A. 燃烧反应B. 光合作用C. 吸热反应D. 氧化还原反应答案:A二、填空题(每题5分,共20分)1. 金属铝的化学符号是________。
答案:Al2. 元素周期表中,第ⅦA族元素的名称是________。
答案:卤素3. 根据酸碱中和反应的定义,当酸和碱反应时,生成的是________和________。
答案:盐、水4. 摩尔质量的单位是________。
答案:g/mol三、简答题(每题10分,共20分)1. 请解释什么是电子亲和能,并给出一个例子。
答案:电子亲和能是指一个中性原子获得一个电子形成负离子时放出的能量。
例如,氯原子获得一个电子形成氯离子(Cl-)时,会放出电子亲和能。
2. 描述什么是氧化还原反应,并给出一个例子。
高中化学竞赛无机化学小结第一篇:高中化学竞赛无机化学小结有关水的反应小结一.水在氧化还原反应中的作用 l 水作氧化剂: 水与钠、其它碱金属、镁、等金属在一定温度下反应生成氢气和相应碱水与铁在高温下反应生成氢气和铁的氧化物(四氧化三铁)水与碳在高温下反应生成“水煤气”。
铝与强碱溶液反应 *硅与强碱溶液反应 l 水作还原剂:水与单质氟反应 l 水电解l 水既不作氧化剂也不作还原剂:水与氯气反应生成次氯酸和盐酸水与过氧化钠反应生成氢氧化钠和氧气水与二氧化氮反应生成硝酸和一氧化氮二。
水参与的非氧化还原反应: l 水合、水化:水与二氧化硫、三氧化硫、二氧化碳、五氧化二磷等酸性氧化物化合成酸。
(能与二氧化硅化合吗?)水与氧化钠、氧化钙等碱性氧化物化合成碱。
(氧化铝、氧化铁等与水化合吗?)氨的水合无水硫酸铜水合(变色,可检验液态有机物中是否含水)(喀斯特地貌的形成,氨碱法制纯碱等与上述CO2水合,NH3水合有关;浓硫酸吸水,用硝酸镁吸水浓缩稀硝酸等也与相关物质的水合有关;工业酒精用生石灰吸水以制无水酒精)乙烯水化成乙醇 *乙炔水化制乙醛 l 水解: 乙酸乙酯水解油脂水解(酸性水解或皂化反应)水与电石反应制乙炔名称中带“水”的物质(一)与氢的同位素或氧的价态有关的“水”。
蒸馏水—H2O 重水—D2O 超重水—T2O 双氧水—H2O2(二)水溶液氨水—(含分子:NH3,H2O,NH3·H2O,含离子:NH4+,OH-,H+)氯水—(含分子:Cl2,H2O,HClO,含离子:H+,Cl-,ClO-,OH-)卤水—常指海水晒盐后的母液或粗盐潮解所得溶液,含NaCl、MgCl2、NaBr等王水—浓硝酸和浓盐酸的混合物(1:3)硬水—含有校多Ca2+,Mg2+的水软水—不含或只含少量Ca2+、Mg2+的水生理盐水—0.9%的NaCl溶液水玻璃—Na2SiO3溶液(三)其它水银--Hg 水晶--SiO2 水泥—2CaO·SiO2、3CaO·SiO2、3CaO·Al2O3 铁水—一般指熔融的生铁,含Fe、C、Mn、Si、P等水煤气—CO、H2的混合气生成氧气的反应小结(1)氯酸钾热分解(二氧化锰催化)(2)高锰酸钾热分解*(3)过氧化氢分解(二氧化锰催化)(4)电解水(5)氧化汞热分解(6)浓硝酸分解(7)次氯酸分解(光)(8)氟与水置换反应(9)过氧化钠与水反应(10)过氧化钠与二氧化碳反应*(11)光合作用以上1~3适合实验室制取氧气,但一般所谓“实验室制取氧气”是指1、2两种方法。
化学竞赛书目一、无机化学:1、基础教材类:《无机化学》(武汉大学、吉林大学,第三版,高教社,1994)很多人极崇拜的无机教材,的确很适合竞赛。
竞赛需要的元素知识大部分都在其中,编排思路也不错,但错误较多,看的时候需要慎重。
《无机化学》(吉林大学、武汉大学、南开大学,第四版,高教社,2004)我的启蒙教材啊。
普遍认为不如第三版,个人感觉理论部分还可以,条理比较清晰。
元素就不用看了,或者对照第三版找找新的东西就行。
《无机化学》(北京、华中、南京师范大学,第一版,人教社,1981)初中时查资料用的书。
感觉比第四版要好一些,不过很罕见。
《无机化学》(北京、华中、南京师范大学,第四版,高教社,2002)吴国庆的书,对于竞赛来说有一些参考价值。
理论部分很好,元素就是照格林伍德的书抄的,而且漏洞百出。
无机拓展知识部分值得一看,已经从中出过很多道竞赛题。
《普通化学原理》(华彤文、陈景祖等,第三版,北大,2005)北大普化教材,相当基础,相当细致,做启蒙教材比较适合。
《基础无机化学》(尹敬执、申泮文,第一版,人教社,1980)很老的一套教材,排版较乱,不过毕竟是院士的书,某些方面还是有值得借鉴之处的。
《基础无机化学》(F.A.科顿、G.威尔金森,南开大学译,第一版,科学,1984)当代著名无机化学家和诺贝尔化学奖得主共同编写的基础教材,有一些个人色彩,在有机金属化合物方面有较详尽的介绍。
2、元素化学类:《普通无机化学》(严宣申、王长富,第二版,北大,1999)与一般的教材思路不同,很有看的价值。
《化学元素周期系》(车云霞,申泮文,第一版,南开大学出版社,1999)书中有两个申老先生的科研成果,但整体较简略。
价值不大《大学普通化学》(傅鹰,人教社,1981)院士的书,其下册可以算是我看过的最经典的元素教材了。
语言相当风趣,讲述知识的同时也讲述科研方法、思想,而且适时地介绍做人的道理。
全书条理清晰,详略得当,对主要元素的介绍很到位,而且有一些独到的东西,看过之后大部分元素知识就不会再忘了。
高中化学竞赛无机化学在高中化学竞赛的领域中,无机化学无疑是一座巍峨的山峰,等待着学子们去攀登和征服。
无机化学,作为化学学科的重要分支,涵盖了丰富多样的内容,从元素周期表的规律到各种无机化合物的性质,从化学反应的原理到实际应用,无一不让人感受到化学世界的神奇与魅力。
首先,元素周期表是无机化学的基石。
它不仅仅是一张罗列元素的表格,更是揭示元素性质规律的密码图。
沿着周期表的横行和纵列,我们可以清晰地看到元素的周期性变化。
同一周期中,从左到右,原子半径逐渐减小,金属性逐渐减弱,非金属性逐渐增强;同一主族中,从上到下,原子半径逐渐增大,金属性逐渐增强,非金属性逐渐减弱。
这些规律为我们理解元素的化学性质提供了重要的线索。
比如,碱金属元素(锂、钠、钾等)具有很强的还原性,而卤族元素(氟、氯、溴等)则具有很强的氧化性。
无机化合物的种类繁多,性质各异。
氧化物、酸、碱、盐是其中常见的几大类。
氧化物又分为酸性氧化物、碱性氧化物和两性氧化物。
酸性氧化物如二氧化碳、二氧化硫等,能与碱反应生成盐和水;碱性氧化物如氧化钠、氧化钙等,能与酸反应生成盐和水;而两性氧化物如氧化铝,既能与酸反应,又能与碱反应。
酸和碱的性质也是竞赛中的重点。
强酸强碱在水溶液中完全电离,而弱酸弱碱则部分电离。
常见的强酸有盐酸、硫酸、硝酸等,强碱有氢氧化钠、氢氧化钾等。
盐的种类更是丰富多样,正盐、酸式盐、碱式盐都有各自独特的性质。
化学反应是无机化学的核心内容之一。
氧化还原反应、酸碱中和反应、沉淀反应等在竞赛中经常出现。
氧化还原反应中,电子的转移是关键。
通过化合价的变化,我们可以判断氧化剂和还原剂,计算电子转移的数目。
酸碱中和反应则是氢离子和氢氧根离子结合生成水的过程。
沉淀反应则涉及到溶度积的概念,通过比较离子积和溶度积的大小,可以判断是否会生成沉淀。
在无机化学的学习中,实验也是不可或缺的一部分。
通过实验,我们可以直观地观察到化学反应的现象,验证理论知识。