化学竞赛-无机化学知识
- 格式:ppt
- 大小:716.00 KB
- 文档页数:84

无机化学实验知识竞赛题一.容易题(12道)是非题:1.不慎将浓碱液沾到皮肤上,要立即用大量水冲洗,再涂上硼酸溶液。
(√)2.用100mL容量瓶准确量取100.00ml某标准溶液。
(×)3.三种无机实验中使用的固、液分离方法为倾析法、过滤法和离心分离法。
(√)4.使用托盘天平加砝码时应按其质量由小到大的顺序添加,最后移动游码。
(×)单选题1.下列实验仪器中,常用来取用块状固体药品的仪器是()。
答:AA.药匙B.试管夹C.镊子D.坩埚钳2.下列常用仪器中不能直接用火加热的是()。
答:BA.蒸发皿B.表面皿C.坩埚 D.烧杯3.下列仪器使用前不必检查其是否漏水的是:答:DA.分液漏斗 B. 碱式滴定管 C. 容量瓶 D. 长颈漏斗。
4.下列实验操作能达到测量要求的是:答案:A。
A.用托盘天平称量25.2g氯化钠B. 用10mL量筒量取7.50mL稀硫酸C.用25mL移液管量取14.8mL溶液D. 用广泛PH试纸测得溶液的PH为4.25.化学纯试剂的标签颜色是()答:BA. 红色B. 蓝色C. 玫瑰红色D. 深绿色6.实验室常用浓盐酸的摩尔浓度是()答:A。
A.12B.14C. 16D.187.配制FeCl3溶液,为防止水解,应加入:答:C。
A、NaOHB、NaClC、HClD、HNO38.用pH试纸测定某酸溶液的pH值时,正确操作是()。
答:DA. 将pH试纸伸入待测酸溶液的试剂瓶中蘸取酸液。
B. 将待测酸溶液倒入试管中,将pH试纸伸入试管中蘸取酸液。
C. 先将待测液倒在试管中,再用玻璃棒从试管中蘸取酸液沾到pH试纸上。
D. 用玻璃棒从试剂瓶中直接蘸取酸液,然后蘸到pH试纸上9.往AgCl沉淀中加入浓氨水,沉淀消失,这是因为()。
答:DA. 盐效应B.同离子效应C.酸效应D.配位效应10.配置好的盐酸溶液贮存于()中。
答:CA.棕色橡皮塞试剂瓶B.白色橡皮赛试剂瓶C.白色磨口塞试剂瓶D.试剂瓶11.在实验室中,皮肤溅上浓碱时,用大量水冲洗后,应再用()溶液处理。

高中化学竞赛无机化学小结高中化学竞赛中的无机化学部分是一个知识体系庞大且富有深度的领域。
在这一部分的学习和竞赛准备中,我们需要对各种元素及其化合物的性质、结构、反应等有深入且全面的理解。
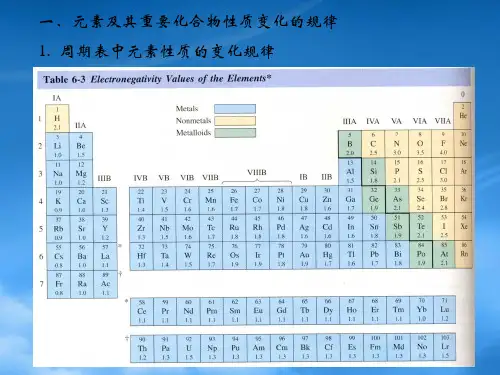
首先,元素周期表是无机化学的基石。
我们不仅要熟悉周期表的结构和排列规律,更要理解元素周期性的本质。
从原子半径、电离能、电子亲和能到电负性等性质的周期性变化,都反映了元素内在结构与外在性质的关联。
比如,同一周期从左到右,原子半径逐渐减小,电离能逐渐增大,元素的金属性逐渐减弱,非金属性逐渐增强。
对于主族元素,碱金属和碱土金属是比较常见的考点。
碱金属如钠、钾等,化学性质活泼,容易失去电子形成正离子,与水反应剧烈。
碱土金属如镁、钙等,相对碱金属来说,化学性质稍显温和,但在特定条件下也能发生强烈的化学反应。
卤族元素如氟、氯、溴、碘,它们的氧化性逐渐减弱,与氢气反应的条件也越来越苛刻。
氧族元素中的氧和硫,其化合物的性质多样,二氧化硫、三氧化硫以及各种含氧酸的性质和转化关系需要重点掌握。
过渡金属元素在无机化学中也占有重要地位。
它们具有可变的化合价和独特的配合物化学。
例如,铁元素常见的化合价有+2 和+3,在不同的环境下可以相互转化。
铜元素的+1 和+2 价化合物具有不同的颜色和性质。
配合物化学中,如六氰合铁(III)酸钾、四氨合铜(II)离子等,了解它们的形成条件、结构和稳定性对于解题至关重要。
无机化学中的化学热力学和化学动力学也是不容忽视的部分。
通过热力学定律,我们可以计算化学反应的焓变、熵变和自由能变化,从而判断反应的方向和可能性。
动力学则关注反应的速率和反应机制,比如通过碰撞理论和过渡态理论来解释反应速率的影响因素。
在无机化学实验方面,常见的实验操作和实验现象也是竞赛的重点。
比如物质的分离和提纯方法,如蒸馏、萃取、重结晶等;常见离子的检验方法,如氯离子用硝酸银溶液检验,硫酸根离子用氯化钡溶液检验等。
还有一些经典的无机化学实验,如制备氨气、氯气等,需要了解实验原理、装置、操作步骤和注意事项。




化学奥赛⾃学资料—⽆机化学全部知识要点及配套练习奥赛⾃学资料—⽆机化学全部知识要点及配套练习⼀.⽆机化学(理论部分)知识点应⽤归纳1、⽆机物(分⼦或离⼦)构型:(1)简单分⼦(或离⼦):(2)配合物:2、物质的熔、沸点(包括硬度):(1)晶体类型:原⼦晶体,离⼦晶体,⾦属晶体,分⼦晶体(2)离⼦晶体:(3)分⼦晶体(4)⾦属晶体:⾦属键(与价电⼦、价轨道有关)3、物质的稳定性:(1)⽆机⼩分⼦:(2)配合物:4、物质的磁性:(1)⽆机⼩分⼦:MO (掌握双原⼦分⼦轨道能级图)(共价双原⼦分⼦)(2)配合物:5、物质的颜⾊:(1)⽆机⼩分⼦:极化理论(2)配合物:6、⽆机物溶解度:(1)离⼦晶体:(2)共价化合物:7、物质的氧化还原性:影响因素(1)溶液酸、碱度(2)物质的聚集状态8、化学反应⽅向:(1)热⼒学数据:(2)软硬酸碱理论9、分⼦极性、键的极性、键⾓、键长等:10、推导元素在周期表中的位置:能级组取值,选择—组合理量⼦数:四个量⼦数取值规则11、溶液中有关质点浓度计算:化学平衡,电离平衡,沉淀—溶解平衡,氧化—还原平衡,配合解离平衡:利⽤多重平衡规则,K是关键12、常见的基本概念:对⾓线规则;惰性电⼦对效应;Lewis酸、碱;质⼦酸、碱;缓冲溶液;屏蔽效应;钻穿效应;同离⼦效应;盐效应;镧系收缩;电负性;电离势;电⼦亲合势;晶格能;键能;有效核电荷及求法等。
⼆.⽆机化学(元素部分)(1)结构(2)性质:重点是化学性质第⼀讲分⼦结构(molecular structure)1-1 离⼦键理论⼀、基本要点活泼⾦属和活泼⾮⾦属的原⼦反应时,⽣成的化合物如NaCl等都是离⼦型化合物,它们具有⼀些固有的特征,如它们都以晶体的形式存在,具有较⾼的熔、沸点,在熔融态或⽔溶液中可导电等。
这种由于原⼦间发⽣电⼦转移,⽣成正负离⼦,并通过静电库仑作⽤⽽形成的化学键称为离⼦键。
通常,⽣成离⼦键的条件是两原⼦的电负性差⼤于1.7以上,由离⼦键形成的化合物叫做离⼦键化合物。

化学竞赛无机部分笔记摘要化学竞赛无机部分笔记摘要。
一、路易斯结构式一、FC(形式电荷)计算公式1、公式及其表达意义V=价电子总数L=孤对电子数(不是电子对数,电子数为电子对数的2倍) S=共用电子数FC=2、中性原子FC之和应等于零;负离子FC之和应为负值,绝对值等于所带电量;正离子FC 之和应为正值,绝对值等于所带电量。
3、注意Lewis结构式中孤电子(对)要标出,结构稳定的一般满足8电子结构。
另外形式电荷的大小与整体结构的稳定性无关,结构首先要符合八隅律,然后再考虑形式电荷大小。
绝对值越低越稳定。
在满足八隅律的前提下·以总量最低的为准。
4、形式电荷不同于氧化数。
二、路易斯结构式画法1、首先确定分子骨架,通过电离能,较低在中间。
2、依照路易斯结构规则讨论价电子总数3、讨论按八隅体规则共需多少电子4、确定成键电子=所需总数-价电子总数5、合理排列,画出简图6、添加孤对电子7、成键连线,标孤对电子8、检验FC,选择FC最低的结构三、共振杂化1、共振论认为,如果一个物质存在两种以上满足共振要求的路易斯结构,这类物质只能用共振式来书写,而且它们实际上综合具有这些结构的特点。
每一个共振中的结构称为共振结构或极限结构,而这样的物质看作由共振结构“杂化”而成,称为杂化体。
2、共振能杂化体的能量总是低于各极限结构,常用共振能的概念来表示该降低值。
它被定义为杂化体能量低于最稳定极限结构能量的数值,常与另一个概念离域能混用。
电子的离域降低了轨道能,增加了分子的稳定性,常会造成分子的芳香性,如苯。
共振能随着极限结构数的增多而增大,尤其是存在等价极限结构时(能量相等)。
可由量子化学计算、热化学方法或分子的氢化热来估计共振能。
四、八隅体规则不适用的情况1、奇数价电子情况1)、自由基时未成对电子添加在中心原子上,单电子导致自由基化学性质活泼。
在体内人即需要自由基有有酶修复自由基造成的损害。
2)、一氧化氮(NO)属于自由基(这种缺少了一个电子,而又非常活跃的原子或分子的自由基,自由基,化学上也称为“游离基”,是指化合物的分子在光热等外界条件下,共价键发生均裂而形成的具有不成对电子的原子或基团。

全国高中化学竞赛真题汇总高中化学竞赛是一项极具挑战性和专业性的学科竞赛,对于热爱化学、追求知识深度和广度的学生来说,是一个展示自己才华和实力的舞台。
以下是为大家汇总的一些全国高中化学竞赛的真题,希望能对准备参赛的同学们有所帮助。
一、无机化学部分真题 1:已知某元素 X 的原子序数为 25,其+2 价离子的电子构型为 Ar3d5。
请回答下列问题:(1)写出元素 X 的名称和元素符号。
(2)预测元素 X 的常见氧化态。
(3)比较元素 X 的+2 价离子和+3 价离子的稳定性,并说明原因。
这道题主要考查了原子结构和元素周期表的相关知识。
对于原子序数为 25 的元素,我们可以通过电子构型来确定其为锰(Mn)。
锰常见的氧化态有+2、+4、+6、+7 等。
在+2 价和+3 价离子中,由于+2 价离子的 3d 轨道半充满,结构相对稳定,所以+2 价离子比+3 价离子更稳定。
真题 2:给出下列化合物的名称:K2PtCl6、Co(NH3)6Cl3。
这道题考查了配合物的命名。
K2PtCl6的名称为六氯合铂(Ⅳ)酸钾,Co(NH3)6Cl3 的名称为三氯化六氨合钴(Ⅲ)。
二、有机化学部分真题 1:完成下列反应方程式:(1)CH3CH2CH=CH2 +HBr →(2)CH3CH2OH +PBr3 →对于第一个反应,根据马氏规则,氢原子会加到含氢较多的双键碳原子上,所以产物为 CH3CH2CHBrCH3。
第二个反应中,PBr3 可以将醇羟基转化为溴原子,产物为 CH3CH2Br。
真题 2:用化学方法鉴别以下化合物:苯甲醛、乙醛、丙酮。
鉴别这三种化合物可以利用醛基的特殊反应。
首先,分别加入银氨溶液(托伦试剂),能产生银镜反应的是苯甲醛和乙醛,无现象的是丙酮。
然后,向产生银镜反应的两种物质中加入斐林试剂,加热后产生砖红色沉淀的是乙醛,不产生沉淀的是苯甲醛。
三、物理化学部分真题 1:在 298 K 时,反应 2A +B → C 的速率常数 k = 10×10^(-3) L·mol^(-1)·s^(-1)。

高中化学竞赛无机化学6高中化学竞赛中的无机化学部分,是一个充满挑战与趣味的领域。
在这其中,第六部分的知识更是涵盖了众多关键的概念和原理。
首先,让我们来聊聊原子结构。
原子是构成物质的基本单位,了解其结构对于理解化学性质至关重要。
原子核位于原子的中心,由质子和中子组成,而电子则围绕着原子核高速运动。
质子的数量决定了元素的种类,而原子的质量主要由质子和中子共同决定。
电子在不同的能级轨道上运动,其分布遵循特定的规律。
比如,能层、能级、原子轨道等概念,都是理解电子运动状态的重要基础。
说到化学键,这可是无机化学中的重点。
离子键是通过阴阳离子之间的静电作用形成的,通常在活泼金属与活泼非金属之间形成。
共价键则是原子之间通过共用电子对形成的,分为极性共价键和非极性共价键。
金属键则存在于金属单质中,是由金属阳离子和自由电子之间的相互作用形成的。
这些不同类型的化学键决定了物质的物理性质和化学性质。
比如离子化合物通常具有较高的熔点和沸点,而共价化合物的性质则较为多样。
元素周期表是无机化学的重要工具。
在高中化学竞赛中,对元素周期表的深入理解是必不可少的。
同一周期的元素,从左到右,原子半径逐渐减小,金属性逐渐减弱,非金属性逐渐增强。
同一主族的元素,从上到下,原子半径逐渐增大,金属性逐渐增强,非金属性逐渐减弱。
这些规律有助于我们预测元素的性质和化合物的形成。
再来看看无机化合物。
氧化物是其中的一大类,包括酸性氧化物、碱性氧化物和两性氧化物等。
酸和碱的性质和分类也是重要的考点。
强酸强碱在溶液中完全电离,而弱酸弱碱则部分电离。
盐的种类繁多,有正盐、酸式盐和碱式盐等。
了解它们的水解规律对于判断溶液的酸碱性非常关键。
化学反应速率和化学平衡也是竞赛中的重点。
影响化学反应速率的因素有浓度、温度、压强、催化剂等。
而化学平衡则是一个动态平衡,当外界条件改变时,平衡会发生移动。
通过勒夏特列原理,我们可以判断平衡移动的方向。
在无机化学的实验部分,各种实验操作和实验现象需要我们熟练掌握。

无机化学知识点总结一、无机化学的基本原理1. 原子结构与元素周期表原子是物质的基本单位,由原子核和绕核电子组成。
原子核由质子和中子组成,质子数决定了元素的原子序数,即元素周期表中的元素编号。
而电子的排布决定了元素的化学性质。
元素周期表是基于元素的原子序数和化学性质进行排列的,它反映了元素的周期性规律和趋势。
2. 化学键与晶体结构化学键是原子之间的相互作用力。
根据原子之间的电子共享或转移,化学键可以分为共价键、离子键和金属键。
共价键是通过电子共享形成的,离子键是通过电子转移形成的,金属键是金属原子内的电子云相互重叠形成的。
这些化学键形成了物质的晶体结构,晶体结构的类型决定了物质的性质。
3. 反应平衡与化学反应化学反应是物质之间发生化学变化的过程,通常包括物质的生成和消耗。
化学反应通过反应方程式进行描述,反应平衡是指反应物和生成物的摩尔比在一定条件下保持不变的状态。
化学反应的平衡常数和动力学速率是化学反应研究的重要参数。
4. 配位化学与过渡金属化合物过渡金属化合物是指含有过渡金属元素的化合物,其中过渡金属离子通过配位基与配位子形成配合物。
配位化学研究了配位物的结构、性质和合成方法,配位物的稳定性、配位数、立体化学等是配位化学的重要内容。
二、无机化学的主要知识点1. 主族元素化合物主族元素是元素周期表中的ⅢA、ⅣA、ⅤA、ⅥA和ⅦA族元素,它们可形成氧化物、氢化物、卤化物等化合物。
主族元素的化合物具有多种性质,如ⅢA族元素具有氧化性,ⅣA族元素具有还原性等。
2. 离子化合物离子化合物是由阳离子和阴离子组成的化合物,它们通常具有良好的溶解度、导电性和晶体结构。
离子化合物的性质和结构与其离子的大小、电荷和架构有关。
3. 氧化还原反应氧化还原反应是指物质失去或获得电子,从而使氧化态发生变化的化学反应。
氧化还原反应包括氧化、还原、氧化剂和还原剂等概念,它们是化学反应中的重要参与者。
4. 配合物化学过渡金属离子通过配体与配位子形成配合物,配合物具有不同的结构、性质和应用。
化学竞赛无机化学绝密课件卤素一、卤素简介卤素,又称卤族元素,是元素周期表中第VIIA族元素,包括氟(F)、氯(Cl)、溴(Br)、碘(I)和砹(At)。
卤素元素在自然界中大多以无机盐形式存在,具有独特的化学性质和广泛的应用领域。
本课件旨在为化学竞赛选手提供卤素元素的系统性知识,帮助选手在竞赛中取得优异成绩。
二、卤素的物理性质1.氟:氟是卤素元素中最轻的一种,具有浅黄绿色,在常温常压下为气态,具有刺激性气味。
氟的熔点为-219.67℃,沸点为-188.1℃,密度约为0.0017g/cm³。
2.氯:氯是一种黄绿色气体,具有刺激性气味。
氯的熔点为-101.5℃,沸点为-34.04℃,密度约为3.21g/L。
3.溴:溴在常温常压下为液态,具有红棕色,具有刺激性气味。
溴的熔点为-7.2℃,沸点为58.78℃,密度约为3.12g/cm³。
4.碘:碘在常温常压下为固态,具有紫黑色,具有刺激性气味。
碘的熔点为113.7℃,沸点为184.3℃,密度约为4.93g/cm³。
5.砹:砹是一种放射性元素,具有多种同位素,其中^210At的半衰期最长,约为8.1小时。
砹的物理性质尚不明确,但一般认为其熔点、沸点较高,密度较大。
三、卤素的化学性质1.氧化性:卤素元素具有较强的氧化性,能与大多数金属和非金属发生反应。
氟的氧化性最强,可以与水反应氧气。
2.电子亲和能:卤素元素的电子亲和能较大,容易接受电子,形成负离子。
3.电负性:卤素元素的电负性较高,与碳、氢等元素形成的化合物中,卤素元素表现出较强的亲电子性。
4.反应符合性:卤素元素与氢、卤化氢、金属卤化物等化合物发生反应时,遵循相应的反应规律,如氟化反应、氯化反应、溴化反应、碘化反应等。
5.卤素互化反应:氟、氯、溴、碘之间可以发生互化反应,相应的卤化物。
四、卤素化合物卤素元素与金属、非金属、有机物等均可形成多种化合物,下面列举一些常见的卤素化合物:1.卤化氢:卤素元素与氢气反应,卤化氢(HX,X代表卤素元素)。
化学竞赛无机化学试题及答案一、选择题(每题2分,共20分)1. 以下哪种元素是地壳中含量最多的元素?A. 氧B. 硅C. 铝D. 铁2. 元素周期表中,第IA族元素的代表性特征是什么?A. 非金属性B. 金属性C. 稀有气体D. 放射性3. 根据元素周期律,同一主族元素的原子半径从上到下的变化趋势是什么?A. 逐渐减小B. 逐渐增大C. 先增大后减小D. 无规律变化4. 以下化合物中,哪一个是共价化合物?A. NaClB. CaOC. H2OD. FeS5. 金属晶体中,金属原子之间通过什么相互作用?A. 离子键B. 共价键C. 金属键D. 范德华力二、填空题(每空2分,共20分)6. 元素周期表中的第_______周期被称为长周期。
7. 原子序数为17的元素是_______。
8. 离子键通常存在于_______和_______之间。
9. 金属晶体的导电性是由于_______的存在。
10. 一个典型的离子晶体是_______。
三、简答题(每题10分,共30分)11. 描述什么是离子晶体,并给出一个例子。
12. 解释什么是配位数,并给出一个常见的配位化合物的例子。
四、计算题(每题15分,共30分)13. 已知某化合物的化学式为Fe2O3,计算其摩尔质量。
14. 假设有1.0摩尔的NaCl溶解在1升水中,计算溶液的摩尔浓度。
答案一、选择题1. A2. B3. B4. C5. C二、填空题6. 四7. 氯(Cl)8. 金属非金属9. 自由电子10. NaCl三、简答题11. 离子晶体是由正负离子通过静电吸引力结合形成的晶体。
例如,NaCl(氯化钠)就是一个典型的离子晶体。
12. 配位数是指一个中心原子或离子周围所连接的配体数量。
例如,[Fe(H2O)6]3+中,铁离子的配位数是6。
四、计算题13. Fe2O3的摩尔质量= 2 × 55.845(Fe的摩尔质量)+ 3 × 15.999(O的摩尔质量)= 159.688 g/mol。
高中化学竞赛无机化学在高中化学竞赛的领域中,无机化学无疑是一座巍峨的山峰,等待着学子们去攀登和征服。
无机化学,作为化学学科的重要分支,涵盖了丰富多样的内容,从元素周期表的规律到各种无机化合物的性质,从化学反应的原理到实际应用,无一不让人感受到化学世界的神奇与魅力。
首先,元素周期表是无机化学的基石。
它不仅仅是一张罗列元素的表格,更是揭示元素性质规律的密码图。
沿着周期表的横行和纵列,我们可以清晰地看到元素的周期性变化。
同一周期中,从左到右,原子半径逐渐减小,金属性逐渐减弱,非金属性逐渐增强;同一主族中,从上到下,原子半径逐渐增大,金属性逐渐增强,非金属性逐渐减弱。
这些规律为我们理解元素的化学性质提供了重要的线索。
比如,碱金属元素(锂、钠、钾等)具有很强的还原性,而卤族元素(氟、氯、溴等)则具有很强的氧化性。
无机化合物的种类繁多,性质各异。
氧化物、酸、碱、盐是其中常见的几大类。
氧化物又分为酸性氧化物、碱性氧化物和两性氧化物。
酸性氧化物如二氧化碳、二氧化硫等,能与碱反应生成盐和水;碱性氧化物如氧化钠、氧化钙等,能与酸反应生成盐和水;而两性氧化物如氧化铝,既能与酸反应,又能与碱反应。
酸和碱的性质也是竞赛中的重点。
强酸强碱在水溶液中完全电离,而弱酸弱碱则部分电离。
常见的强酸有盐酸、硫酸、硝酸等,强碱有氢氧化钠、氢氧化钾等。
盐的种类更是丰富多样,正盐、酸式盐、碱式盐都有各自独特的性质。
化学反应是无机化学的核心内容之一。
氧化还原反应、酸碱中和反应、沉淀反应等在竞赛中经常出现。
氧化还原反应中,电子的转移是关键。
通过化合价的变化,我们可以判断氧化剂和还原剂,计算电子转移的数目。
酸碱中和反应则是氢离子和氢氧根离子结合生成水的过程。
沉淀反应则涉及到溶度积的概念,通过比较离子积和溶度积的大小,可以判断是否会生成沉淀。
在无机化学的学习中,实验也是不可或缺的一部分。
通过实验,我们可以直观地观察到化学反应的现象,验证理论知识。