李军川:乳腺导管内增生性病变(宁夏)
- 格式:pdf
- 大小:8.57 MB
- 文档页数:67

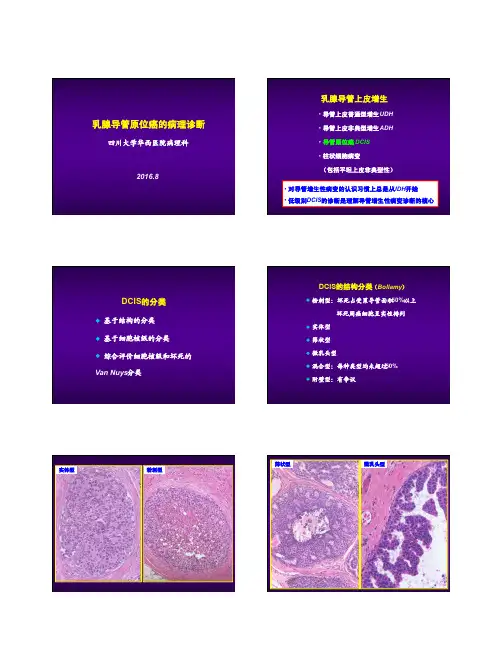
乳腺导管原位癌的病理诊断四川大学华西医院病理科2016.8乳腺导管上皮增生•导管上皮普通型增生UDH•导管上皮非典型增生ADH•导管原位癌DCIS•柱状细胞病变(包括平坦上皮非典型性)•对导管增生性病变的认识习惯上总是从UDH开始•低级别DCIS 的诊断是理解导管增生性病变诊断的核心DCIS的分类u 基于结构的分类u 基于细胞核级的分类u 综合评价细胞核级和坏死的Van Nuys 分类DCIS的结构分类(Bollamy)u粉刺型:坏死占受累导管面积50%以上坏死周癌细胞呈实性排列u实体型u筛状型u微乳头型u混合型:每种类型均未超过50%u 附壁型:有争议实体型粉刺型筛状型微乳头型所谓的“附壁型”2012 WHO:只有那些伴有高级别核改变的病变才能诊断为DCIS导管原位癌核级(低、中、高)Schnitt低级别DCIS的简要诊断标准u增生细胞纯化(特别是细胞核)u细胞分布较均匀u特征性的结构模式u病变往往累及多支导管低级别DCIS的结构模式u结构特点:1 筛状结构:细胞群内出现“冲凿”样圆形或椭圆形的腔隙,腔缘光滑、有张力、均匀分布2 微乳头:纺锤状(基底细,体部膨大)、量多体积大3 僵直的细胞搭桥、有张力的拱形结构4 实体结构:依赖对细胞形态的判断Tavassoli筛状结构有张力、均匀分布WHO纯化;细胞分布均匀WHO微乳头状结构WHO细胞纯化细胞纯化纺锤状Tavassoli僵直的细胞搭桥有张力的拱形结构WHO低级别DCIS诊断的量化标准u至少有两个导管完全受累(Page)u受累导管合计>2mm(Tavassoli )中等级别DCISu显示低核级,但部分导管含有坏死u 显示中等核级,坏死可有或无导管原位癌核级(低、中、高)Schnitt高级别DCISu核明显多形、极向紊乱、分布不均,核形不规则,染色质粗糙,核仁明显u核分裂常见,但不是诊断必需u呈单层、微乳头、筛状或实性u坏死常呈粉刺样,但并非必需u即使一个导管有典型形态学特点也足够诊断高级别核大汗腺型DCIS少见亚型u大汗腺型u梭形细胞型u印戒细胞型u透明细胞型u小细胞型u二态型u黏液型u鳞状细胞型u 囊性高分泌型梭形细胞型印戒细胞型透明细胞型二态型小细胞型p63黏液型囊性高分泌型鳞状细胞型如何报告“导管原位癌”• 核级(低、中、高)、坏死、钙化、组织学模式• 导管原位癌(高核级伴坏死、钙化,筛状、微乳头状结构)鉴别诊断UDH的简要诊断标准u 增生细胞间腔隙不规则,分布不均匀,多位于周边u 细胞核分布不均匀、有重叠(合体状)u 细胞形态多样,非纯化(杂)结构–细胞间腔隙WHO旺炽性增生florid hyperplasiaSchnitt 结构–细胞间腔隙结构 - 细胞间腔隙细胞 - 合体状Rosen细胞重叠、分界不清、合体状Schnitt细胞呈梭形,合体状Schnitt细胞呈梭形,流水状细胞形态多样,非纯化WHO 微乳头结构Schnitt细胞搭桥Schnitt TDLU内的UDHRosenUDH 伴有粉刺样坏死SchnittUDH 伴有坏死UDH 中有无肌上皮细胞成分?SMA calponinp63u 仅根据SMA 等肌上皮标记在导管增生性病灶中呈阴性表达就否定UDH 可能会导致误诊u UDH 偶尔表达p63Boecker ,J Pathol 2002绿色:SMA 红色:Ck8/18/19Note that the myoepithelial cells are not acomponent of the intraductal cell proliferation普通型增生Boecker :5 种细胞,即定向干细胞、腺中间细胞、腺上皮终端细胞、肌上皮中间细胞和肌上皮终端细胞仅表达高分子量CK ,如CK5/6仅表达CK8/18/19仅表达SMA 等表达CK5/6、CK8/18/19表达CK5/6、SMACK5/6UDH的增生细胞群确实含有多种成分,包括定向干细胞、腺中间细胞和腺终端细胞,但未发现具有肌上皮特点的细胞参与其中UDH ADHCK5/6DCIS DCISER染色UDH DCISWHO UDH DCIS UDHDCISADH 的传统诊断标准u 增生病灶出现低级别DCIS 的部分(不是全部)特征即可诊断ADH (不满足DCIS 定性标准)u 如果增生病灶具有低级别DCIS 的全部特征(包括细胞学和结构),只要不超过两个导管或大小不超过2mm ,也诊断ADH (不满足DCIS 定量标准)u 当诊断DCIS 有迟疑时则诊断ADHTavassoli :具有低级别DCIS 细胞学和结构特征的病变仅部分累及单个或多个导管非典型增生增生导管部分区域出现低核级DCIS 的特征Schnitt SchnittSchnitt• 变迁中的定量标准(ADH )- 1985 Page: < than 2 separate spaces (i.e., 1 space) - 1990 Tavassoli + Norris: < or = 2mm - 1998 Jensen and Page: 2-3mm - 2003 Page <4-5mm(2012 WHO :低级别DCIS 发生浸润性癌的时间间隔平均超过15年)• 多数情况下,是在TDLU受累以后使用• 仅测量形成充分的病灶• 病变导管呈纵切面时,不使用此标准SchnittSchnitt Koerner中等核级DCIS SchnittWHOADH是否存在分度(程度划分)?•完全受累(具有低核级DCIS特征),但范围小 - 重度•部分区域具有低核级DCIS特征,多病灶 - 中/重度•部分区域具有低核级DCIS特征,单病灶 - 轻/中度•导管内少数细胞具有纯化特征 - 轻度•如:borderline atypical d uctal hyperplasia / low-gradeductal carcinoma in situmarked ADH / severe ADH / extensive ADHfocal ADHRosen’ breast pathologySchnitt’ breast pathology2012 WHO易被误诊为浸润性癌的DCIS改变u DCIS的小叶癌化(lobular cancerization)u DCIS假浸润:纤维化导致DCIS形态不规则炎细胞浸润背景u DCIS出芽改变u DCIS累及腺病(硬化性、小管型、大汗腺型)和RS等u人工现象:如穿刺导致DCIS 细胞移位小叶癌化小叶癌化炎细胞浸润DCIS出芽改变貌似浸润癌的DCISHER2 DCIS假浸润DCIS假浸润DCIS假浸润DCIS累及腺病DCIS假浸润DCIS累及腺病穿刺导致DCIS细胞移位腺泡型浸润性小叶癌貌似DCIS 的癌栓特殊病例来自张祥盛老师女 38岁 左乳3cm肿物p63Calponin左腋窝淋巴结20/23、左侧锁骨下11/11有转移呈扩张性侵袭 / 膨胀性浸润的癌Bhargava, Dabbs缺乏肌上皮层的“DCIS”p63SMMHC病例p63ER ERPRPR病理诊断送检组织中查见癌,癌组织呈DCIS 形态,但部分肿瘤导管周围缺乏肌上皮层,不能排除其为呈膨胀性生长的浸润癌小 结• 乳腺DCIS 的病理诊断有章可循,但无绝对标准;诊断的主观性客观存在• 量化标准的运用• 基底型CK 的诊断价值• 真假浸润(包括DCIS 缺失肌上皮)致 谢u 华西医院病理科各位老师、同事!u 吴蕴 M.D. Anderson Cancer Center, USAu唐平 University of Rochester Medical Center, USA。

中国乳腺导管原位癌病理诊断共识(2022版)摘要乳腺导管原位癌具有独特的临床特征、组织形态学和分子特征。
本共识全面阐述了导管原位癌相关生物标志物的临床意义,旨在提高导管原位癌标本取材、病理评估以及相关检测的准确性和可重复性,从而促进导管原位癌病理报告内容的规范化,为临床治疗和预后评估提供可靠依据。
正文乳腺导管原位癌(ductaIcareinomainsitu,DCIS)是一种乳腺非浸润性上皮细胞恶性肿瘤,局限于导管-小叶系统,显示不同程度的结构异常和细胞核级。
在临床、影像、组织形态及基因改变上均具有异质性,有进展为浸润性癌的风险,但并非必然。
随着乳腺影像学检查的普及,DC1.S检出率明显增加,占所有新发乳腺癌的20%~25%°由于DC1.S生物学行为不一,给临床治疗带来挑战。
正确诊断DC1.S对于临床治疗方案的确定和患者预后的评估至关重要。
2016年中国乳腺原位癌诊疗共识专家组制定了《乳腺原位癌诊疗专家共识》,但目前还缺乏相应的中国乳腺DCIS病理诊断规范。
本共识由中华医学会病理学分会乳腺疾病学组、中国抗癌协会肿瘤病理专业委员会乳腺肿瘤学组和中国临床肿瘤学会肿瘤病理专家委员会组织编写,由病理医师和临床医师共同制定,涵盖DCIS标本取材、肿瘤生物标志物检测及病理诊断报告内容等各环节规范化操作要点,旨在使DC1.S的病理诊断更精准,为相关临床诊疗提供依据。
一、乳腺DCIS取材及切缘评估1.瘤床取材:手术科室应提供详细的临床病史和病理信息,包括病变解剖部位(左右侧及象限)、影像学检查结果、有无术前穿刺活检及病理诊断、有无乳腺癌病史和家族史等。
对于乳腺广泛切除或区段切除标本,外科医师应用缝合线或其他标志物作解剖学定位(如上、下、内、外侧)。
病理取材医师应涂染料标记切缘,并结合临床标记和影像学检查进行肿物定位,间隔5~10mm将整个标本平行切开,作好标记。
有条件的单位可对标本进行X线照相。
若病变区域的直径<5cm,建议全部取材;若病变区域的直径25cm,需间隔1Cm至少取材一块组织,有条件的单位尽可能更多取材。

乳腺硬化性腺病冰冻病理诊断分析乳腺硬化性腺病(Mammographic Sclerosing Adenosis,简称SA)是一种常见的乳腺疾病,也是乳腺透视的常见异常表现之一。
本文主要目的是通过冰冻病理诊断分析乳腺硬化性腺病的特点和诊断要点。
乳腺硬化性腺病是一种特征性的乳腺病理改变,主要由于乳腺管、管腔周围的腺体被大批成簇的纤维组织包围,并且出现较为明显的纤维化和增生。
该病变常见于乳腺导管周围的终末管腺体,特别是在乳腺的一侧或两侧中央部位。
乳腺硬化性腺病的临床特点主要有:乳房肿块、皮肤增厚、纤维性导管扩张及导管内白色或乳白色分泌物等。
乳腺硬化性腺病的冰冻病理诊断主要依靠镜下观察硬化性腺病的典型组织学特点。
一般情况下,冰冻切片的处理程序和方法与常规病理切片相似。
取得切除标本后,将其快速冷冻,制备成为薄片,并在显微镜下进行观察和分析。
而纤维化在冰冻切片中是易于辨认的,通常呈现出纤维组织的增生和包围导管的特点。
硬化性腺病的冰冻切片还可观察到管腔非典型增生的现象,其中大约三分之一的病例,其炎性因素也可能伴随其间。
乳腺硬化性腺病与乳腺纤维瘤在冰冻切片中有时很难鉴别。
不过,乳腺纤维瘤与硬化性腺病有明显的区别,主要体现在纤维瘤的纤维组织周围不包围导管。
乳腺硬化性腺病通常表现出更明显的纤维组织过度增生,而乳腺纤维瘤的纤维组织增生则较为轻微。
在冰冻切片的鉴别诊断过程中,我们应该结合患者的临床情况,全面分析病变,以获得准确的诊断结果。
乳腺硬化性腺病的冰冻病理诊断分析可以帮助我们了解该病变的组织学特点和临床意义,以便进一步指导临床治疗的选择和预后的评估。
通过冰冻病理诊断分析可以发现该病变与其他乳腺病变的区别和联系,提高对乳腺疾病的鉴别诊断能力,为临床工作提供更多的参考依据。


乳腺非典型导管上皮增生的病理学分类与随访观察策略引言乳腺非典型导管上皮增生是一种常见的乳腺疾病,它在女性中的发生率较高。
该疾病是乳腺癌的前期病变之一,因此对其进行及时的诊断与随访观察具有重要意义。
本文旨在详细介绍乳腺非典型导管上皮增生的病理学分类和随访观察策略。
乳腺非典型导管上皮增生的病理学分类乳腺非典型导管上皮增生是一种异形增生,其病理学分类主要包括以下几种类型:1. 非典型导管上皮增生非典型导管上皮增生是乳腺非典型增生的一种常见形式,它主要表现为导管内上皮的异型增生。
病理学上,非典型导管上皮增生的细胞形态与正常上皮相比较为异常,细胞核呈现出异型性和增生特征。
2. 非典型导管内乳头状瘤非典型导管内乳头状瘤是一种相对罕见但具有较高恶性潜能的乳腺非典型增生。
它主要表现为导管内乳头状结构的异常增生,并且伴有细胞核异型性和增生。
该病理类型的患者需要特别密切的随访观察。
3. 非典型导管泡瘤状增生非典型导管泡瘤状增生是一种与浸润性导管癌密切相关的乳腺非典型增生类型。
它主要表现为导管内乳头状结构的扩张和囊变,并且伴有导管细胞核的异型性和增生。
该类型病理学改变的存在提示了潜在的恶性转化风险。
乳腺非典型导管上皮增生的随访观察策略乳腺非典型导管上皮增生的随访观察策略主要包括以下几个方面:1. 临床随访观察对乳腺非典型导管上皮增生确诊患者需要定期进行临床随访观察,以及乳腺自我检查。
随访观察的频率根据患者的具体情况而定,通常建议每6个月进行一次随访。
2. 影像学检查建议对乳腺非典型导管上皮增生患者进行乳腺超声检查或乳腺MRI检查,以及每年进行一次乳腺X线摄影检查。
这些影像学检查有助于评估病变病理学特征的变化,并对病变是否恶变进行进一步的判断。
3. 组织学评估定期进行组织学评估是乳腺非典型导管上皮增生患者随访观察的重要环节。
通过穿刺活检或手术活检获取组织标本,进行细胞学或病理学检查,以了解病变的进展情况。
4. 个体化治疗策略根据每个乳腺非典型导管上皮增生患者的具体情况,制定个体化的治疗策略,包括手术切除、药物治疗等。



女性应慎防乳腺导管扩张症作者:孟昭群来源:《现代养生(上半月版)》 2021年第4期孟昭群在医院妇科门诊,年近五旬的贺女士向医生述说:“半年前,我的左侧乳房一直胀痛,且有红肿现象,摸起来有些硬,但我没有在意。
昨天洗澡时,左侧乳房挤出了黄色分泌物,我才害怕了,赶快来医院就诊。
”医生建议她做了彩超,超声显示:“左侧乳腺腺体增厚,回声增粗,导管可见扩张。
”医生告诉她得了乳腺导管扩张症。
贺女士十分担忧,这到底是什么病,会不会癌变呢?乳腺导管扩张症是一种并不少见的、良性的、病程冗长、病变复杂而多样化的慢性乳腺病,是非哺乳期的最常见的一种非细菌性炎症。
近年来,乳腺导管扩张症的发病率有上升的趋势,其发病年龄不等,少者则为20岁左右的青年女性,常以乳晕旁脓肿或乳晕旁瘘管而就诊;在31~40岁这一组属好发年龄,有乳晕下肿块、浆细胞性乳腺炎;发病高峰常见于年龄为50~60岁的中老年女性。
由于其临床表现复杂多变,易被误诊为乳腺癌。
目前有很多人,甚至有些外科医生都不认识这种病,误将其当作一般的小脓肿,反复多次做切开引流,伤口久不愈合,或反复红肿,自发破溃,形成瘘管,最后乳房千疮百孔,乳头内陷,扭曲变形,给患者造成很大的痛苦。
乳腺导管扩张症的病因目前尚不清楚,大多学者认为可能与以下几种因素有关:1.导管排泄障碍。
如先天性乳头畸形、凹陷、不洁或外来毛发、纤维等引起乳孔堵塞;导管发育异常,乳腺结构不良,导致上皮增生、炎症、损伤等引起导管狭窄、中断或闭塞;导管内分泌物积聚,导管排泄不畅,引起导管扩张。
另外,部分中老年妇女,由于卵巢功能减退,乳腺导管呈退行性变,管壁松弛,肌上皮细胞收缩力减退,导致导管内分泌物积聚而管腔扩张引起本病。
2.激素水平异常。
病人血中性激素水平异常,排卵前期血中雌二醇、黄体生成素水平低于正常,而泌乳素水平高于正常,异常的性激素刺激能促使导管上皮产生异常分泌,导管明显扩张。
一般来说,单有阻塞存在而无异常激素刺激促使上皮分泌,不致发生导管扩张。

针对乳腺导管良性病变的临床分析及钼靶X线特征研究【摘要】目的对乳腺导管良性病变的临床分析及钼靶x线特征研究。
方法资料选取我院接收的乳腺导管良性病变患者25例,检查中采用意大利的giotto智能乳腺机进行,常规加压进行乳房轴位和侧斜位摄片,对于乳头溢液患者必要的时候需要进行乳腺导管的造影检查,观察患者的钼钯x线平面表现和病理表现。
结果块影主要分布在乳晕和各个象限,共12例,块影直径在02cm-40cm之间,其中边缘不规则1例,边缘清10例。
发现导管内乳头状瘤5例,多发性2例,1例见异型细胞,单发性3例,无异型细胞。
导管扩张伴其他11例。
结论钼靶x线在检查乳腺导管内良性病变中实用性较高,有很高的临床价值。
【关键词】乳腺导管良性病变;钼靶x线;肿块doi:103969/jissn1004-7484(x)201309114文章编号:1004-7484(2013)-09-4955-01乳腺病在中年妇女中较为常见,且在近年其发病率不断升高,乳腺导管内良性病变在各种乳腺病中所占的比重在不断上升,其临床表现主要为肿块和乳头溢液。
采用钼靶x线能有效检查乳腺导管内病变,是当前临床中最常用的诊断方法。
本文对我院25例乳腺导管内良性病变患者的临床和影像资料做了分析,现报告如下:1资料与方法11一般资料资料选取我院接收的乳腺导管良性病变患者25例,左乳11例,右乳14例,所有患者均不是妊娠期妇女,均为单孔溢液。
患者平均年龄为24-64岁,平均年龄为(413±41)岁,病程为1-24个月,平均病程为54个月。
入院临床诊断中单纯性溢液16例,9例为肿块伴溢液,单纯性溢液中溢清水6例,血性溢液5例,浆液性溢液5例。
9例肿块伴溢液中4例为血性,5例为浆液性。
12方法检查中采用意大利的giotto智能乳腺机进行,常规加压进行乳房轴位和侧斜位摄片,对于乳头溢液患者必要的时候要需要进行乳导管的造影检查,具体方法如下:检查人员算作于患者面前,用手轻托患者乳房并向乳头中心挤压,当患者乳头出现溢液,则从溢液孔中插入针头,注入05ml40%的泛影葡胺,直到患者有胀痛感时拔出,然后进行摄片。

乳腺导管原位癌的病理特征及治疗原则前言乳腺导管原位癌是乳腺癌中最常见的一种类型,它是乳腺癌的早期病变,通常没有侵犯到周围组织。
然而,如果不及早发现和治疗,它可能会发展成为侵袭性乳腺癌。
本文将介绍乳腺导管原位癌的病理特征及治疗原则。
病理特征乳腺导管原位癌主要起源于乳腺导管内上皮细胞的异常增生,病理学上可分为非浸润性和浸润性两种类型。
非浸润性乳腺导管原位癌非浸润性乳腺导管原位癌又称为原位导管癌或非侵袭性导管癌。
其特征包括以下几个方面:1.导管细胞异常增生:病理学上可观察到乳腺导管内上皮细胞的非典型增生,细胞核变大,染色质增多,核分裂增多。
2.细胞核形态异常:细胞核的大小、形态、染色质分布等方面与正常细胞呈明显不同。
3.乳腺导管结构未破坏:非浸润性导管癌并不会破坏乳腺导管的正常结构,细胞异常只局限在导管内。
浸润性乳腺导管原位癌浸润性乳腺导管原位癌是非浸润性乳腺导管原位癌发展的一种进展性病变。
与非浸润性乳腺导管原位癌相比,其特征有所不同:1.导管壁浸润:肿瘤细胞能够破坏乳腺导管的基底膜,侵入周围的结缔组织,导致乳腺导管扩张和肿块形成。
2.恶性细胞浸润:肿瘤细胞也可进一步侵入血管和淋巴管,通过血液和淋巴系统扩散到远处器官和组织。
治疗原则乳腺导管原位癌的治疗原则主要包括手术切除和辅助治疗两个方面。
手术切除乳腺导管原位癌的首要治疗方法是手术切除肿瘤组织,确保彻底切除肿瘤,防止病变发展和恶化。
1.乳房保留手术:对于早期病变和小肿块,可考虑进行乳房保留手术,如乳腺部分切除术(lumpectomy)或乳腺切除术(mastectomy)。
2.乳房重建手术:对于乳腺切除术后的患者,可考虑进行乳房重建手术,恢复乳房形态和外观。
3.淋巴结检查:在手术中可能需要进行淋巴结检查,以确定是否存在淋巴结转移。
辅助治疗除手术切除外,乳腺导管原位癌的患者可能还需要接受一些辅助治疗来降低病变复发和转移的风险。
1.放疗:放疗是乳腺导管原位癌的常规辅助治疗方法之一,通过高能射线照射肿瘤区域,杀灭潜在的残留癌细胞。
乳腺导管内增生性病变35例病理观察及免疫表型分析裴文军【期刊名称】《临床医药实践》【年(卷),期】2008(017)B09【摘要】目的:探讨乳腺导管内增生性病变的形态学、免疫学特点、和乳腺浸润性癌的关系以及旺炽型普通导管增生、非典型导管增生和低级别导管内癌的鉴别诊断。
方法:①观察35例乳腺导管内增生性病变的形态学特点。
②对35例导管内增生性病变进行cK5/6、34DE12染色。
结果:乳腺增生病中UDH8ff0(53%),FEA1例(25%),ADH2例(29%),DICSO0例。
纤维腺瘤中UDH3例(20%),FEAO例,ADH1例(14%),DICSO0例。
浸润癌旁组织中UDH4例(27%),FEA3例(75%),ADH4例(57%),DICSO9例(100%)。
UDH中CK5/6阳性率93%、34βE12阳性率100%。
FEA中CK5/6阳性率25%、34βE12阳性率0。
ADH中CKS/6阳性率14%、34βE12阳性率0。
DICS中CK5/6、34β E12全部阴性。
结论:DICS、ADH、FEA和乳腺浸润性癌关系密切,绝大多数导管内增生性病变的病理诊断形态学就可完成,CK5/6和34β E12对鉴别诊断具有重要作用。
【总页数】3页(P666-668)【作者】裴文军【作者单位】新疆哈密吐哈石油医院病理科,839009【正文语种】中文【中图分类】R737.9【相关文献】1.乳腺导管内增生性病变35例病理观察及免疫表型分析 [J], 裴文军2.67例眼眶淋巴组织增生性病变病理学与免疫表型分析 [J], 黄宗明;于媛媛;李友红3.16例乳腺导管内增生性病变病理观察及分析 [J], 贾东明4.乳腺导管内增生性病变的免疫表型分析 [J], 朱鸿;徐钢;李科;宋林红5.乳腺导管内增生性病变118例的临床病理及免疫表型分析 [J], 景红;吴江因版权原因,仅展示原文概要,查看原文内容请购买。
宁夏地区女性乳腺癌流行因素研究
蔡生荣
【期刊名称】《宁夏医学杂志》
【年(卷),期】1996(000)001
【摘要】本文对宁夏医学院附院肿瘤外科1992年6月 ̄1995年元月收治的宁夏地区100例女性乳腺癌患者进行病例对照研究,1:1配对,年龄24 ̄69岁,采秀单因素分析。
发现本地区乳癌与初潮年龄早、月经周期短、绝经晚、乳腺增生、初次足月妊娠年龄晚、身体肥胖、高动物蛋白、高脂肪饮食有关,本研究未显示哺乳、口服避舀药和乳癌家族史增加乳癌发生的危险性。
【总页数】1页(P1)
【作者】蔡生荣
【作者单位】不详;不详
【正文语种】中文
【中图分类】R737.901
【相关文献】
1.宁夏地区女性乳腺癌危险因素的病例对照研究 [J], 张宏;余建军;刘兰;张鹏举;倪文思
2.2017年宁夏地区牛流行热血清流行病学调查 [J], 尹才;高闪电;马龙;王玉梅;张成莲;周海宁;李知新;王晓亮
3.粤东地区女性乳腺癌患者一级亲属早期筛查行为现状及相关因素研究 [J], 方霭玲; 郑秀勇; 郭小曼
4.中青年女性乳腺癌患者术后抑郁的危险因素研究 [J], 廖彦萍
5.女性乳腺癌流行病学趋势及危险因素研究进展 [J], 张雪;董晓平;管雅喆;任萌;郭冬利;贺宇彤
因版权原因,仅展示原文概要,查看原文内容请购买。