空气的气液相平衡
- 格式:doc
- 大小:159.00 KB
- 文档页数:12



4.2气液相平衡关系本节教学要求1、重点掌握的内容:相平衡的影响因素及相平衡关系在吸收过程中的应用;2、熟悉的内容:溶解度、平衡状态、平衡分压、亨利定律。
4.2.1 相组成表示方法1.质量分率与摩尔分率质量分率:质量分率是指在混合物中某组分的质量占混合物总质量的分率。
对于混合物中的A 组分有mm w A A = (4-1) 式中 A w ——组分A 的质量分率;A m ——混合物中组分A 的质量,kg ;m ——混合物总质量,kg 。
1N B A =⋅⋅⋅++w w w (4-2)摩尔分率:摩尔分率是指在混合物中某组分的摩尔数n A 占混合物总摩尔数n 的分率。
对于混合物中的A 组分有 气相:nn y A A = (4-3) 液相:n n x A A =(4-4) 式中 A y 、A x ——分别为组分A 在气相和液相中的摩尔分率;A n ——液相或气相中组分A 的摩尔数,n ——液相或气相的总摩尔数。
1N B A =⋅⋅⋅++y y y (4-5) 1N B A =⋅⋅⋅++x x x (4-6) 质量分率与摩尔分率的关系为:NN B B A A A A x /M w /M w /M w /M w A ⋅⋅⋅++= (4-7) 式中 B A M M 、——分别为组分A 、B 的分子量。
2.摩尔比摩尔比是指混合物中某组分A 的摩尔数与惰性组分B (不参加传质的组分)的摩尔数之比,其定义式为BA A n n Y = (4-8)B A A n n X =(4-9) 式中 A Y 、A X ——分别为组分A 在气相和液相中的摩尔比;摩尔分率与摩尔比的关系为XX x +=1 (4-10) YY y +=1 (4-11) -x x X 1= (4-12) -yy Y 1= (4-13) 【例5-1】 在一常压、298K 的吸收塔内,用水吸收混合气中的SO 2。
已知混合气体中含SO 2的体积百分比为20%,其余组分可看作惰性气体,出塔气体中含SO 2体积百分比为2%,试分别用摩尔分率、摩尔比和摩尔浓度表示出塔气体中SO 2的组成。


空气与水的气液平衡原理空气与水的气液平衡原理是指当水与空气接触时,两者之间会发生物质的传递和平衡,从而形成水体和大气中溶解气体浓度的关系。
这种平衡是通过溶质的扩散、吸附和脱附等过程实现的。
本文将详细介绍空气与水的气液平衡原理。
首先,我们来了解一下气体溶解于液体中的基本原理。
气体分子在液体中溶解的过程可以分为三个主要步骤:气体分子通过扩散进入液体,然后逐渐与液体分子间相互作用,最后被液体吸附或反应生成新的物质。
这一过程受到温度、压力、液体性质等因素的影响。
在空气与水的气液平衡中,空气中的气体会溶解于水中。
气体溶解水的量可由亨利定律描述:在一定温度下,气体与溶液之间的溶解度(溶解质的浓度)与该溶质的分压成正比。
即溶解度与溶液中所含有的该气体分子的压力呈线性关系。
此外,温度也是空气与水的气液平衡中的重要因素。
一般情况下,温度升高会导致溶解度降低,即在相同的压力下,高温下水对气体的溶解度会较低。
这是因为温度增加会使液体分子的热运动加剧,分子之间的吸引力减弱,从而使气体分子与液体分子之间的作用力减小,溶解度降低。
除了温度和压力,溶解质本身的特性也会对气体在水中的溶解度产生影响。
溶解度与溶质的等值、溶质-溶剂分子之间的作用力、溶质分子的大小和形状以及液相中其他溶质的有无等因素相关。
在大气和水的气液平衡中,还存在气体在水体中的分布和传输过程。
大气中的气体通过扩散作用进入水体,形成溶解气体。
溶解气体在水体中可以通过对流、扩散和水体的混合转移。
此外,气体还可以通过化学反应与水体中的其他物质发生作用而在水体中转化。
总的来说,空气与水的气液平衡是通过气体分子在液体中的溶解和由溶质分子向气相的扩散、吸附、脱附等过程实现的。
这种平衡受到温度、压力、液相特性、溶质间相互作用等因素的影响。
了解和研究空气与水的气液平衡原理对于理解环境和大气污染、水体健康与污染以及气候变化等问题具有重要意义。

液体饱和蒸汽压的测定【摘要】本实验根据克拉贝龙-克劳修斯方程,运用动态法研究环己烷的饱和蒸气压与温度的关系,并计算其摩尔汽化热。
在实验中了解了真空泵、气压计的使用方法及注意事项。
【关键词】饱和蒸气压 摩尔汽化热 动态法 克拉贝龙-克劳修斯方程 一、前言本实验研究的是单组分体系气-液相平衡:定温下把液体放在真空容器中,液体开始蒸发变成气体态,气态物质又可重新回到液体中。
达到平衡时,通过液体表面进出的分子数相等,定温下液体与其自身的蒸气达到平衡时的蒸气压就是液体的饱和蒸气压;蒸发1摩尔液体需要吸收的热量即为该温度下液体的摩尔汽化热∆H ;饱和蒸汽压与摩尔汽化热之间的关系可以用克拉贝龙-克劳修斯方程表示:d d v a p m l n p T H R T =∆2当液体与外界大气压相通,并且液体的饱和蒸气压与外界压强相等时,液体沸腾,此时的温度称为沸点.沸点是随着外压的改变而变化的。
若温度改变的区间不大,∆H 可视为为常数。
积分上式得:ln 'P A HRT =-∆或 lo g P A BT=-常数A A ='.2303,B H R =∆vap m 2303..log P 与1T 有线性关系。
作图可得一直线,斜率为-B 。
因此可得实验温度范围内液体的平均摩尔汽化热∆H 。
∆v a p mH R B =2303. 本实验采用的是在不同外部压力下测定液体沸点的动态法。
即测量多组不同气压下的沸点,并通过直线拟和计算出纯水的摩尔汽化热。
本实验操作较为复杂,应注意保证体系中不要混入空气,以免影响实验结果。
二、实验部分(一)仪器DTC-2AI控温仪南京南大万和科技有限公司WYB-I型真空稳压包南京南大万和科技有限公司U型压力计江苏省常州市东风仪表厂JJ-1型增力电动搅拌器江苏省金坛市环宇科学仪器厂1/10℃温度计福廷式压力计平衡管(二)药品环己烷液体(三)操作步骤1)装置概述平衡管由三个相连通的玻璃球构成,顶部与冷凝管相连。

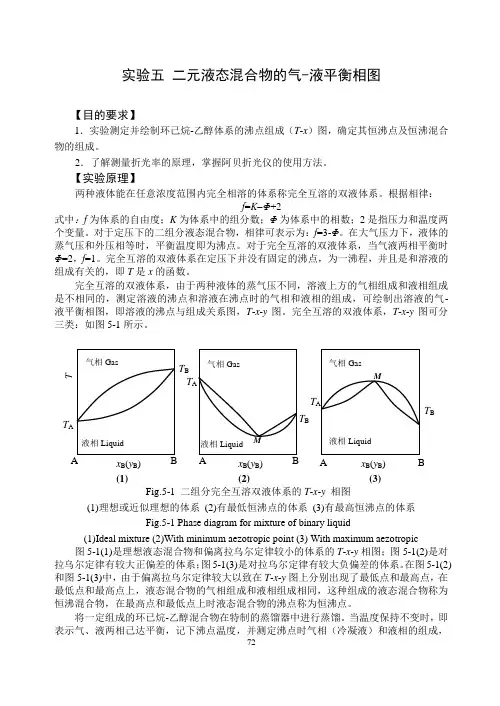
实验五 二元液态混合物的气-液平衡相图【目的要求】1.实验测定并绘制环己烷-乙醇体系的沸点组成(T -x )图,确定其恒沸点及恒沸混合物的组成。
2.了解测量折光率的原理,掌握阿贝折光仪的使用方法。
【实验原理】两种液体能在任意浓度范围内完全相溶的体系称完全互溶的双液体系。
根据相律:f =K Φ+2式中:f 为体系的自由度;K 为体系中的组分数;Φ为体系中的相数;2是指压力和温度两个变量。
对于定压下的二组分液态混合物,相律可表示为:f =3-Φ。
在大气压力下,液体的蒸气压和外压相等时,平衡温度即为沸点。
对于完全互溶的双液体系,当气液两相平衡时Φ=2,f =1。
完全互溶的双液体系在定压下并没有固定的沸点,为一沸程,并且是和溶液的组成有关的,即T 是x 的函数。
完全互溶的双液体系,由于两种液体的蒸气压不同,溶液上方的气相组成和液相组成是不相同的,测定溶液的沸点和溶液在沸点时的气相和液相的组成,可绘制出溶液的气-液平衡相图,即溶液的沸点与组成关系图,T -x -y 图。
完全互溶的双液体系,T -x -y 图可分三类:如图5-1所示。
图5-1(1)是理想液态混合物和偏离拉乌尔定律较小的体系的T -x -y 相图;图5-1(2)是对拉乌尔定律有较大正偏差的体系;图5-1(3)是对拉乌尔定律有较大负偏差的体系。
在图5-1(2)和图5-1(3)中,由于偏离拉乌尔定律较大以致在T -x -y 图上分别出现了最低点和最高点,在最低点和最高点上,液态混合物的气相组成和液相组成相同,这种组成的液态混合物称为恒沸混合物,在最高点和最低点上时液态混合物的沸点称为恒沸点。
将一定组成的环已烷-乙醇混合物在特制的蒸馏器中进行蒸馏。
当温度保持不变时,即表示气、液两相己达平衡,记下沸点温度,并测定沸点时气相(冷凝液)和液相的组成,Fig.5-1 二组分完全互溶双液体系的T -x -y 相图 (1)理想或近似理想的体系 (2)有最低恒沸点的体系 (3)有最高恒沸点的体系 Fig.5-1 Phase diagram for mixture of binary liquid(1)Ideal mixture (2)With minimum aezotropic point (3) With maximum aezotropic 液相Liquid 气相Gas T B x B (y B ) (3) M A B液相Liquid气相Gas T A T B x B (y B ) T (1) AB 液相Liquid 气相Gas T A T Bx B (y B ) (2) M A B T A图5-2 沸点仪示意图 1.温度计;2.接加热器;3.加液口;4.电热丝连接点;5.电热丝;6.分馏液;7.分馏液取样口 Fig.5-2 The sketch of ebulliometer 1.thermometer;2. connection pole;3. inlet orifice; 4. connection point of heater with wire;5.heater; 6. fractional liquid;7. sampling orifice 即可得到一组T -x -y 数据。

气液两相处于平衡时的特征
气液两相处于平衡时,是指气体和液体两种物质在一定条件下达到平衡状态,
不再有净的物质转化或迁移的过程。
在这种平衡状态下,气相和液相之间存在一系列特征,这些特征对于理解和应用气液平衡有着重要的意义。
首先,气液两相在平衡时具有相同的化学势。
化学势是描述物质在平衡状态下
参与反应或转化的趋势的物理量,气液两相达到平衡时,化学势相等是平衡状态的必然结果。
这一特征表明在平衡状态下,气相和液相之间的物质转化趋势达到平衡,体现了平衡态的稳定性。
其次,气液两相平衡时的温度、压力和化学组分之间存在着一定的关系。
根据
气相和液相的性质,气液平衡的温度和压力条件可以通过平衡常数或者化学反应的热力学公式来确定。
这种关系可以帮助我们在实际应用中准确地控制气液平衡的条件,实现气液相平衡的控制和调节。
此外,气液两相平衡时,气相和液相的物理性质也会发生一些特殊的变化。
比如,气相和液相的密度、粘度、热容等物理性质在平衡状态下可能会发生变化,这些变化对于气液平衡的稳定性和性质有着重要的影响。
理解和掌握气液平衡时的物理性质变化,有助于我们更好地理解和应用气液平衡的原理。
总的来说,气液两相处于平衡时的特征涉及到化学势的平衡、温度、压力和化
学组分的关系,以及气液两相的物理性质的变化等方面。
通过深入研究和理解气液平衡的特征,我们可以更好地应用气液平衡的理论和原理,实现气液相平衡的控制和调节,为气液相平衡的研究和应用提供理论和实践基础。

汽液平衡数据的测定汽液平衡数据是最常用的化工基础数据。
许多化工过程如精馏的设计、操作及过程控制等都离不开汽液平衡数据。
有热力学研究方面,新的热力学模型的开发,各种热力学模型的比较筛选等也离不开大量精确的汽液平衡实测数据。
现在,各类化工杂志每年都有大量的汽液平衡数据及汽液平衡测定研究的文章发表。
所以汽液平衡数据的测定及研究深受化工界人士的重视一、实验目的:通过测定常压下乙醇—水二元系统汽液平衡数据的实验,使同学们了解、掌握汽液平衡数据测定的方法和技能,熟悉有关仪器的使用方法,将课本上学到的热力学理论知识与实际运用有机地联系在一起。
从而既加深对理论知识的理解和掌握,又提高了动手的能力。
二、汽液平衡测定和种类:由于汽液平衡体系的复杂性及汽液平衡测定技术的不断发展,汽液平衡测定也形成了特点各异的不同种类。
按压力分,有常减压汽液平衡和高压所液平衡测定。
高压汽液平衡测定的技术相对比较复杂,难度较大。
常减压汽液平衡测定则相对较易。
按形态分,有静态法和动态法。
静态法技术相对要简单一些,而动态法测定的技术要复杂一些但测定较快较准。
在动态法里又有单循环法和双循环法。
双循环法就是让汽相和液相都循环,而单循环只让其中一相(一般是汽相)循环。
在一般情况下,常减压汽液平衡都采用双循环,而在高压所液平衡中,只让汽相强制循环。
循环的好处是易于平衡、易于取样分析。
根据对温度及压力的控制情况,有等温法与等压法之分。
一般,静态法采用等温测定,动态法的高压汽液平等多采用等温法。
总之汽液平衡系统特点各异,而测定的方法亦丰富多彩。
本实验采用的是常压下(等压)双循环法测定乙醇—水的汽液平衡数据。
三、实验原理:以循环法测定汽液平衡数据的平衡釜有多种形式,但基本原理是一样的。
如图书馆所示,当体系达到平衡时,A 和B 两容器中组成不随时间布景为化,这时从A 和B 两容器中取样分析可以得到一组汽液平衡实验数据。
根据下平衡原理,当所液两相达到相平衡时,汽液两相温度压力相等,同时任一组分在各相中的逸度相等,即:v L i i f f =))这里 v v i i i f y P =Φ)) 0L i i i i f r x f =))对低压汽液平衡,其汽相可以视为理想气体混合物,即1v i Φ=),忽略压力对液体逸度的影响,即0i i f P =),从而得出低压下汽液平衡关系式:i i i i Py r x P =式中 P ——体系压力(总压)i P ——纯组分i 在平衡温度下的饱合蒸汽压。
图5-1第五章空气的精馏5.1空气的精馏5.1.1气液相平衡每种聚集态内部均匀的部分,称之为相。
相的内部达到平衡时,宏观物理化学性质均匀一致。
当两相接触时,物质从一相迁移到另一相中去的过称叫相变,比如:蒸发、冷凝、溶解、结晶、凝固、升华等,都属于相变。
在相变过程中,当宏观上物质迁移过程停止时候的状态,叫相平衡。
如图5-1中,在一个密闭容器中,随着液体蒸发,液面上的气体分子逐渐增多,蒸气压力也不断升高。
由于蒸气分子在空间不断作无规则运动,相互碰撞,其中一部分蒸汽分子接近液面,被液相分子吸引,重新凝结回液相。
蒸气压力越升高,凝结回液相的蒸气分子越增多。
当到达某一时候,微观上蒸发的分子数与凝结的分子数相等。
气相和液相的分子数量不再发生变化,容器中的液相与液面上的气相建立了平衡,称之为气液相平衡。
气液相平衡时,整个气液系统处于恒定的压力和温度之下,各部分状态参数将保持不变。
气液相平衡状态下,液面上方的蒸气叫饱和蒸气,饱和蒸气对应的压力称为饱和气压,相对应的温度叫饱和温度,也叫沸点。
一旦压力或温度发生了变化,原来的气液相平衡就被打破,宏观上蒸发和冷凝将继续进行,直到在新的条件下重新建立起平衡。
图5-2是氧、氮、氩的饱和蒸气压与温度的关系曲线。
在同一温度下,即在图中作一条垂线,饱和蒸气压越高,表明该物质越容易气P(Mpa)0.10.0111050100140T (K )图5-2N 2ArO 21008060402010080604020图5-3化,亦即“易发挥”。
相同温度下,氮的饱和蒸气压总是大于氧,氮相对于氧就是易挥发组分,氧是难挥发组分,氩介于氧、氮之间。
液态的氧和氮可以任何比例均匀混合,空气的主要组分是氧和氮,所以液态空气通常可称为氧、氮二元系混凝土合溶液。
图5-3表示不同压力下氧在液空溶液气相和液相的平衡含量的关系。
在98Kpa 绝对压力下,含有21%氧的液空上方的空气中仅含6.3%氧气;如图A 点;如使气相氧含量达到21%,则液相中氧含量达到52%,从图中可以看出,氧氮混合溶液中,液相氧浓度总是大于气相氧浓度,因此,气相氮浓度也总是大于液相氮浓度。
实验五双液系的气液平衡相图摘要:完全互溶双液系的饱和蒸汽压与体系的组成有关,当完全互溶双液系的饱和蒸汽压与外界大气压相等时液体沸腾,通常用几何作图的方法将双液系的沸点对其气相、液相组成作图,所得图形称为双液系T-x相图,在一定温度下还可画出体系的压力P与组成的P-x 关系图,液体组成可以用阿贝折射仪来测量,沸点仪用来测得气液两相的平衡温度。
关键词:沸点,完全互溶双液系,阿贝折射仪,调压变压器T-x相图,P-x关系图。
前言:用沸点仪和阿贝折射仪确定其最低恒沸点温度及恒沸混合物的组成。
用折光率确定双组分体系的组成,据此作出一个大气压下水——正丙醇双液系的气液平衡相图,并且确定其最低恒沸点温度及恒沸混合物的组成。
实验原理:在常温下,两液态物质混合而成的体系称为双液系。
两液体若只能在一定比例范围内互相溶解,称为部分互溶双液系,若两液体能以任意比例相互溶解,则称为完全互溶双液系。
例如:苯-乙醇体系,正丙醇-水体系,环己烷—乙醇体系都是完全互溶双液系,苯-水体系则是部分互溶双液系。
液体的沸点是指液体的蒸气压与外压相等时的温度。
在一定的外压下,纯液体的沸点有确定的值。
但对于双液系来说,沸点不仅与外压有关,而且还与双液系的组成有关,即与双液系中两种液体的相对含量有关。
双液系在蒸馏时具有另一个特点是:在一般情况下,双液系的气相组成和液相组成并不相同。
因此原则上有可能用反复蒸馏的方法,使双液系中的两液体互相分离。
通常用几何作图的方法将双液系的沸点对其气相、液相组成作图,所得图形称为双液系T-x相图,在一定温度下还可画出体系的压力P与组成的P-x关系图。
完全互溶双液系在恒定压力下的气液平衡相图可分为三类:如果溶液与拉乌尔定律的偏差不大,在T—x图上,溶液的蒸汽压和沸点介于A,B两纯组分蒸汽压及沸点之间,如甲苯-苯体系(图5-1)所示,为第一类。
实际溶液由于A—B两组分的相互影响,常与拉乌尔定律有较大的偏差。
在T—X图上可能有最低和最高点出现。
第八章习题气液相平衡1.在盛水的鼓泡吸收器中通入纯CO2气,经长期接触后测得水中CO2的平衡溶解度为2.857×10-2mol/L溶液。
鼓泡器中的总压为101.3kPa,水温30℃,溶液的密度ρm=996kg/m3。
求亨利系数,并将此实验值与文献值E=188.5MPa作比较。
2.惰性气与CO2的混合气中含CO230% (体积百分数),在1MPa(表压)下用水吸收。
设吸收塔底水中溶解的CO2达到饱和,此吸收液在膨胀槽中减压至20kPa(表压),放出大部分CO2,然后再在解吸塔中吹气解吸。
设全部操作范围内水与CO2的平衡关系服从亨利定律,操作温度为25℃。
求1kg水在膨胀槽中最多能放出多少kgCO2气。
习题1 附图习题2附图3.20℃的水与N2气逆流接触以脱除水中溶解的O2气。
塔底入口的N2气中含氧0.1% (体积),设气液两相在塔底达到平衡,平衡关系服从亨利定律。
求下列两种情况下水离开塔底时的最低含氧量。
以mg/m3水表示。
(1)操作压强为101.3kPa(绝对)。
(2)操作压强为40kPa(绝对)。
4.气液逆流接触的吸收塔,在总压为101.3kPa下用水吸收Cl2气,进入塔底的气体混合物中含氯1%(体积),塔底出口的水中含氯浓度为x=0.8×10-5(摩尔分率)。
试求两种不同温度下塔底的吸收推动力,分别以(x e-x)及(y-y e)表示。
(1)塔底温度为20℃。
(2)塔底温度为40℃。
5.某逆流吸收塔塔底排出液中含溶质x=2×10-4(摩尔分率), 进口气体中含溶质2.5%(体积),操作压强为101kPa。
气液平衡关系为y=50x。
现将操作压强由101kPa增至202kPa,问塔底推动力(y-y e)及(x e-x)各增加至原有的多少倍。
扩散与相际传质速率6.柏油马路上积水2mm,水温20℃。
水面上方有一层0.2mm厚的静止空气层,水通过此气层扩散进入大气。
大气中的水汽分压为1.33kPa。
空气的气液相平衡
(一)空气的组成
空气是一种均匀的多组分混合气体,它的主要成分是氧、氮和氩,此外还含有微量的氢及氖、氦、氪、氙等稀有气体。
根据地区条件的不同,空气中含有不定量的二氧化碳、水蒸气以及乙炔等碳氢化合物,空气的组成及各成分的沸点示于第8章表8-2中。
(二)空气的二元系气液平衡
1.气液平衡及氧、氩、氮饱和压力和温度的关系
在气液平衡条件下,各相的状态参数保持不变,它们的温度、压力都分别相等,这时的温度称饱和温度,压力称饱和蒸气压力。
纯物质在一定的压力下对应着唯一的饱和温度,或在一定的温度下对应有唯一的饱和压力。
图9-1示出氧、氩、氮纯物质在气液平衡时,饱和压力与温度之间的关系。
图9-1
由图知,氧、氩、氮在同一温度下具有不同的饱和蒸气压力,这是由于它们的分子结构和分子间的引力不同所致。
在同一温度
下饱和蒸气压的大小,表明了液体气化的难易程度。
饱和蒸气压大的物质容易由液体变为蒸气,反之,饱和蒸气压小的物质不易由液体变为蒸气。
在相同的温度下,氮的饱和蒸气压高于氧的饱和蒸气压,而在相同的压力下,氮的饱和温度低于氧。
氩则介于氧、氮之间。
2.氧-氮二元系的气液平衡压力、温度、比焓与成分的关系
氧-氮二元系气液平衡关系可用相平衡图表示。
相平衡图是按用实验方法求得的温度,压力,比焓及摩尔分数
之间的关系绘制。
常用的几种平衡图如下:图9-2
(1) 图
如图9-2所示,图中的每组曲线是在等压下作出的,纵座标表示温度,横座标表示氧的摩尔系数(x及y),对应于每一个压力都有一组气液相平衡曲线(称鱼形曲线,曲线中的压力数值单位是105Pa)。
以任一组曲线为例,上面的一条线称冷凝等压线,它表示在给定的压力下,与液相平衡的气相
组成与温度的关系,又称气相线;下面的一条线称沸腾等压线,它表示在给定压力下,与气相平衡的液相组成与温度的关系,又称液相线。
在气相线与液相线之间的区域称湿蒸气区。
曲线的两端点的纵座标分别表示纯氧和纯氮在该压力下的饱和温度。
由T-x-y 图我们可看出氧-氮二元溶液有以下特点:(1)气相中氧的摩尔分数为30~40%时,相平衡的气液的摩尔分数差最大,增加或减少气相中的含氧量时,气液摩尔分数差都减小,这表明当气相(或液相)中的含氧(或含氮)量愈少时愈难分离。
(2)压力越低,液相线与气相线的间距越大,即气液相间的摩尔分数差越大,这说明在低压下分离空气较在高压下分离容易。
(3)气液平衡时,液相中的氧摩尔分数大于气相中的氧摩尔
分数,气相中的氮摩尔分数大于液相中的氮摩尔分数。
(4)当压力一定时,溶液中低沸点组分的摩尔分数愈大,它的蒸发温度和冷凝温度愈低。
表9-5表示氧-氮气液平衡的温度T、压力p和摩尔分数y3、x3的关系。
表中为
液体中氮的摩尔分数;为气体中氮的摩尔分数;
表9-6为氩-氮气液平衡的温度T,压力p和摩尔分数y3、x3的关系。
表9-7为氧-氩气液平衡数据,表中为液体中氩的摩尔分数;为气体中氮的摩尔分数;
(2)图
图9-3所示为氧-氮二元系在不同压力下的图,它的横座标为溶液中氮的摩尔分数,用x表示,纵座标为与液体相平衡的气相中氮的摩尔分数,用y表示。
图中每一条曲线表
示图示压力下的关系。
在不同的压力下有不同的平衡曲线。
由此图可以看出在不同压力下氮的气相及液相中的浓度之间的关系。
此图可根据表9-5数据制作。
图9-4为氧-氩二元系在
p=133.3kPa下的图,可见气液平
衡时,差值比氧氮的浓度差值小得多,所以氧氩分离较难。
图9-3,图9-4
二元溶液的比焓,前面已有介绍,即气态的比焓不计溶解热、按纯组分的分数加和,但纯组分的比焓与溶液有相同温度和相同压力。
液态溶
液的比焓,对氧、氮、氩等组分的混合物不计溶解热,所以液态部分的等温线(在图上)也是直线。
由于压力对液体的比焓影响小,特别当压力较低时,所以液相区等温线适用各不同压力。
(三)空气的三元系气液平衡
1. 氧-氩-氮三元系气液平衡图
三元系的气液平衡关系,可根据实验数据表示在相平衡图上。
相平衡图一般有两种表示方法:三角形摩尔分数和直角座标摩尔分数表示法。
在三元系中分别以
代表氧、氩、氮气相及液相
摩尔分数。
图9-5为氧-氩-氮三元系的平衡图,该图是在定压下作出的,纵座标为气相中的氩摩尔分数,横座标为气相中氧摩尔分数,图中有和T的三组等值曲线。
在这个图
上按已知液相组成可求出与之平衡的气相
组成,反之按已知气相组成也可求得液相组成,并能确定平衡温度,由于三角形图使用不方便,不准确,故目前设计中多使用直角座标气液平衡图。
图9-5横座标是氧氮气液平衡关系,纵座标是氩氮气液平衡关系,斜边是氩氧平衡关系,压力为p=133.3kPa,按相同方法也可作得其他压力下的三元图。
图9-6是氧-氩-氮图在
p=133.3kPa压力时,横座标为液体中氧摩尔分数,纵座标为温度,表示三元混合物饱
和液体浓度与温度的关系。
图9-5 氧-氩-氮三元系平衡图 p=133.3kPa
图9-5 氧-氩-氮T-x1图 p=133.3kPa 直角座标图如图9-6所示。
图在左边为带有等氩摩尔分数线的氧的图,右边为
带有等氧摩尔分数线的氩的图。
通过该
图可由已知液相摩尔分数查得平衡气相摩
尔分数,或者根据气相摩尔分数查得平衡液相摩尔分数。
例如已知气相摩尔分数,,
压力为133.3kPa,则在图9-6横座标上找到
的读数,由此作垂线与氩的等摩尔分数
相交于一点,由此点作水平线,与纵
座标交于,即为平衡液相中的氧摩尔分数。
同样方法,在右图横座标上找到的
读数,由此作垂线,与氧的等摩尔分数线
交于一点,由此交点作水平线,与纵座标交于,即为平衡液相中的氩摩尔分数。
反之
如果已知液相中摩尔分数为,亦可由该平衡图查出与之平衡的气相摩尔分数。
三元平衡气液的比焓与二元相似,气体和液体混合物溶解热均忽略不计,液体比焓
----- 纯组分液体比焓,与溶液温度相同,
;
----- 液体摩尔分数。
气体混合物比焓为,
----- 与混和气体相同温度、压力的纯组分
气体比焓,;
----- 气体摩尔分数。
图9-6。