具有新型核心结构的肽类BACE1抑制剂的设计、合成及活性评价
- 格式:pdf
- 大小:376.23 KB
- 文档页数:6


第62卷 第1期吉林大学学报(理学版)V o l .62 N o .1 2024年1月J o u r n a l o f J i l i nU n i v e r s i t y (S c i e n c eE d i t i o n )J a n 2024d o i :10.13413/j .c n k i .jd x b l x b .2023170新型靶向αv β6多肽的设计㊁合成与亲和力评价李跃鹏,王远强(重庆理工大学药学与生物工程学院,重庆400054)摘要:通过计算机辅助药物设计策略及固相合成法设计并筛选具有全新结构的αv β6多肽配体,并用酶联免疫吸附法(E L I S A )测定多肽配体与αv β6的结合亲和力,建立αv β6多肽配体的筛选方案.首先用S y b y l -X 1.3对αv β6多肽配体及天然配体进行分子对接;其次用A m b e r 16对分子对接结果进行分子动力学模拟,确定多肽配体与αv β6蛋白之间的结合模式,并以R G D L X X L (X 为任意氨基酸)为多肽配体核心结构,通过逐步延伸氨基酸构建虚拟肽库,筛选获得长度为7~10个氨基酸的多肽配体,进一步通过相似氨基酸替换的方法设计筛选不同于R G D L X X L 核心的新的多肽配体;最后用固相合成法合成新设计的多肽配体,利用间接E L I S A 法测定多肽配体-αv β6的结合亲和力.已有多肽配体和天然配体的分子对接以及分子动力学模拟结果表明,αv β6与配体的结合主要通过A s p 218和多肽配体之间形成氢键,以及M g 2+和多肽配体形成金属螯合作用完成.结合虚拟组合筛选与相似氨基酸替换,发现G R T D L G T L L F R ,G R R T D L A T I H G ,R T D V G R V R G R G 和R G D V G R V G R 等多肽均满足该结合模式,R T D V G R V R G R G 与αv β6的亲和力为10.76μm o l /L .可见R T D V G R V R G R G 与αv β6亲和力良好,是一条全新的αv β6多肽配体.关键词:整合素αv β6;多肽配体;药物设计;亲和力;酶联免疫吸附法中图分类号:R 914.2 文献标志码:A 文章编号:1671-5489(2024)01-0181-08D e s i g n ,S y n t h e s i s a n dA f f i n i t yE v a l u a t i o no f N o v e l T a r g e t e d αv β6P o l y p e p t i d e s L IY u e p e n g ,WA N G Y u a n q i a n g(S c h o o l o f P h a r m a c y a n dB i o e n g i n e e r i n g ,C h o n g q i n g U n i v e r s i t y o f T e c h n o l o g y ,C h o n g q i n g 400054,C h i n a )收稿日期:2023-05-02.第一作者简介:李跃鹏(1997 ),男,汉族,硕士研究生,从事药物设计和生物信息学的研究,E -m a i l :l i y u e p e n g l m c @f o x m a i l .c o m.通信作者简介:王远强(1979 ),男,汉族,博士,教授,从事靶向药物筛选与评价和多肽抗菌药物开发的研究,E -m a i l :w a n g y q n n @c q u t .e d u .c n .基金项目:重庆市科学技术局自然科学基金(批准号:C S T B 2022N S C Q -M S X 1327)和重庆市人力资源和社会保障局留学人员回国创业创新支持计划项目(批准号:c x 2020012).A b s t r a c t :W e d e s i g n e d a n ds c r e e n e d αv β6p o l y p e p t i d e l i g a n d sw i t hn e ws t r u c t u r eb y u s i n g c o m p u t e r -a i d e dd r u g d e s i g ns t r a t e g y a n ds o l i d -p h a s es y n t h e s i s m e t h o d ,a n dd e t e r m i n e dt h eb i n d i n g a f f i n i t y b e t w e e n t h e p o l y p e p t i d e l i g a n d s a n d αv β6b y u s i n g e n z y m e -l i n k e d i mm u n o s o r b e n t a s s a y (E L I S A )t o e s t a b l i s ha s c r e e n i n g s c h e m e f o r αv β6p o l y p e p t i d e l i g a n d s .F i r s t l y ,S y b y l -X1.3w a su s e d t o p e r f o r m m o l e c u l a r d o c k i n g o f t h e αv β6p o l y p e p t i d e l i g a n d s a n dn a t u r a l l i g a n d s .S e c o n d l y ,A m b e r 16w a s u s e d t o p e r f o r m m o l e c u l a rd y n a m i c ss i m u l a t i o nt od e t e r m i n et h eb i n d i n g m o d eb e t w e e nt h e p o l y p e p t i d e l i g a n d s a n d αv β6p r o t e i n ,a n dR G D L X X L (X w a sa n y a m i n oa c i d )w a su s e da s t h ec o r es t r u c t u r eo f t h e p o l y p e p t i d el i g a n d ,t h ev i r t u a l p e p t i d el i b r a r y w a sc o n s t r u c t e db ygr a d u a le x t e n s i o no fa m i n o281吉林大学学报(理学版)第62卷a c i d s,p o l y p e p t i d e l i g a n d sw i t hal e n g t ho f7 10a m i n oa c i d sw e r es c r e e n e d,a n dn e w p o l y p e p t i d el i g a n d sd i f f e r e n tf r o m t h ec o r eo f R G D L X X L w e r ed e s i g n e da n ds c r e e n e d b y s i m i l a ra m i n oa c i d s u b s t i t u t i o nm e t h o d.F i n a l l y,t h e n e w l y d e s i g n e d p o l y p e p t i d e l i g a n d sw e r e s y n t h e s i z e db y s o l i d-p h a s e s y n t h e s i sm e t h o d,a n dt h eb i n d i n g a f f i n i t y o f p o l y p e p t i d el i g a n d-αvβ6w a sd e t e r m i n e db y i n d i r e c t E L I S A m e t h o d.T h e m o l e c u l a rd o c k i n g a n d m o l e c u l a rd y n a m i c ss i m u l a t i o nr e s u l t so f p o l y p e p t i d e l i g a n d s a n dn a t u r a l l i g a n d s s h o wt h a t t h e b i n d i n g o fαvβ6t o t h e l i g a n d i sm a i n l y a c h i e v e d t h r o u g h t h e h y d r o g e nb o n df o r m a t i o n b e t w e e n A s p218a n dt h e p o l y p e p t i d el i g a n d,a n dt h e m e t a lc h e l a t i o n b e t w e e n M g2+a n dt h e p o l y p e p t i d e l i g a n d.C o m b i n e dw i t hv i r t u a l c o m b i n a t i o ns c r e e n i n g a n ds i m i l a r a m i n oa c i ds u b s t i t u t i o n,w ef i n dt h a t p o l y p e p t i d e ss u c h a s G R T D L G T L L F R,G R R T D L A T I H G, R T D V G R V R G R G a n d R G D V G R V G R a l l m e e tt h i s b i n d i n g p a t t e r n,a n d t h e a f f i n i t y b e t w e e n R T D V G R V R G R Ga n dαvβ6i s10.76μm o l/L.T h e r e f o r e,R T D V G R V R G R Ga n dαvβ6h a v ea g o o d a f f i n i t y a n d a r e an e wαvβ6p o l y p e p t i d e l i g a n d.K e y w o r d s:i n t e g r i nαvβ6;p o l y p e p t i d e;d r u g d e s i g n;a f f i n i t y;e n z y m e-l i n k e d i m m u n o s o r b e n t a s s a y(E L I S A)整合素是细胞黏附分子家族中的重要成员之一,是一组跨膜糖蛋白受体,广泛分布于细胞表面.整合素的主要功能是介导细胞与细胞㊁细胞与细胞外基质之间的相互黏附,并介导细胞与细胞外基质之间的双向信号传导,对细胞的黏附㊁增殖㊁转移㊁凋亡起重要的调控作用.整合素是由α亚基和β亚基通过非共价键组成的跨膜异二聚体糖蛋白,目前已发现18种α亚基和8种β亚基,可形成24种不同的整合素受体[1].其中,αvβ6是唯一由β6亚基参与形成的异源二聚体整合素.整合素αvβ6在健康的成人上皮中不表达或表达很弱,但在创伤愈合㊁纤维化和炎症等生理或病理过程中,甚至在一些恶性肿瘤中,它的表达水平显著上调,该特征使整合素αvβ6在各种疾病诊断与治疗中成为一个非常有吸引力的靶点[2-3].目前文献报道的靶向αvβ6配体包括小分子配体和多肽类配体,其中多肽类配体主要包括定向工程化噬菌体展示获得的多肽R01和S02[4],基于向日葵胰蛋白酶抑制剂噬菌体展示筛选得到的多肽S F L A P3[5],源于口蹄疫病毒外壳的多肽A20F M D v2[6],噬菌体展示文库筛选得到的多肽D L X X L[7],以及天然配体P r o-T G F-β1和T G F-β3[8].其中[18F]氟苯甲酰基标记的肽[18F]F B A-A20F M D v2已在人类临床试验中用作P E T放射性示踪剂,用于特发性肺纤维化的诊断和治疗评估.研究表明,尽管多肽配体没有直接的抗癌活性,但可以作为分子成像载体用于癌症等疾病诊断,以及通过与药物或纳米粒的偶联进行整合素靶向肿瘤治疗.靶向整合素放射药物已是比较成熟的研究方向,此类药物结合了两种关键元素:一种靶向化合物/配体和一种放射性同位素[9].靶向放射性药物可以与肿瘤组织中的特异性靶点结合并聚集,通过放射性射线产生电离辐射作用,由于正常组织细胞与肿瘤组织细胞对射线的敏感性不同,因此可以实现肿瘤的靶向治疗或根据放射性射线对肿瘤进行精准诊断.如177L u-P S MA-617(N o v a r t i s)即将被批准用于前列腺癌的诊疗[10],由北京大学王凡课题组研发的中国首个核医学肿瘤显像诊断1类新药99m T c-3P R G D2已完成三期临床[11].因此开发具有靶向αvβ6作用的多肽配体具有重要意义.针对目前αvβ6结合多肽基本含有R G D L X X L(X为任意氨基酸)核心结构,且该结构处于专利保护范围内,本文拟筛选设计非专利范围内全新结构的αvβ6结合多肽配体.先通过分子模拟方法分析αvβ6与多肽配体的结合模式,再通过计算机辅助药物设计方法发现一种全新结构的αvβ6多肽配体,该配体具有良好的结合亲和力,可为后续的靶向αvβ6多肽和多肽-核素复合物研究提供理论与实际研究指导,是一个具有发展前景的先导化合物.1材料与方法1.1试剂和仪器F m o c-氨基酸(上海麦克林生化科技股份有限公司),2-氯代三苯甲基氯-树脂(阿拉丁试剂(上海)有限公司),二氯甲烷(D C M )㊁二甲基甲酰胺(D M F )㊁二异丙基乙胺(D I E A )和乙腈等(国药集团化学试剂有限公司),人整合素αv β6蛋白(M e d C h e m E x p r e s s L L C )㊁链霉亲和素-辣根过氧化物酶(S t r e p t a v i d i n -H P R )和3,3ᶄ,5,5ᶄ-四甲基联苯胺(T M B )显色液(上海碧云天生物技术有限公司),A 20F M D v 2(N A V P N L R G D L Q V L A Q K V A R T )㊁A 20F M D v 2-B i o t i n (B i o t i n -N A V P N L R G D L Q V L A Q -K V A R T )和A 20F M D v 2-G R D (N A V P N L G R D L Q V L A Q K V A R T )(核欣(苏州)医药科技有限公司),酶联免疫吸附试剂盒(江苏酶免实业有限公司).液相制备色谱仪(L C -20A P 型,日本岛津公司);三重四级杆液-质联用仪(A G I L E N T6470型,美国安捷伦科技有限公司);全波长酶标仪(M u l t i s k a nS k y H i g h 型,美国赛默飞世尔科技公司).1.2 分子模拟方法1.2.1 分子对接采用S y b y l -X 1.3进行分子对接,靶蛋白αv β6源自蛋白质结构数据库(P r o t e i n D a t aB a n k ,h t t p s ://w w w.r c s b .o r g ,I D :5F F O ),配体来源于文献㊁有机小分子生物活性数据库(P u b C h e m ,h t t p s ://p u b c h e m.n c b i .n l m.n i h .g o v )和药物化学数据库(C h e m b l ,h t t p s ://w w w .e b i .a c .u k /c h e m b l /)等.使用S y b y l 软件的S u r f l e x -D o c k 模块,将蛋白晶体结构中天然配体所在位置定义为活性结合口袋.利用S u r f l e x -D o c kG e o m X (S F X C )模块进行高精度分子对接,分子对接参数:配体分子初始构像数目为10,分子片段最大构像数目为20,分子最大可旋转键数据为100,其他参数默认.综合结合构像和对接打分构建αv β6-多肽复合物用于分子动力学模拟.1.2.2 分子动力学模拟和结合自由能计算本文所有分子动力学模拟均在L i n u x 工作站用A m b e r 16[12]计算.αv β6使用F F 14S B 力场,多肽配体使用G A F F 力场和AM 1-B C C 电荷,将多肽-蛋白体系浸没于0.15m o l /L 氯化钠溶液(T I P 3P )的立方体盒子中,复合物距立方体盒子边缘为1.00n m ,体系包含98个N a +,78个C l -,36206个水分子.模拟过程如下:首先进行5步能量优化,避免可能的分子碰撞;其次进行两步加热,使体系温度从0逐渐升温到303.15K ,并进行溶液密度调整和体系平衡;最后在303.15K 下对系统(N P T )进行100n s 的动力学模拟,时间步长为2f s,压力恒定为1个大气压.结合自由能以及能量分解计算由A m b e r 的MM P B S A.p y 程序完成[13],选取最后20n s 进行计算并取其平均结构进行结合模式分析,分析αv β6与配体的结合模式.当结合自由能的值为负值时,体系是稳定的,且该值越小配体-受体结合亲和力越高.1.2.3 组合虚拟筛选本文虚拟筛选由S Y B Y L -X1.3完成.首先以R G D L X X L 为基础,在5,6号位通过20种天然氨基酸的随机组合建立一个含400条多肽的多肽文库,通过R o s e t t a 软件[14]对多肽进行批量结构优化构建虚拟肽库,根据1.2.1节中定义的活性口袋进行虚拟筛选,综合结合构像以及对接打分筛选出最佳结合七肽.然后将筛选出的七肽作为核心逐步延长多肽链,同理筛选出最佳结合八肽㊁九肽和十肽用于进一步研究.结合模式分析结果表明,现有多肽配体与αv β6的结合主要为九肽和十肽核心结构,因此将筛选出的九肽㊁十肽和骨架R G D L X X L 进行氨基酸替换,如亮氨酸可替换为缬氨酸,二者等电点相近,分别为5.98和5.96,侧链结构相似,分别为异丙基和异丁基,二者均为带疏水性侧链的脂肪族氨基酸,氨基酸替换时在改变多肽结构的同时尽量不改变其理化性质.在保持多肽关键结合氨基酸不变的情况下,进一步构建虚拟肽库,通过与上一步相同的虚拟筛选㊁精准对接㊁分子动力学模拟获得最佳结合多肽配体,利用分子动力学模拟和结合自由能能量分解计算验证结构改造的合理性.1.3 多肽固相合成方法用D C M 激活树脂后,通过D I E A 将第一个氨基酸耦联到树脂上,然后用哌啶/D M F 保护第一个氨基酸,通过茚三酮实验确认氨基酸耦合后用D M F 和甲醇洗涤树脂.使用预活化的第二个氨基酸㊁肽耦合试剂H B T U 和D I E A 溶液进行耦联,确认耦联后,重复洗涤,重复去保护和耦合循环,直到获得所需的肽链长度.最后将树脂结合的多肽转移到圆底瓶中,通过n (T F A )ʒn (H 2O )ʒn (E D T )ʒn (T I S )=94.5ʒ2ʒ2.5ʒ1的组合溶液同时去除树脂和保护基团.再利用制备型高效液相色谱结合梯381 第1期 李跃鹏,等:新型靶向αv β6多肽的设计㊁合成与亲和力评价481吉林大学学报(理学版)第62卷度洗脱对多肽进行分离纯化,其中乙腈/水为流动相,检测波长为214n m.最后用液质联用仪(L C-M S)确认目标产物.1.4E L I S A法测定结合亲和力人源αvβ6蛋白经包被㊁封闭后,在孔板中加入待测配体溶液.其中空白组仅加入100μL T B S缓冲溶液;空白对照中加入A20F M D v2-B i o t i n和T B S缓冲溶液各50μL;阳性对照加入A20F M D v2-B i o t i n和A20F M D v2(梯度)各50μL;阴性对照加入A20F M D v2-B i o t i n和A20F M D v2-G R D各50μL;实验组加入A20F M D v2-B i o t i n和待测多肽(梯度)各50μL.每组设置3个平行试验.反应2h后, S t r e p t a v i d i n-H R P用P B S T稀释100倍,向各孔加入100μL,室温振摇反应后,向各孔加入100μLT M B显色液,立即将孔板置于酶标仪中避光孵育,每5m i n读取一次650n m波长处的吸光度(A)值,共读取1h(13个检测点).2结果与讨论2.1αvβ6与现有配体的结合模式现有αvβ6多肽配体的分子对接与结合自由能计算结果列于表1.由表1可见,分子对接打分选取结合构像最佳的对接结果,所有配体分子与αvβ6的结合自由能为-147.7534~-92.8887k J/m o l.结合自由能能量分解结果表明,αvβ6与多肽配体形成的基本强相互作用:A r g R G D侧链通过氢键与αv 亚基A s p218上的羧基形成氢键;多肽的侧链残基与β6亚基种金属离子依赖的黏附位点中M g2+形成配位键;配体中-L X X L-部分可以形成两亲性α螺旋,并且该螺旋结构与β6亚基形成的特异性疏水口袋结合,该结合模式为后续设计的多肽是否合理建立标准.表1现有αvβ6配体分子对接以及结合自由能计算结果T a b l e1C a l c u l a t i o n r e s u l t s o fm o l e c u l a r d o c k i n g a n db i n d i n g f r e e e n e r g y f o r e x i s t i n gαvβ6l i g a n d多肽配体多肽序列分子对接打分结合自由能/(k J∙m o l-1) R01G C I L NM R T D L G T L L F R C R R D S D C P G A C I C R G N G Y C G10.65-136.2091S02G C R S L A R T D L D H L R G R C S S D S D C L A E C I C L E N G F C G9.36-131.6895S F L A P3G R C T G R G D L G R L C Y P D9.03-147.7534A20F M D v2N A V P N L R G D L Q V L A Q K V A R T11.39-142.9696D L X X L R T D L D S L R T7.46-92.8887T G F-β3H R G D L G R L K K8.89-139.6147P r o-T G F-β1N G F T T G R R G D L A T I H GMN R8.53-144.51582.2靶向αvβ6多肽配体的设计以R G D L X X L为核心初步筛选多肽配体的分子对接以及结合自由能计算结果列于表2.结合自由能除七肽较低为-26.3186k J/m o l外,其他3条多肽结合自由能均小于-62.8020k J/m o l.虚拟筛选的多肽与αvβ6结合模式如图1所示.由图1可见,七肽除必要的结合作用外,还与T y r178形成键长为0.29,0.39n m的氢键,并与G l u698形成键长为0.35n m的氢键;八肽除必要的结合作用外,还与A s n693和S e r602分别形成键长为0.38,0.31n m的氢键;九肽除必要的结合作用外,还与T y r178, A s p729,T h r696,A s p695分别形成键长0.32,0.32,0.40,0.38n m的氢键;十肽除必要的结合作用外,还与T y r178,S e r602,T h r696分别形成键长为0.40,0.32,0.39n m的氢键.表2多肽虚拟筛选㊁设计分子对接以及结合自由能计算结果T a b l e2V i r t u a l s c r e e n i n g o f p o l y p e p t i d e s,d e s i g no fm o l e c u l a r d o c k i n g a n d c a l c u l a t i o n r e s u l t s o f b i n d i n g f r e e e n e r g y多肽序列分子对接打分结合自由能/(k J∙m o l-1)七肽R G D L T R L8.23-26.3186八肽R G D L T R L G8.64-70.9813九肽R G D L T R L G R9.49-104.0541十肽R G D L T R L G R T9.62-116.2197图1 虚拟筛选的多肽与αv β6结合模式F i g .1 B i n d i n gp a t t e r n s o f v i r t u a l s c r e e n i n g o f p o l y p e p t i d e s a n d αv β6 考虑到现有研究中的配体均基于R G D L X X L 配体,本文对初步筛选出的九肽和十肽的氨基酸残基进行替换筛选,探索全新结构的αv β6多肽配体,最终得到2条多肽,分别为R G D V G R V G R 和R T D V G R V R G R .2条多肽配体与αv β6结合模式如图2所示.由图2可见,2条多肽与αv β6的结合模式与现有配体一致:多肽R T D V G R V G R G 除必要的结合作用外,还与A s p 150,A s p 148,I l e 147,G l u 121,S e r 656,G l u 698分别形成键长为0.29,0.34,0.35,0.31,0.32,0.32n m 的氢键;多肽R G D V G R V G R 除必要的相互作用外,还与T y r 178,A s p 695,T h r 696,L y s 119,S e r 656,P r o 654,L y s 645分别形成键长为0.38,0.27,0.23,0.33,0.29,0.29,0.28n m 的氢键.图2 氨基酸替换后多肽结合模式F i g .2 P o l y p e p t i d e b i n d i n gpa t t e r na f t e r a m i n o a c i d s ub s t i t u t i o n 2.3 多肽合成结果本文合成了4条多肽,分别为P 1(G R T D L G T L L F R ),P 2(G R R T D L A T I H G ),P 3(R T D V G R V R G R ),P 4(R G D V G R V G R ).其中P 2为p r o -T G F -β1配体的R G D 特征片段[15-17],在后续研究中作为设计多肽亲和力测定的对照,P 1为重庆理工大学靶向药物筛选与活性评价课题组原有肽库筛选出的配体,P 3和P 4为本文结构优化后的多肽配体.根据高效液相色谱(H P L C )结果,P 1纯度为98.461%,P 2纯度为95.749%,P 3纯度为95.135%,P 4纯度为97.554%.根据L C -M S 结果,P 1计算的摩尔质量为1248.42g /m o l ,测量的摩尔质量为1249.00g /m o l ;P 2计算的摩尔质量为1196.31g /m o l ,测量的摩尔质量为1196.70g /m o l ;P 3计算的摩尔质量为1171.31g /m o l ,测量的摩尔质量为1171.35g /m o l ;P 4计算的摩尔质量为971.07g /m o l ,测量的摩尔质量为971.25g /m o l .可见,经H P L C 以及L C -M S 分析,确定合成的多肽581 第1期 李跃鹏,等:新型靶向αv β6多肽的设计㊁合成与亲和力评价为本文研究的目标产物.2.4亲和力测定结果酶联免疫吸附(E L I S A)实验采用饱和浓度法进行计算[18],即体系反应达到最大响应值的50%时的浓度为结合亲和力浓度.每个孔位设置3组平行试验,测量数据结果显示标准差不超过平均值的15%.测试样品吸光度在进行计算时应减去标准品浓度为0的A平均值,即只加了T B S缓冲液的孔位吸光度.采用A20F M D v2作为阳性对照(亲和力3μm o l/L),利用O r i g i n2016对标准品吸光度及浓度绘制四参数逻辑函数曲线,计算阳性对照达到最大反应响应值的浓度约为40μm o l/L,如图3所示.利用B i o t i n标记的A20F M D v2作为检测目标分子,S t r e p t a v i d i n-H R P可与B i o t i n-A20F M D v2形成稳定复合物,当待测多肽与αvβ6结合时溶液中的B i o t i n-A20F M D v2浓度增加,T M B可与S t r e p t a v i d i n-H R P生成蓝色化合物进而检测溶液吸光度.根据4条待测多肽的A值以及浓度㊁阳性标准品的吸光度,绘制多肽-蛋白结合率和多肽浓度相关性曲线,结果如图4所示.由图4和吸光度数据可以计算出P1的亲和力为3.35μm o l/L,P3的亲和力为10.76μm o l/L .图3阳性对照A20F M D v2的浓度-吸光度曲线F i g.3C o n c e n t r a t i o n-a b s o r b a n c e c u r v eo f p o s i t i v e c o n t r o lA20F M D v 2图4待测多肽的浓度-结合率曲线F i g.4C o n c e n t r a t i o n-b i n d i n g r a t e c u r v e so f t e s t e d p o l y p e p t i d e2.5讨论本文通过分子对接与分子动力学模拟分析αvβ6与配体的结合模式,虚拟组合筛选获得符合结合模式的全新结构多肽,采用固相合成法合成多肽,通过间接E L I S A法测定多肽配体与αvβ6的结合亲和力.实验结果表明:多肽配体P3与αvβ6具有良好的结合亲和力,略大于阳性对照A20F M D v2的结合亲和力,基本符合设计预期.实验中P2和P4由于亲和力较弱,仅存在阳性结果,无法计算其亲和力值.P1虽然也有较强的αvβ6蛋白结合亲和力,但其结构仍具有R G D L X X L核心,因此在后续的研究中可作为先导化合物改造其结构.P3和P4虽都为氨基酸替换后筛选出的多肽,但其结合亲和力差距较大.综合分子对接和结合自由能相关计算结果,推测P4活性较差的原因是其-V G R V G R-部分的空间位阻较小,而αv与β6亚基形成的结合空腔较大,二者结合时存在一定的结合不稳定性.结构生物学研究表明,αvβ6不仅能识别R G D序列,还能识别-L X X L-基序,该基序折叠成两亲性α-螺旋,结合至β6亚基残基组成的疏水口袋中[15-17].研究中筛选出全新结构多肽含有的-V X X V-序列也可以形成两亲性α-螺旋,该螺旋可与β6亚基形成更多氢键相互作用,R T D序列也可以与αvβ6形成稳定的氢键,表明了本文采用氨基酸替换方法的合理性.可见,计算机辅助药物设计方法可有效提高药物开发的成功率㊁降低研发成本并缩短研发周期,是创新药物研发的重要方法.文献研究表明,整合素αvβ6的表达在许多肿瘤中显著上调,包括口腔鳞癌㊁乳腺癌㊁胃癌㊁胰腺癌㊁结直肠癌㊁肺癌等[18-20].整合素αvβ6的表达与许多癌种患者的生存率降低相关,例如结直肠癌㊁乳腺癌㊁胰腺导管腺癌㊁非小细胞肺癌和宫颈鳞状细胞癌等[21-25],并且可以通过纤维连接蛋白和胶原中的R G D序列参与肿瘤细胞与胞外基质的相互作用,该整合素的过度表达与上皮细胞向间充质样细胞转化有关,可促进肿瘤细胞的侵袭和迁移,通常在肿瘤侵袭病灶的前沿部分中整合素的表达水平较高.目前,靶向整合素成像已成为整合素研究热点之一,包括正电子发射断层扫描和单光子发射计算机断层扫描,整合素显像剂可用于对患者分层进行靶向治疗㊁评估治疗反应,并监测肿瘤生长[26-30].681吉林大学学报(理学版)第62卷由于大部分基础生物学仍未完全了解,因此αv β6为靶标的治疗肿瘤药物也尚未开发,但其仍有作为诊断靶点的潜力.综上所述,本文采用计算机辅助药物设计的方法设计了一条基于R T D V X X V 全新结构的αv β6多肽配体,研究结果表明,该配体具有良好的结合亲和力,配体分子可作为靶向αv β6多肽或肽类结合物开发的候选分子,为未来αv β6结合配体的开发提供结构基础.参考文献[1] S L A C K R J ,MA C D O N A L D SJ F ,R O P E R J A ,e ta l .E m e r g i n g T h e r a p e u t i c O p p o r t u n i t i e sf o rI n t e gr i n I n h i b i t o r s [J ].N a tR e vD r u g D i s c o v ,2022,21(1):60-78.[2] K O I V I S T OL ,B I JR ,HÄK K I N E NL ,e t a l .I n t e g r i n αv β6:S t r u c t u r e ,F u n c t i o n a n dR o l e i nH e a l t h a n dD i s e a s e [J ].I n t JB i o c h e m C e l l B i o l ,2018,99:186-196.[3] B R Z O Z OW S K A E ,D E S HMU K H S .I n t e g r i n A l p h avB e t a6(αv β6)a n dI t s I m p l i c a t i o n s i nC a n c e rT r e a t m e n t [J ].I n t JM o l S c i ,2022,23(20):12346-1-12346-18.[4] K I MU R A R H ,T E E DR ,HA C K E LBJ ,e t a l .P h a r m a c o k i n e t i c a l l y S t a b i l i z e dC y s t i n eK n o tP e pt i d e sT h a tB i n d A l p h a -v -B e t a -6I n t e g r i nw i t hS i n g l e -D i g i tN a n o m o l a rA f f i n i t i e s f o rD e t e c t i o n o f P a n c r e a t i cC a n c e r [J ].C l i nC a n c e r R e s ,2012,18(3):839-849.[5] R OE S C H S ,L I N D N E RT ,S A U T E R M ,e t a l .C o m p a r i s o no f t h eR G D M o t i f -C o n t a i n i n g αv β6I n t e g r i n -B i n d i n g P e p t i d e sS F L A P 3a n d S F I T G v 6f o r D i a g n o s t i c A p pl i c a t i o ni n HN S C C [J ].J N u c l M e d ,2018,59(11):1679-1685.[6] HA U S N E RSH ,D I C A R AD ,MA R I KJ ,e t a l .U s e o f aP e p t i d eD e r i v e d f r o mF o o t -a n d -M o u t hD i s e a s eV i r u s f o r t h eN o n i n v a s i v e I m a g i n g o fH u m a nC a n c e r :G e n e r a t i o n a n dE v a l u a t i o n o f 4-[18F ]F l u o r o b e n z o yl A 20F M D v 2f o r i n v i v o I m a g i n g o f I n t e g r i n A l p h a v b e t a 6E x p r e s s i o n w i t hP o s i t r o nE m i s s i o nT o m o g r a p h y [J ].C a n c e rR e s ,2007,67(16):7833-7840.[7] K R A F TS ,D I E F E N B A C H B ,M E H T A R ,e ta l .D e f i n i t i o no fa n U n e x p e c t e d L i g a n d R e c o gn i t i o n M o t i ff o r A l p h a vB e t a 6I n t e g r i n [J ].JB i o l C h e m ,1999,274(4):1979-1985.[8] D O N G XC ,HU D S O N N E ,L U CF ,e t a l .S t r u c t u r a lD e t e r m i n a n t s o f I n t e g r i n β-S u b u n i t S p e c i f i c i t y f o rL a t e n t T G F -β[J ].N a t S t r u c tM o l B i o l ,2014,21(12):1091-1096.[9] G A R O U S I J ,V O R O B Y E V A A ,A L T A IM.I n f l u e n c e o f S e v e r a l C o m p o u n d s a n dD r u g s o n t h eR e n a lU pt a k eo f R a d i o l a b e l e dA f f i b o d y M o l e c u l e s [J ].M o l e c u l e s ,2020,25(11):2673-1-2673-10.[10] S A R T O R O ,D E B O N O J ,C H I K N ,e ta l .L u t e t i u m -177-P S MA -617f o r M e t a s t a t i c C a s t r a t i o n -R e s i s t a n t P r o s t a t eC a n c e r [J ].N E n g l JM e d ,2021,385(12):1091-1103.[11] Z HUZ H ,M I A O W B ,L IQ W ,e ta l .99m T c -3P R G D 2f o rI n t e g r i n R e c e p t o rI m a g i n g o fL u n g C a n c e r :A M u l t i c e n t e r S t u d y [J ].JN u c lM e d ,2012,53(5):716-722.[12] C A S ED A ,C H E A T HAM ⅢT E ,D A R D E N T ,e t a l .T h eA m b e rB i o m o l e c u l a rS i m u l a t i o nP r o gr a m s [J ].J C o m p u tC h e m ,2005,26(16):1668-1688.[13] M I L L E R ⅢBR ,M C G E ETD ,J r ,S WA I L S JM ,e t a l .MM P B S A.p y :A nE f f i c i e n t P r o g r a mf o r E n d -S t a t e F r e e E n e r g y C a l c u l a t i o n s [J ].JC h e m T h e o r y C o m p u t ,2012,8(9):3314-3321.[14] N E R L I S ,S G O U R A K I SN G.C s -R o s e t t a [J ].M e t h o d sE n z y m o l ,2019,614:321-362.[15] C AM P B E L L M G ,C O R M I E R A ,I T O S ,e t a l .C r y o -E M R e v e a l s I n t e g r i n -M e d i a t e dT G F -βAc t i v a t i o nw i t h o u t R e l e a s e f r o m L a t e n tT G F -β[J ].C e l l ,2020,180(3):490-501.[16] S C H I N N E R C ,X U L F ,F R A N Z H ,e t a l .D e f e c t i v e D e s m o s o m a l Ad he s i o n C a u s e s A r r h y t h m o ge n i c C a r d i o m y o p a t h y b y I n v o l v i n g a n I n t e g r i n -αv β6/T G F -βSi g n a l i n g C a s c a d e [J ].C i r c u l a t i o n ,2022,146(21):1610-1626.[17] WA N G X ,L I US ,Y U T ,e t a l .I n h i b i t i o no f I n t e g r i n αv β6A c t i v a t i o no fT G F -βAt t e n u a t e sT e n d i n o p a t h y [J ].A d vS c i (W e i n h ),2022,9(11):e 2104469-1-e 2104469-14.[18] 陈文龙,张阳阳,张生英,等.牛病毒性腹泻病毒E 2蛋白的克隆㊁表达及多克隆抗体制备[J ].吉林大学学报(理学版),2020,58(3):711-717.(C H E N W L ,Z HA N G Y Y ,Z HA N GSY ,e t a l .C l o n i n g a n dE x pr e s s i o no f E 2P r o t e i no f B o v i n e v i r a l d i a r r h e av i r u s a n dP r e p a r a t i o no fP o l y c l o n a lA n t i b o d y [J ].J o u r n a l o f J i l i nU n i v e r s i t y 781 第1期 李跃鹏,等:新型靶向αv β6多肽的设计㊁合成与亲和力评价881吉林大学学报(理学版)第62卷(S c i e n c eE d i t i o n),2020,58(3):711-717.)[19] HU A N G H S,Y U A N M C,WU SL,e ta l.C l i n i c a lS i g n i f i c a n c eo fC-X-C M o t i fC h e m o k i n eR e c e p t o r4a n dI n t e g r i nαvβ6E x p r e s s i o n i nB r e a s tC a n c e r[J].JB r e a s tC a n c e r,2020,23(2):171-181.[20] B A A R T V M,V A N D U I J NC,V A NE GMO N DSL,e t a l.E G F Ra n dαvβ6a sP r o m i s i n g T a r g e t s f o rM o l e c u l a rI m a g i n g o fC u t a n e o u s a n d M u c o s a l S q u a m o u sC e l l C a r c i n o m a o f t h eH e a da n dN e c kR e g i o n[J].C a n c e r s,2020,12(6):1474-1-1474-13.[21] MO O R E K M,D E S A I A M,D E L G A D O B L,e ta l.I n t e g r i nαvβ6-S p e c i f i c T h e r a p y f o rP a n c r e a t i c C a n c e rD e v e l o p e d f r o m F o o t-a n d-M o u t h-D i s e a s eV i r u s[J].T h e r a n o s t i c s,2020,10(7):2930-2942.[22] L I A N GB J,L I L P,M I A O R Z,e ta l.E x p r e s s i o n o fI n t e r l e u k i n-6a n dI n t e g r i nαvβ6i n C o l o n C a n c e r:A s s o c i a t i o nw i t hC l i n i c a lO u t c o m e s a n dP r o g n o s t i c I m p l i c a t i o n s[J].C a n c e r I n v e s t,2019,37(3):174-184.[23] A HNSB,MOHAM E D A L IA,C HA N C,e ta l.C o r r e l a t i o n sb e t w e e nI n t e g r i nαvβ6E x p r e s s i o na n d C l i n i c o-P a t h o l o g i c a l F e a t u r e s i nS t a g eBa n dS t a g eCR e c t a l C a n c e r[J].P L o SO n e,2014,9(5):e97248-1-e97248-8.[24] D E S A IK,N A I R M G,P R A B HUJS,e t a l.H i g hE x p r e s s i o no f I n t e g r i nβ6i n A s s o c i a t i o n w i t ht h eR h o-R a cP a t h w a y I d e n t i f i e s aP o o rP r o g n o s t i cS u b g r o u p w i t h i n H E R2A m p l i f i e dB r e a s tC a n c e r s[J].C a n c e rM e d,2016, 5(8):2000-2011.[25] R AMO SD M,D A N GD M,S A D L E RS.T h eR o l e o f t h e I n t e g r i nA l p h a vB e t a6i nR e g u l a t i n g t h eE p i t h e l i a l t oM e s e n c h y m a lT r a n s i t i o n i nO r a l C a n c e r[J].A n t i c a n c e rR e s,2009,29(1):125-130.[26] B A T E SR C,B E L L O V I N DI,B R OWN C,e ta l.T r a n s c r i p t i o n a lA c t i v a t i o no fI n t e g r i n B e t a6d u r i n g t h eE p i t h e l i a l-M e s e n c h y m a lT r a n s i t i o n D e f i n e sa N o v e lP r o g n o s t i cI n d i c a t o ro f A g g r e s s i v e C o l o n C a r c i n o m a[J].JC l i n I n v e s t,2005,115(2):339-347.[27] L I O L I O SC,S A C H P E K I D I SC,K O L O C O U R I SA,e t a l.P E TD i a g n o s t i cM o l e c u l e sU t i l i z i n g M u l t i m e r i cC y c l i cR G DP e p t i d eA n a l o g s f o r I m a g i n g I n t e g r i nαvβ3R e c e p t o r s[J].M o l e c u l e s,2021,26(6):1792-1-1792-27. [28] D O L G I N E.R a d i o a c t i v e D r u g s E m e r g e f r o m t h e S h a d o w s t o S t o r m t h e M a r k e t[J].N a t B i o t e c h n o l,2018,36(12):1125-1127.[29] R I C E M,K R O S I N M,HA S T E P.P o s t Y t t r i u m-90I m a g i n g[J].S e m i nI n t e r v e n t R a d i o l,2021,38(4):460-465.[30] B A D I P AF,A L I R E Z A O U R B,Y O U S E F N I A H.A n O v e r v i e wo fR a d i o l a b e l e dR G D P e p t i d e s f o rT h e r a n o s t i cA p p l i c a t i o n s[J].C u r rR a d i o p h a r m,2022,16(2):107-122.(责任编辑:单凝)。


ACE抑制肽的制备、构效关系及活性评价研究进展
沈嘉森;苏永昌;林河通;李水根;陈晓婷;刘智禹
【期刊名称】《渔业研究》
【年(卷),期】2022(44)1
【摘要】ACE抑制肽是通过食源性加工制备而成的具有降血压作用的生物活性多肽,包含抗氧化、抗炎、抗肥胖等多种潜在生理活性,将纯化后的多肽序列与ACE相互作用,研究其构效关系。
ACE抑制肽具有天然可靠、无毒、安全等优点,在食品工业中受到了广泛的关注和应用。
本文概述ACE抑制肽,重点对多肽的制备、分离纯化、分子模拟及原发性高血压大鼠的体内表达和体外功能活性评价等研究进展进行综述,以期为ACE抑制肽在加工和生产领域的进一步开发提供借鉴。
【总页数】9页(P100-108)
【作者】沈嘉森;苏永昌;林河通;李水根;陈晓婷;刘智禹
【作者单位】闽台特色海洋食品加工及营养健康教育部工程研究中心;福建农林大学食品科学学院;福建水产研究所;福建海洋职业技术学校
【正文语种】中文
【中图分类】S985
【相关文献】
1.ACE抑制肽构效关系及其酶法制备的研究进展
2.ACE抑制肽构效关系研究进展
3.食物源ACE抑制肽的生产及构效关系研究进展
4.ACE抑制肽构效关系的研究进
展及乳源性ACE抑制肽的加工利用现状5.食用菌ACE抑制肽制备及其功能活性研究进展
因版权原因,仅展示原文概要,查看原文内容请购买。
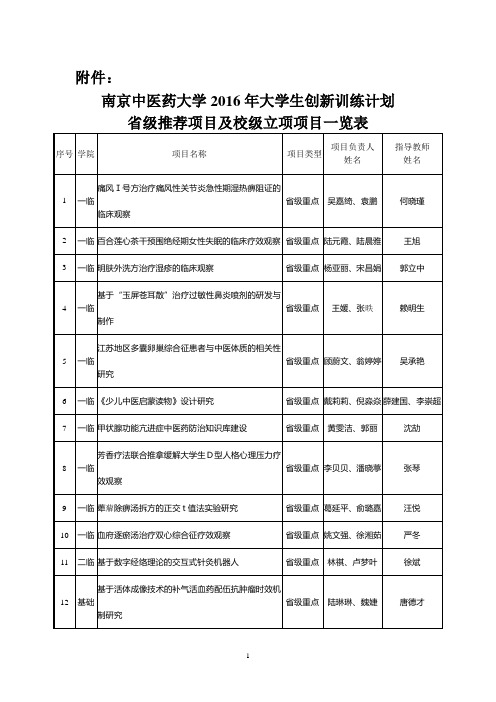
![BACE1抑制剂[发明专利]](https://img.taocdn.com/s1/m/3c08d43fbb1aa8114431b90d6c85ec3a86c28b40.png)
(19)中华人民共和国国家知识产权局(12)发明专利申请(10)申请公布号 (43)申请公布日 (21)申请号 201580046156.6(22)申请日 2015.10.07(30)优先权数据14188412.2 2014.10.10 EP(85)PCT国际申请进入国家阶段日2017.02.27(86)PCT国际申请的申请数据PCT/EP2015/073077 2015.10.07(87)PCT国际申请的公布数据WO2016/055496 EN 2016.04.14(71)申请人 豪夫迈·罗氏有限公司地址 瑞士巴塞尔(72)发明人 比约恩·巴特尔斯 菲利普·奎尼 科西莫·多伦特 沃尔夫冈·古帕 沃尔夫冈·哈普 安德烈亚斯·库格斯塔特 乌尔丽克·奥布斯特·森德 延斯-乌韦·彼得斯 马克·罗杰斯-埃文斯 沃尔特·维凡 托马斯·沃尔特林 (74)专利代理机构 中科专利商标代理有限责任公司 11021代理人 贺卫国 柳春琦(51)Int.Cl.C07D 513/04(2006.01)C07D 519/00(2006.01)A61K 31/542(2006.01)A61P 25/28(2006.01) (54)发明名称BACE1抑制剂(57)摘要本发明提供具有BACE1抑制活性的式I化合物,它们的制备,含有它们的药物组合物和它们作为治疗活性物质的用途。
本发明的活性化合物可用于治疗性和/或预防性治疗例如阿尔茨海默病。
权利要求书25页 说明书181页CN 106795177 A 2017.05.31C N 106795177A1.一种式I化合物,其中n是1,2或3;R1选自由以下各项组成的组i)C1-6-烷基,和ii)卤素-C1-6-烷基;R2选自由以下各项组成的组i)C1-6-烷基,和ii)卤素-C1-6-烷基;或R1和R2与它们连接的C-原子一起形成C3-6-环烷基-,其中C3-6-环烷基-任选地被一个以上选自由卤素和羟基组成的组的取代基取代;R3各自独立地选自由以下各项组成的组i)氢,ii)C1-6-烷基,和iii)卤素;R4各自独立地选自由以下各项组成的组i)氢,ii)C1-6-烷基,和iii)卤素;或其中R3和R4一起是-(CH2)m-,其中m是2,3,4或5,R5是氢,R6选自由以下各项组成的组i)C1-6-烷基,和ii)卤素-C1-6-烷基;R7选自由以下各项组成的组i)氢,和ii)卤素;R8选自由以下各项组成的组i)芳基,ii)被1-4个单独选自以下各项的取代基取代的芳基:氨基,氰基,卤素,卤素-C1-6-烷基,卤素-C1-6-烷氧基,C1-6-烷氧基,C1-6-烷氧基-C1-6-烷基,C2-6-炔基-C1-6-烷氧基,C2-6-炔基,C1-6-烷基,其中R9是H或C1-6-烷基的COOR9,其中R10是H或C1-6-烷基C3-6-环烷基并且R11是H或C1-6-烷基的CONR10R11,任选地被1至4个单独选自由卤素,氰基,C1-6-烷基和C1-6-烷氧基组成的组的取代基取代的C3-6-环烷基,C3-6-环烷基-C1-6-烷氧基和C3-6-环烷基-C1-6-烷氧基,其中所述环烷基单元被1至4个单独选自由卤素,氰基,C1-6-烷基和C1-6-烷氧基组成的组的取代基取代;iii)杂芳基,和iv)被1-4个单独选自以下各项的取代基取代的杂芳基:氨基,氰基,卤素,卤素-C1-6-烷基,卤素-C1-6-烷氧基,C1-6-烷氧基,C1-6-烷氧基-C1-6-烷基,C2-6-炔基-C1-6-烷氧基,C2-6-炔基,C1-6-烷基,其中R9是H或C1-6-烷基的COOR9,其中R10是H或C1-6-烷基C3-6-环烷基并且R11是H 或C1-6-烷基的CONR10R11,任选地被1至4个单独选自由卤素,氰基,C1-6-烷基和C1-6-烷氧基组成的组的取代基取代的C3-6-环烷基,C3-6-环烷基-C1-6-烷氧基和C3-6-环烷基-C1-6-烷氧基,其中所述环烷基单元被1至4个单独选自由卤素,氰基,C1-6-烷基和C1-6-烷氧基组成的组的取代基取代;或其药用盐。
专利名称:一类新型二肽基肽酶抑制剂、合成方法和用途专利类型:发明专利
发明人:陈慧茹,陈义朗
申请号:CN200710041760.7
申请日:20070608
公开号:CN101318922A
公开日:
20081210
专利内容由知识产权出版社提供
摘要:本发明提供了如下式(I)所示的二肽基肽酶IV的抑制剂,式中,R为氢、氯、氟、溴、羟基或C-C的烷氧基,R为氢、氯、氟、溴或羟基,但R为氢时排除R为羟基或C-C的烷氧基,R为氢或氟。
这类化合物可用于治疗或预防与二肽基肽酶IV相关的疾病,如糖尿病,肥胖,高血脂。
本发明还提供(I)所示化合物及其药学上可接受的盐、药物组合物的制备方法及其用于制备治疗或预防与二肽基肽酶IV相关疾病的药物中的应用。
申请人:上海阳帆医药科技有限公司
地址:201203 上海市张江高科技园区蔡伦路720弄2号楼204、206室
国籍:CN
代理机构:上海专利商标事务所有限公司
代理人:徐迅
更多信息请下载全文后查看。
专利名称:一类多肽及其在制备ACE抑制剂或降血压产品上的应用
专利类型:发明专利
发明人:俞黎黎,钱炳俊,田冲冲,温尧林,胡君,杨烨,戴丽
申请号:CN202011593797.2
申请日:20201229
公开号:CN112694429A
公开日:
20210423
专利内容由知识产权出版社提供
摘要:本发明公开了一类多肽及其在制备ACE抑制剂或降血压产品上的应用。
该类多肽的氨基酸序列为Sar‑bAla‑Pro;结构如通式(I)所示本发明多肽由稀有氨基酸Sar、bAla和常规氨基酸Pro人工合成,为单链线性结构,白色粉末状,微溶于水,分子量为257.14Da,tPSA值为98.74,显示出较好的疏水性,该类多肽可以抵御体内蛋白酶的进一步水解,具有较好的抑制ACE的活性,作为治疗高血压等心血管病药物和功能食品有效成份的先导化合物具有良好的潜力和应用价值。
申请人:江苏医药职业学院,苏州凯祥生物科技有限公司
地址:224005 江苏省盐城市解放南路283号
国籍:CN
代理机构:南京先科专利代理事务所(普通合伙)
代理人:缪友菊
更多信息请下载全文后查看。
新型BTK-PROTAC分子的设计、合成及生物活性评价葛子豪;周卯;查永骏;白海云;钟利【期刊名称】《合成化学》【年(卷),期】2024(32)6【摘要】蛋白降解靶向嵌合体(PROTAC)技术在新药研发领域越来越受到重视。
基于NX-5948的靶蛋白配体(Warhead)结构,采用5-氟吲哚代替吡嗪胺的思路进行改造,成功合成化合物A。
为研究不同连接子(Linker)和E3配体对蛋白降解活性的影响,成功设计合成了化合物B~F,化合物A~F结构均经^(1)H NMR和MS表征。
通过蛋白质免疫印迹法(Western blot,WB)分别测定目标化合物布鲁顿酪氨酸激酶(BTK)的降解活性。
结果表明:化合物A、C、D、E、F都有近似于NX-5948的蛋白降解活性,其半数降解浓度(DC_(50))小于1 nM;并且所有目标化合物24 h最大降解程度(D_(max))均略优于NX-5948,为进一步化合物改造提供结构依据。
【总页数】8页(P534-541)【作者】葛子豪;周卯;查永骏;白海云;钟利【作者单位】安徽中医药大学药学院;长三角药物高等研究院;百极弘烨(南通)医药科技有限公司【正文语种】中文【中图分类】R914.5【相关文献】1.以ALS为靶标的新型除草剂的分子设计、合成及生物活性研究(Ⅵ)——嘧啶(硫)醚类除草剂的电子结构研究及新型除草剂的分子设计2.以ALS为靶标的新型除草剂的分子设计、合成及生物活性研究(Ⅲ)——5,7-二甲基-N-(取代苯基)-1,2,4-三唑并[1,5-a]嘧啶-2-磺酰胺的晶体及分子结构3.新型CDK2-cyclinA2小分子抑制剂的设计、合成及生物学活性研究4.杂环或大位阻基团固定硝基位向的新型新烟碱类化合物的分子设计,合成及生物活性5.杂环或大位阻基团固定硝基位向的新型新烟碱类化合物的分子设计,合成及生物活性因版权原因,仅展示原文概要,查看原文内容请购买。