人类对原子结构的认识
- 格式:doc
- 大小:240.53 KB
- 文档页数:8

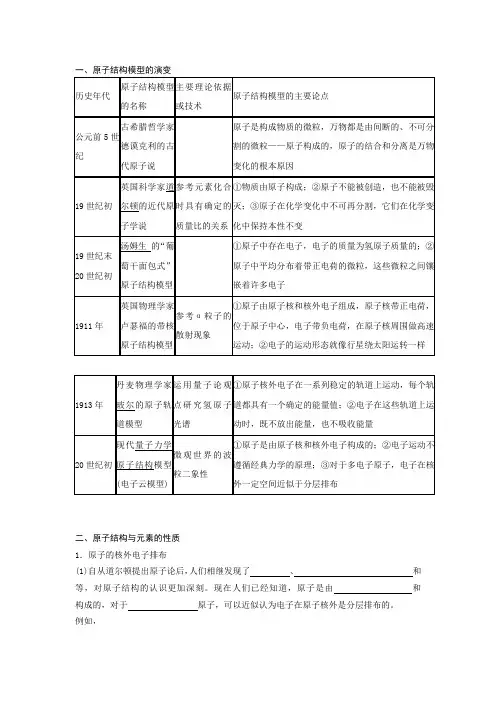
一、原子结构模型的演变历史年代原子结构模型的名称主要理论依据或技术原子结构模型的主要论点公元前5世纪古希腊哲学家德谟克利的古代原子说原子是构成物质的微粒,万物都是由间断的、不可分割的微粒——原子构成的,原子的结合和分离是万物变化的根本原因19世纪初英国科学家道尔顿的近代原子学说参考元素化合时具有确定的质量比的关系①物质由原子构成;②原子不能被创造,也不能被毁灭;③原子在化学变化中不可再分割,它们在化学变化中保持本性不变19世纪末20世纪初汤姆生的“葡萄干面包式”原子结构模型①原子中存在电子,电子的质量为氢原子质量的;②原子中平均分布着带正电荷的微粒,这些微粒之间镶嵌着许多电子1911年英国物理学家卢瑟福的带核原子结构模型参考α粒子的散射现象①原子由原子核和核外电子组成,原子核带正电荷,位于原子中心,电子带负电荷,在原子核周围做高速运动;②电子的运动形态就像行星绕太阳运转一样1913年丹麦物理学家玻尔的原子轨道模型运用量子论观点研究氢原子光谱①原子核外电子在一系列稳定的轨道上运动,每个轨道都具有一个确定的能量值;②电子在这些轨道上运动时,既不放出能量,也不吸收能量20世纪初现代量子力学原子结构模型(电子云模型)微观世界的波粒二象性①原子是由原子核和核外电子构成的;②电子运动不遵循经典力学的原理;③对于多电子原子,电子在核外一定空间近似于分层排布二、原子结构与元素的性质1.原子的核外电子排布(1)自从道尔顿提出原子论后,人们相继发现了、和等,对原子结构的认识更加深刻。
现在人们已经知道,原子是由和构成的,对于原子,可以近似认为电子在原子核外是分层排布的。
例如,(2)核外电子排布的表示方法——结构示意图人们常用原子结构示意图表示原子的核外电子排布,如氧原子的结构示意图为,钠原子的结构示意图为。
2.元素的化学性质与原子核外电子排布的关系(1)稀有气体元素原子最外层电子数为8(氦为2),是稳定结构,不易得失电子,因此化学性质稳定,一般不跟其他物质发生化学反应。


《人类对原子结构的认识》知识清单一、早期的原子学说在人类探索物质构成的漫长历史中,早期的原子学说为后来对原子结构的深入研究奠定了基础。
古希腊哲学家德谟克利特最早提出了“原子”的概念,他认为原子是构成物质的最小、不可再分的单元。
然而,这种观点在当时更多的是一种哲学上的思辨,缺乏科学的实验依据。
二、道尔顿的原子学说19 世纪初,英国科学家道尔顿提出了较为系统的原子学说。
道尔顿认为:1、物质是由原子组成的,原子不能被创造、毁灭或分割。
2、同种元素的原子具有相同的质量和性质,不同元素的原子质量和性质不同。
3、不同元素的原子以简单整数比相结合,形成化合物。
道尔顿的原子学说为近代化学的发展奠定了重要的基础,使化学从定性研究走向定量研究。
三、汤姆生的“葡萄干布丁”模型19 世纪末,汤姆生发现了电子。
这一发现打破了原子不可再分的观念。
汤姆生提出了原子的“葡萄干布丁”模型,他认为:1、原子是一个球体,正电荷均匀分布在整个球体内。
2、电子像葡萄干一样镶嵌在球体内。
四、卢瑟福的核式结构模型卢瑟福通过著名的α粒子散射实验,对原子结构有了新的认识。
实验结果表明:1、大多数α粒子穿过金箔后仍沿原来的方向前进。
2、少数α粒子发生了较大角度的偏转。
3、极少数α粒子甚至被反弹回来。
基于这些实验结果,卢瑟福提出了原子的核式结构模型:1、原子的中心有一个很小的原子核,几乎集中了原子的全部质量和正电荷。
2、电子在原子核外绕核高速运动。
五、玻尔的原子模型丹麦物理学家玻尔在卢瑟福模型的基础上,引入了量子化的概念。
玻尔的原子模型要点包括:1、原子中的电子只能在特定的轨道上运动,这些轨道的能量是量子化的。
2、电子在不同轨道上运动时,原子处于不同的能量状态,即定态。
3、当电子从一个能量较高的定态跃迁到一个能量较低的定态时,会辐射出一定频率的光子;反之,吸收光子。
六、现代原子结构模型随着科学技术的不断发展,现代原子结构模型更加完善和精确。
我们知道:1、原子核由质子和中子组成。

人类对原子结构的认识——原子结构模型的演变人类对原子结构的认识是一个逐步演变的过程。
从古希腊时期开始,人们对原子的概念就存在一定的认识,但是直到近代才逐渐了解原子的真正本质和结构。
本文将从古希腊时期的原子概念开始,主要介绍原子结构模型的演变过程,包括汤姆逊模型、卢瑟福模型和波尔模型,直到现代的量子力学模型。
古希腊时期,由于实验条件的限制,人们对原子的概念还比较朦胧。
古代哲学家德谟克利特首次提出“原子”的概念,原子是构成世界万物的最基本单位,它们具有不可分割的性质。
然而,这仅仅是一种哲学上的假设,没有经过科学实验的验证。
到了19世纪末,随着科学实验技术的进步,科学家对原子的理解逐渐深入。
在这个时期,英国科学家约翰·道尔顿提出了道尔顿原子论。
他认为,所有物质都是由不可分割的小颗粒(道尔顿原子)构成的,每种物质由不同类型的原子组成。
这个理论为解释化学反应和元素周期性表提供了重要的基础。
然而,到了20世纪初,科学家们发现了一些无法用道尔顿原子论解释的实验现象。
1904年,英国物理学家汤姆逊提出了汤姆逊模型,也被称为“葡萄干糕布模型”。
他认为,原子是一个正电荷球体,而电子则均匀地分布在球体内部,就像葡萄干糕布一样。
这个模型解释了电子的存在和负电荷,但没有考虑到原子中的正电荷分布。
1909年,英国物理学家卢瑟福进行了著名的金箔散射实验,这个实验改变了人们对原子结构的认识。
实验结果表明,大部分α粒子通过金箔而无明显偏转,但一小部分α粒子发生了大角度的散射。
基于这个实验结果,卢瑟福提出了卢瑟福模型,也被称为“太阳系模型”。
他认为,原子是由一个小而密集的带正电荷的核心,以及围绕核心运动的电子组成。
这个模型解释了实验结果,卢瑟福还通过核和电子的质量和电荷比计算出了核的大小。
然而,卢瑟福模型仍然存在一些问题。
根据经典电磁理论,一个加速的电子应该会辐射能量并从核中坠落,但事实上我们并没有看到这种现象。
为了解决这个问题,1913年,丹麦物理学家尼尔斯·波尔提出了波尔模型。

人类对原子结构的认识经历了一个漫长而曲折的历程。
从古希腊哲学家德谟克里特提出的“原子论”到现代量子力学的发展,人类对原子结构的认识不断深化和完善。
公元前5世纪,古希腊哲学家德谟克里特提出了“原子论”,认为宇宙万物都是由不可再分的、永恒的、微小的原子组成的。
这一理论为后来的原子结构研究奠定了基础。
然而,由于当时的科学技术水平有限,人们对原子结构的认识仅停留在宏观层面,无法揭示原子内部的奥秘。
19世纪初,英国科学家约翰·道尔顿提出了“道尔顿原子模型”,将原子划分为带正电荷的质子和带负电荷的电子,这是人类对原子结构认识的第一次重大突破。
随后,奥地利物理学家欧文·朗缪尔提出了“朗缪尔原子模型”,引入了原子核的概念,进一步揭示了原子内部结构的复杂性。
20世纪初,丹麦物理学家尼尔斯·玻尔提出了“玻尔原子模型”,将电子围绕原子核的运动分为不同的能级,解释了氢光谱现象。
这一模型被认为是量子力学的雏形,为后来的原子结构研究奠定了基础。
1927年,美国物理学家埃尔温·薛定谔提出了“薛定谔方程”,奠定了量子力学的基础。
薛定谔方程描述了微观粒子(如电子)在特定势场中的运动规律,为揭示原子内部结构提供了理论依据。
在此基础上,德国物理学家沃纳·海森堡、马克斯·玻恩等人提出了著名的“不确定性原理”,揭示了微观世界的非确定性特征。
随着科学技术的不断发展,人类对原子结构的认识也在不断深入。
20世纪中叶,美国物理学家罗伯特·塞格瑞等人提出了“塞格瑞模型”,将原子核分为质子和中子,解释了原子核的稳定性问题。
此外,科学家们还发现了反物质、超重元素等新的物质形态,丰富了人类对原子结构的认识。
总之,人类对原子结构的认识经历了一个漫长而曲折的历程。
从古希腊哲学家德谟克里特的“原子论”到现代量子力学的发展,人类对原子结构的认识不断深化和完善。
在未来,随着科学技术的进一步发展,人类对原子结构的认识必将更加深入,为人类探索宇宙奥秘提供更多的理论支持。

第1讲人类对原子结构的认识1.构成物质的微粒构成物质的微粒有原子、分子和离子。
原子是化学变化中的最小微粒,能直接构成物质,如金刚石、石墨等。
分子是构成物质的一种微粒,更多的研究结果表明,分子是由原子结合而成的,如:He、O2、O3、H2O、CO2、H2SO4等。
原子可以通过得到或失去电子形成离子,离子也是构成物质的微粒,如氯化钠就是由Na+和Cl-构成的。
2.原子原子的英文名(Atom)是从äτομοζ(atomos,“不可切分的”)转化而来。
很早以前,希腊和印度的哲学家就提出了原子的不可切分的概念。
17和18世纪时,化学家发现了物理学的依据:对于某些物质,不能通过化学手段将其继续的分解。
19世纪晚期和20世纪早期,物理学家发现了亚原子粒子以及原子的内部结构,由此证明原子并不是不能进一步切分。
原子是一种元素能保持其化学性质的最小单位,一个原子包含有一个致密的原子核及若干围绕在原子核周围带负电的电子,原子核由带正电的质子和电中性的中子组成。
在原子中,质子数与电子数相同,原子表现为电中性。
如果质子数和电子数不相同,就成为带有正电荷或者负电荷的离子。
根据质子和中子数量的不同,原子的类型也不同,质子数决定了该原子属于哪一种元素。
原子是一个极小的物体,其质量也很微小,原子的99.9%的重量集中在原子核,其中的质子和中子有着相近的质量,目前可用扫描隧道显微镜观察并拨动单个原子,下图为超高真空多功能扫描隧道显微镜,中图为显微镜下的硅原子结构,右图为在扫描隧道显微镜下科学家拨动49个铁原子排列在钢表面上形成的一个圆形栅栏。
1.原子的组成原子是化学反应中的最小微粒,在化学反应中不可分割。
科学研究表明,绝大多数原子的原子核由质子和中子构成,质子、中子和电子的质量、所带电荷各不相同。
1个质子带1个单位的正电荷,1个电子带1个单位的负电荷,中子不显电性。
原子核内的质子数与原子核外的电子数相等,所以原子呈电中性。

《人类对原子结构的认识》说课稿尊敬的各位评委老师:大家好!今天我说课的题目是《人类对原子结构的认识》。
下面我将从教材分析、学情分析、教学目标、教学重难点、教法与学法、教学过程以及教学反思这几个方面来展开我的说课。
一、教材分析“人类对原子结构的认识”是化学学科中的重要基础知识,对于学生理解化学物质的组成、性质和变化规律具有关键作用。
本节课所在的教材章节,是在学生已经初步了解了化学元素和物质的基本概念之后,进一步引导学生深入探究物质的微观结构。
通过对原子结构的学习,为后续学习化学键、化学反应原理等内容奠定了基础。
教材内容编排上,首先回顾了历史上科学家们对原子结构的探索历程,然后逐步引入现代原子结构模型的相关知识,如核外电子排布规律等。
这种编排方式既体现了科学知识的发展脉络,又符合学生的认知规律。
二、学情分析学生在初中阶段已经对原子的构成有了初步的认识,知道原子由原子核和核外电子构成。
但对于原子结构的深入理解,如电子的分层排布、原子结构与元素性质的关系等,还需要进一步的学习和探究。
在思维能力方面,高中生已经具备了一定的抽象思维和逻辑推理能力,但对于微观世界的想象和理解仍存在一定的困难。
因此,在教学中需要通过多种教学手段,帮助学生建立起清晰的原子结构概念。
三、教学目标1、知识与技能目标(1)了解原子结构模型的演变历程。
(2)理解原子核外电子的排布规律。
(3)掌握原子结构与元素性质的关系。
2、过程与方法目标(1)通过对原子结构模型演变的学习,培养学生的科学思维和创新能力。
(2)通过对核外电子排布规律的探究,提高学生的观察、分析和归纳能力。
3、情感态度与价值观目标(1)感受科学家们在探索原子结构过程中的执着和创新精神,激发学生对科学的热爱和追求。
(2)培养学生的辩证唯物主义世界观,认识到科学理论是不断发展和完善的。
四、教学重难点1、教学重点(1)原子结构模型的演变。
(2)原子核外电子的排布规律。
2、教学难点(1)核外电子排布规律的应用。
人类对原子结构的认识难点突破首先,了解原子结构模型的演变,认识几种结构模型,主要有:(1)古希腊科学家提出的物质由原子构成的猜想是人们对原子结构认识的初始阶段。
(2)道尔顿提出了“实心原子”这一观点。
(3)汤姆生发现电子后提出“葡萄干面包式”原子模型。
(4)卢瑟福提出“核式”原子结构模型。
(5)玻尔把量子说引入核式结构的原子模型。
其次,掌握原子的核外电子排布是依能量的不同,原子内的电子分层排布,其主要规律是:(1)核外电子总是尽先排布在能量较低的电子层,然后由里向外,依次排布在能量逐步升高的电子层(能量最低原理)。
(2)原子核外各电子层最多容纳2n2个电子。
(3)原子最外层电子数目不超过8个(K层为最外层时不能超过2个电子)。
(4)次外层电子数目不能超过18个(K层为次外层时不能超过2个),倒数第三层电子数目不能超过32个。
最后,明确元素的性质与元素的原子核外电子排布的关系:(1)稀有气体的不活泼性:原子最外层有8个电子(氦是2个电子),处于稳定结构。
(2)金属元素最外层少于4个电子,易失电子,表现金属性,非金属元素最外层多于4个电子,易得电子,表现非金属性。
对几个概念的理解注意:①单位1(一般不写出);②粒子:可以是原子、质子、中子、电子等;③质子、中子的相对质量约为1。
可从表格形式清楚了解原子的构成:熟练掌握元素的相对原子质量的计算:×a1%+×a2%+…………为核素的相对原子质量a1%、a2%……为核素的原子百分数或核素原子的物质的量分数氕、氘、氚三种原子的质子数相同,中子数不同,都属于氢元素,因为它们的质子数相同。
归纳与拓展核外电子数相同的微粒核外电子总数为10个电子的微粒,常见的共有15种。
阳离子有:Na+、Mg2+、Al3+、N、H3O+;阴离子有:N3-、O2-、F-、OH-、N;分子有:Ne、HF、H2O、NH3、CH4。
核外电子总数为18个电子的微粒,常见的共有16种。
课后分层练2.3 人类对原子结构的认识1.人们对原子结构的认识是一个不断深入的过程,下列先后顺序符合史实的是( ) ①道尔顿提出原子学说 ①卢瑟福提出带核的原子结构模型 ①玻尔研究氢原子光谱,提出电子分层排布模型 ①汤姆生提出被称为“葡萄干面包式”的原子结构模型A .①①①①B .①①①①C .①①①①D .①①①① [答案] B[解析] 19世纪初,道尔顿提出原子学说,1897年汤姆生提出了被称为“葡萄干面包式”的原子结构模型,1911年卢瑟福提出了带核的原子结构模型,1913年玻尔提出电子分层排布模型,B 正确。
2.下列离子中电子数大于质子数且质子数大于中子数的是( )A .D 163O +B .Li +C .16OD -D .16OH - [答案] D[解析] 电子数大于质子数的粒子必为阴离子,排除A 、B 两项。
C 项,16OD -中质子数为9,中子数为9;D 项,16OH -中质子数为9,中子数为8,符合题意。
3.2016年IUPAC 命名117号元素为Ts(中文名“”,tián),Ts 的原子核外最外层电子数是7。
下列说法不正确的是( )A .Ts 原子核内质子数为117B .Ts 的同位素原子具有相同的电子数C .Ts 是非金属元素D .中子数为176的Ts 核素符号是176117Ts[答案] D[解析] 该元素的原子序数为117,原子核内质子数为117,A 正确;互为同位素的原子具有相同的质子数和电子数,B 正确;由该元素的偏旁为“石”知该元素为非金属元素,C正确;中子数为176的Ts的质量数为117+176=293,则核素符号为293117Ts,D错误。
4.铋(Bi)在医药方面有重要应用,下列关于20983Bi和210 83Bi的说法正确的是()A.209 83Bi和210 83Bi都含有83个中子B. 209 83Bi和210 83Bi互为同位素C. 209 83Bi和210 83Bi的核外电子数不同D. 209 83Bi和210 83Bi分别含有126和127个质子[答案]B[解析]A项,根据原子的表示方式可知,左下角为质子数,中子数=质量数-质子数,两个原子的中子数分别是209-83=126、210-83=127,故错误;B项,同位素是质子数相等,中子数不同的同种元素的不同核素,故正确;C项,质子数等于核外电子数,质子数相等,因此核外电子数相等,故错误;D项,质子数都是83,故错误。