第四章 热力学第二定律
- 格式:pdf
- 大小:484.44 KB
- 文档页数:43



第四章热力学第二定律主要内容:4.1 自发过程及热力学第二定律4.2 卡诺循环与卡诺定理4.3熵的概念4.4Clausius不等式及熵增加原理4.5 熵变的计算及熵的物理意义4.6 热力学第三定律与规定熵4.7 亥姆霍兹能及吉布斯能4.8 热力学基本方程及麦克斯韦关系式4.9吉布斯自由能及温度、压力的关系§4.1 自发过程及热力学第二定律自发过程热力学第二定律1. 自发过程自发过程无需依靠消耗环境的作用(即不借助外力),就能自动进行的过程。
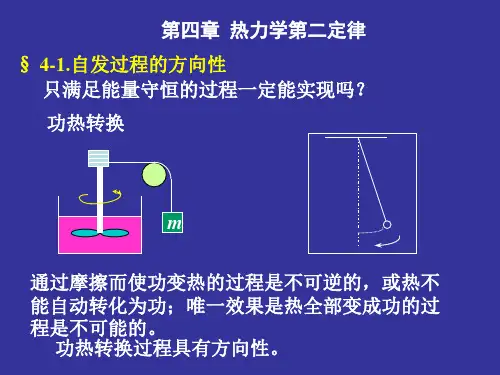
(1) 焦耳热功当量中功自动转变成热;(2) 气体向真空膨胀;(3) 热量从高温物体传入低温物体;(4) 浓度不等的溶液混合均匀;(5) 锌片与硫酸铜的置换反应等,它们的逆过程都不能自动进行。
当借助外力,系统恢复原状后,会给环境留下不可磨灭的影响。
自发过程的特征:1)自发过程总是单向趋于平衡;2)自发过程均具有不可逆性;3)自发过程具有对环境作功的能力,如配有合适的装置,则可从自发过程中获得可用的功。
如:温度传递;气体流动;系统自发过程达到平衡后,无环境作用系统是不可能自动反方向进行并回到原来状态;自发过程的不可逆性是指自然界中所有自发过程都具有热力学的不可逆性;2. 热力学第二定律克劳修斯(Clausius) 的说法:“不可能把热从低温物体传到高温物体,而不引起其它变化。
”—热传导的不可逆性开尔文(Kelvin)的说法:“不可能从单一热源取出热使之完全变为功,而不发生其它的变化。
”—摩擦生热的不可逆性二者说法是等效的,均指明某种自发过程的逆过程是不能自动进行的重要结论: (1)均指明过程的方向性;(2)自发过程存在内在的联系,可以从某一自发过程的不可逆性,便可以推导出其它自发过程的不可逆性。
理解:♦并非“功可以转变为热,而热不能完全变为功”,而是在不引起其它变化的条件下,热才不能完全转变为功。
如:理想气体等温膨胀。
♦第二类永动机:从单一热源吸热使之完全变为功而不留下任何影响。

第四章热力学第二定律(Second law of thermodynamics)楼塌熵增§4.1自然过程的方向性(Directionality of Natural Process)§4.2不可逆性的相互依存(Interdependence of Irreversibility)一、热力学第二定律的开尔文表述K二、热力学第二定律的克劳修斯表述C三、C、K两种表述是等价的四、热力学第二定律的适用范围现代天文学表明,宇宙的温度是千变万化的,有热量放射的地方,就有能量重新集结的地方,以其它形式贮存起来。
§4.3热力学第二定律及其微观意义(Second Law of Thermodynamics and ItsMicro Meaning)热力学第二定律的微观统计意义热力学第二定律的微观统计意义一切自然过程总是沿着分子热运动的序性增大的方向进行。
说明1、第二定律是统计规律,只对大量分子适用。
2、第二定律阐明热力学过程进行的条件和方向。
3、第二定律否定了第二类永动机(单热源热机)4、任何一种不可逆过程的描述对于第二定律都等效。
§4.4热力学概率与自然过程的方向(Thermodynamic Probability andDirection of Natural Processes)结论1、一个宏观状态可以有许多微观状态对应。
2、分子数越多,和一个宏观状态对应的微观状态数越多。
3、每一个宏观状态对应的微观状态数不同。
4、左、右分子数差不多相等的宏观状态对应的微观状态数最多。
均匀分布对应的微观态数最多。
全部退回一边仅对应一种微观态。
统计结果1、分子数越多,左、右分子数差不多相等的宏观状态对应的微观状态数占微观状态总是总数的比例越大。
2、对于实际系统1023,这个比例几乎是100%§4.5玻耳兹曼熵与熵增加原理(Boltzmann Entropy and Principle of Entropy Increase)一. 热力学概率Ω任一宏观状态所对应的微观状态数,称为该宏观状态的热力学概率。



4、3 热力学第二定律4、4描述无序程度的物理量学习目标知识脉络1、明白热传递及宏观过程的方向性、(重点)2。
理解热力学第二定律的两种不同的表述,以及这两种表述的物理实质、(重点、难点)3、明确什么是有序和无序,理解热力学第二定律的微观意义。
(难点)4、了解熵的概念。
热力学第二定律1、自然过程的方向性(1)热传递具有方向性:热量能够自发地从高温物体传到低温物体,却不估计自发地从低温物体传到高温物体、(2)一切自发过程都是有方向性的,是不可逆的、2、热机(1)定义:一种把内能转化为机械能的装置、(2)理想热机的工作原理:热机从热源吸收热量Q1,推动活塞做功W,然后向低温热源(冷凝器)释放热量Q2。
(3)效率:由能量守恒定律知:Q1=W+Q2,而我们把热机做的功W和它从热源的比值叫做热机效率,用η表示,即η=\f(W,Q1)、吸收的热量Q1(4)热机不估计把它得到的全部内能转化为机械能,即效率不估计达到100%、3。
热力学第二定律(1)克劳修斯表述:不估计使热量从低温物体传到高温物体,而不引起其他变化。
此表述揭示出热传递具有方向性、(2)开尔文表述:不估计从单一热源吸收热量并把它全部用来做功,而不引起其他变化、此表述揭示出能量在转化过程中具有方向性、(3)第三种表述:第二类永动机是不估计制成的、错误!1。
温度不同的两个物体接触时,热量会自发地从低温物体传给高温物体、(×)2、热传导的过程是具有方向性的、(√)3、热量不能由低温物体传给高温物体、(×)\o([后考虑])热量能自发地从高温物体传给低温物体,我们所说的“自发地”指的是没有任何的外界影响或者帮助。
电冰箱是让“热”由低温环境传递到高温环境、这是不是自发进行的?说明理由。
图4、3。
1【提示】电冰箱能够把热量从低温物体传给高温物体,在该过程中电冰箱要消耗电能。
一旦切断电源,电冰箱就不能把其内部的热量传给外界的空气了,相反,外界的热量会自发地传给电冰箱,使其温度逐渐升高、1、对热力学第二定律的理解(1)克劳修斯表述指明热传递等热力学宏观现象的方向性,不需要借助外界提供能量的帮助,其物理本质是揭示了热传递过程是不可逆的。


