大学化学之电化学基础 (2).ppt
- 格式:ppt
- 大小:3.60 MB
- 文档页数:129








第2讲电化学基础——原电池一、原电池1.能量的转化原电池:将化学能转变为电能的装置。
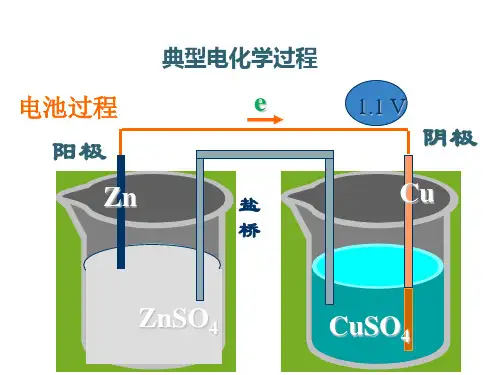
2.工作原理原理:设计一种装置,使氧化还原反应所释放的能量直接转变为电能,即使氧化反应和还原反应分别在两个不同的区域进行,并使其间电子转移,在一定条件下形成电流。
说明:(1)(2)3.组成条件(1)两个活泼性不同的电极,分别发生氧化和还原反应。
(2)电解质溶液,电解质中阴离子向负极方向移动,阳离子向正极方向移动,阴阳离子定向移动成内电路。
(3)导线将两电极连接,形成闭合回路。
4.几种常见的电池(1)一次电池:碱性锌锰电池构成:负极是锌,正极是MnO2,电解质是KOH负极:正极:总反应式:Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2(2)二次电池①铅蓄电池放电电极反应:负极:正极:总反应式:Pb(s)+PbO 2(s)+2H 2SO 4(aq)=2PbSO 4(s)+2H 2O(l)充电电极反应:阳极:阴极:总反应:2PbSO 4(s)+2H 2O(l)=Pb(s)+PbO 2(s)+2H 2SO 4(aq)②镍一镉碱性蓄电池负极:正极:总反应式:Cd +2NiO(OH)+2H 2O2Ni(OH)2+ Cd(OH)2(5)锂电池 参考练习:1.某原电池装置如右图所示。
下列有关叙述中,正确的是A .Fe 作正极,发生氧化反应B .负极反应: 2H + + 2e -=H 2↑C .工作一段时间后,两烧杯中溶液pH 均不变D .工作一段时间后,NaCl 溶液中c (Cl -)增大2.某固体酸燃料电池以CsHSO 4固体为电解质传递H+,其基本结构见右图,电池总反应可表示为:2H 2+O 2=2H 2O ,下列有关说法正确的是A .电子通过外电路从b 极流向a 极B .b 极上的电极反应式为:O 2+2H 2O+4e -=4OH -C .每转移0.1 mol 电子,消耗1.12 L 的H 2D .H +由a 极通过固体酸电解质传递到b 极3.Li-Al/FeS 电池是一种正在开发的车载电池,该电池中正极的电极反应式为:2Li ++FeS+2e -=Li 2S+Fe 有关该电池的下列说法中,正确的是A .Li-Al 在电池中作为负极材料,该材料中Li 的化合价为+1价B .该电池的电池反应式为:2Li+FeS =Li 2S+FeC .负极的电极反应式为:Al-3e -=Al 3+D .正极发生的电极反应式为:Li 2S+Fe-2e -=2Li ++FeS4.某燃料电池所用的原料为H 2和空气(含一定量的CO 2),电解质为熔融的K 2CO 3。