高三化学电化学基础ppt
- 格式:ppt
- 大小:1.04 MB
- 文档页数:106





4.1.1 氧化值确定元素氧化数的规则氧化数与化合价原子数目比例关系整数可以为分数4.1.2 氧化还原反应的近代概念得电子+2e-2e失电子氧化还原方程式的配平原子数目得电子数等于失电子数不能在酸性溶液中配平氧化还原方程1、写出氧化-还原半反应2、配平氧化-还原半反应3、两个半反应乘相应系数(使得失电子数相等)相加×5 +×24、添加不参与反应的离子,配平方程式:(在酸性溶液中只可利用H+和HO配平)21、写出氧化-还原半反应2、配平氧化-还原半反应3、两个半反应乘相应系数(使得失电子数相等)相加×1×2 +444、添加不参与反应的离子,配平方程式:(在碱性溶液中只可利用OH-和H2O来配平)4.2.1原电池的构造及工作原理把化学能直接变为电能的装置叫做原电池。
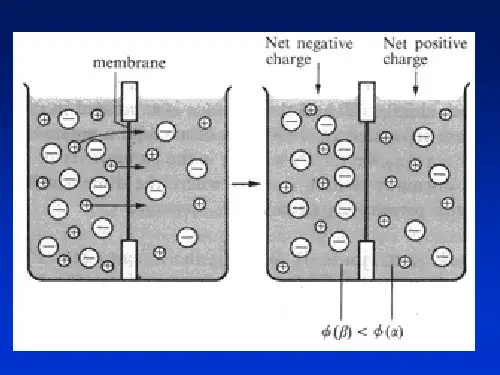
原电池的组成:盐桥的作用4.2.2 原电池的电极反应和电池反应电极反应电池反应:氧化还原电对4.2.3 电池的符号与电极的种类电极的组成和种类对于(2) (3) (4),在组成电极时常需外加导电体材料如Pt 、C(石墨); 石墨、铂叫辅助电极。
电池符号和电极符号原电池的装置可用电池符号来表示。
铜锌原电池的图式记为: (-) Zn | ZnSO4 (c1) || CuSO4 (c2) |Cu (+) 同一个铜电极 在铜锌原电池中作为正极,表示为CuSO4 (c1) | Cu(+) 在银铜原电池中作为负极,表示为 (-)Cu | CuSO4 (c1)高氧化态离子靠近盐桥,低氧化态离 子靠近电极,中间用“,”分开。
如何将化学反应设计成电池1、根据元素氧化数的变化,确定氧化-还原电对(必要时可在方程式两边加同一物质); 2、由氧化-还原电对确定可逆电极,确定电解质溶液,设计成可逆电池(双液电池必须加盐桥); 3、检查所设计电池反应是否与原反应吻合。
例:将反应表示成原电池V(1) Ni + Fe3+→ Ni2++ Fe2+Sn2+Sn4+(-) Ni | Ni2+ (c1) || Fe3+ (c2) ,Fe2+ (c3) | Pt (+)Mn2+ MnO4H+(2) Sn2+ + MnO4- + H+ → Sn4+ + Mn2+ +H2O(-) Pt | Sn2+ (c1) , Sn4+ (c2) || MnO4- (c3), Mn2+ (c4 ) , H+(c5) |Pt(+)4.2.4 可逆电池及其电动势可逆电池两个条件: 1、电化学反应是可逆的; 2、通过电池的电流无限小。