无论反应物是电对中的氧化态,还是其还原态,
氧化还原电对的EΘ的符号不变。
2Fe3+ + Sn2+ → 2Fe2+ + Sn4+
22
(2)电极组成:
正极:Pt│MnO4- (c1),Mn2+(c2),H+ (c3) 负极:Pt, O2 (p)│ H2O2 (c4), H+ (c3)
(3)电池符号:
(-)Pt, O2 (p)│ H2O2 (c4), H+ (c3)‖ MnO4- (c1),Mn2+(c2),H+ (c3) │ Pt(+)
×2) MnO4- +8H+ + 5e = Mn2+ +4H2O + ×5) SO32- + H2O = SO42- + 2H+ + 2e
2MnO4-+5SO32-+6H+ = 2Mn2++5SO42-+3H2O
例2 配平下列氧化还原反应:
H2S + H2SO3 → S + H2O H2S - 2e → S + 2H+ ① H2SO3 + 4H+ + 4e → S + 3H2O ②
25
5.3 电极电势 5.3.1 电极电势的产生 5.3.2 标准电极电势 5.3.3 Nernst方程式
26
5.3 电极电势
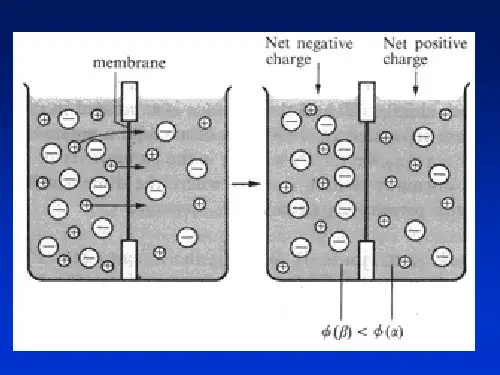
5.3.1 电极电势的产生 1.电极的双电层结构
+++++ +++++
+++++ +++++
----- -----
-----
---
(a)溶解>沉积