脂肪酶测定试剂盒(甲基试卤灵底物法)产品技术要求zhongshengbeikong
- 格式:docx
- 大小:13.25 KB
- 文档页数:3

脂肪酶测定试剂盒(甲基试卤灵底物法) 适用范围:用于体外定量测定人血清中脂肪酶的活性。
1.1规格试剂1:2×60mL,试剂2:1×60mL;试剂1:2×60mL,试剂2:2×15mL;试剂1:3×40mL,试剂2:1×30mL;试剂1:2×60mL,试剂2:2×12mL;试剂1:2×60mL,试剂2:2×20mL;试剂1:1×45mL,试剂2:1×15mL;试剂1:1×4L,试剂2:1×1L;试剂1:2×4L,试剂2:1×2L。
1.2主要组成成分试剂1主要组分:试剂2主要组分:2.1 净含量应不低于试剂瓶标示装量。
2.2 外观试剂1:无色或淡黄色透明溶液;试剂2:无色或淡黄色透明溶液。
外包装完好、无破损,标签完好、字迹清晰。
2.3 试剂空白2.3.1 试剂空白吸光度在570nm处测定试剂空白吸光度,应≤0.9;2.3.2 试剂空白吸光度变化率试剂空白吸光度变化率△A/min≤0.5。
2.4 分析灵敏度测试50U/L的被测物时,吸光度变化率(ΔA/min)应不低于0.0025 。
2.5 准确度在样品中加入一定体积的纯品,计算回收率,应介于90%-110%之间。
2.6 重复性批内变异系数(CV)应不超过10%。
2.7 线性2.7.1在[5,500]U/L区间内,线性相关系数r应不低于0.990;2.7.2[5,60)U/L区间内绝对偏差不超过±7.2U/L;[60,500]U/L区间内相对偏差不超过±12%。
2.8 批间差对同一份样品进行重复测定,相对极差不大于12%。
2.9 稳定性取在2℃~8℃条件下贮存达到12个月后的试剂进行检测,应符合本标准2.2、2.3、2.4、2.5、2.6、2.7之规定。

脂肪酶测定试剂盒(甲基试卤灵底物法)适用范围:用于体外定量测定人血清中脂肪酶的活性。
1.1规格
1.2组成
2.1 外观
2.1.1试剂1:无色液体,无浑浊,无不溶物。
2.1.2试剂2:黄色液体,无浑浊,无不溶物。
2.1.3包装外观应整洁,标签字迹清晰,不易脱落。
2.2 净含量
液体试剂的净含量不低于标示体积。
2.3 试剂空白
2.3.1试剂空白吸光度
试剂空白吸光度≤0.5。
2.3.2试剂空白吸光度变化率
试剂空白吸光度变化率(ΔA/分)≤0.05。
2.4 分析灵敏度
样本浓度为50 U/L时,ΔA/分≥0.01。
2.5 线性区间
在[5,300] U/L范围内,线性相关系数r≥0.990;测试浓度在[5,50] U/L时,绝对偏差不超过±5 U/L,测试浓度在(50,300] U/L时,相对偏差不超过±10%。
2.6 精密度
2.6.1 批內精密度
用高、中、低3个浓度的样本测试试剂盒,各重复测试10次,其变异系数(CV)
应不大于10%。
2.6.2批间差
用样本分别测试3个不同批次的试剂盒,每个批次测试3次,其相对极差(R)应不大于10%。
2.7 准确度
回收率在85%-115%范围内。
2.8稳定性
原包装试剂盒在2℃~8℃避光保存条件下有效期为12个月。
有效期满后3个月内测试,应满足2.3、2.4、2.5、2.6.1和2.7的要求。
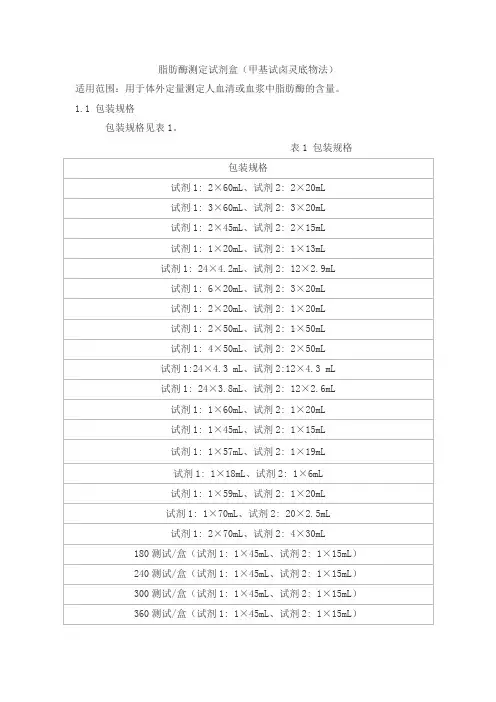
脂肪酶测定试剂盒(甲基试卤灵底物法)适用范围:用于体外定量测定人血清或血浆中脂肪酶的含量。
1.1 包装规格包装规格见表1。
表1 包装规格1.2 试剂成分试剂成分见表2。
表2 试剂成分注:不同批号的校准品、质控品赋值有差异。
2.1 外观试剂1为无色澄清液体,目测不得有任何沉淀及絮状悬浮物;试剂2为橘黄色到橘红色液体,目测不得有任何沉淀及絮状悬浮物;校准品为黄色粉末状物质,复溶后为淡黄色或黄色液体,目测不得有任何沉淀及絮状悬浮物;质控品微黄色粉末状物质,复溶后为淡黄色或黄色液体,目测不得有任何沉淀及絮状悬浮物。
试剂盒标签标识清晰,外包装完整无损。
2.2 净含量试剂的净含量应不少于标称量。
2.3 试剂空白吸光度A570nm下测定空白吸光度应≤ 0.8000。
2.4 准确度与已上市产品进行比对试验:在[5,300]U/L区间内,线性相关系数r≥0.975,在[5,50]U/L区间内测定的绝对偏差应不超过±7.5U/L,在(50,300]U/L 区间内测定的相对偏差应不超过±15%。
2.5 分析灵敏度样本浓度为100 U/L时,其吸光度变化率在0.0150~0.0450之间。
2.6 线性区间在[5,300]U/L区间内,线性相关系数r≥0.990,在[5,50]U/L区间内测定的绝对偏差应不超过±7.5U/L,在(50,300]U/L区间内测定的相对偏差应不超过±15%。
2.7 测量精密度2.7.1重复性对高、低浓度的血清样本或质控品重复测定10次,其测定值的变异系数(CV%)应不大于5%。
2.7.2批间差随机抽取三批试剂盒的批间相对极差(R)应不大于10%。
2.8 瓶间差校准品、质控品的瓶间差应≤10%。
2.9 稳定性2.9.1 效期稳定性试剂在2℃~25℃密封避光保存,校准品、质控品在2℃~8℃密封避光保存,有效期为12个月。
在试剂盒有效期满后一个月以内,分别检测2.1、2.3、2.4、2.5、2.6、2.7.1项,结果应符合各项目的要求。

脂肪酶测定试剂盒(甲基试卤灵底物法)适用范围:本试剂适用于体外定量测定人血清或血浆中脂肪酶活性。
1.1规格试剂1(R1):4×70ml 试剂2(R2):1×70ml试剂1(R1):4×50ml 试剂2(R2):2×25ml试剂1(R1):2×64ml 试剂2(R2):2×16ml试剂1(R1):2×80ml 试剂2(R2):1×40ml试剂1(R1):4×45ml 试剂2(R2):1×45ml试剂1(R1):1×64ml 试剂2(R2):1×16ml2.1外观2.1.1包装完整,标签清晰;2.1.2试剂1为无色透明溶液、无悬浮物、无沉淀物;试剂2为橘红色微乳液。
2.2净含量试剂盒内液体的装量应不低于标示值。
2.3试剂空白2.3.1 试剂空白吸光度用试剂盒测定空白样本,记录试剂盒在570nm波长条件下,试剂空白吸光度A应不大于0.50。
2.3.2 试剂空白吸光度变化率试剂吸光度变化率(△A/min)应不超过0.035。
2.4分析灵敏度测定50U/L样本时,吸光度变化率(△A/min)应符合:0.010~0.150。
2.5线性范围试剂盒线性范围在[3.0,300.0]U/L:线性相关系数r≥0.990;在[3.0,30]U/L线性范围内,绝对偏差不超过±3 U/L;在(30,300]U/L线性范围内,相对偏差不超过±10%。
2.6测量精密度2.6.1重复性用高、低2个水平的血清样品或质控品测试同一批号试剂盒,测试结果应符合CV≤10%。
2.6.2 批间差用3个不同批号的试剂盒测定同一份样本,测得结果极差R≤10%。
2.7准确度以选定的上市分析系统对照试剂作为比对方法进行方法学比对测试,比对结果应满足:a)在[3.0,300]U/L 范围内,线性相关系数r≥0.975;b)在[3.0,30]U/L 范围内,绝对偏差不超过±3 U/L;在(30,300]U/L范围内,相对偏差不超过±10%。

脂肪酶测定试剂盒(甲基试卤灵底物法)适用范围:本试剂盒用于体外定量测定人血清中的脂肪酶的活性浓度。
1.1产品规格1.2产品组成试剂1:BICN缓冲液(pH8.0)50mmol/L,脱氧胆酸钠1.6mmol/L,氯化钙10mmol/L,共脂肪酶≥1mg/L。
试剂2:酒石酸缓冲液(pH4.0)10mmol/L,牛黄脱氧胆酸盐8.8mmol/L,1,2-邻-二月桂基-消旋-甘油-3-戊二酸-(6-甲基试卤灵)酯0.27mmol/L。
2.1 外观试剂1为无色透明溶液,试剂2为黄色透明溶液;试剂盒各组分齐全、完整,液体无渗漏,包装标签文字符号清晰牢固不易脱落,外包装完整无破损。
2.2 装量液体试剂的净含量应不少于标示量。
2.3 试剂空白吸光度在37℃、570nm波长、1cm光径条件下,试剂空白吸光度应不大于0.80。
2.4分析灵敏度测定80U/L脂肪酶时,吸光度变化率在(0.04±0.02)/min范围内。
2.5 准确度采用比对试验,相关系数r≥0.98;[3,30]U/L区间内,线性绝对偏差不超过±3U/L;(30,300]U/L区间内,线性相对偏差不超过±10% 。
2.6 精密度2.6.1 重复性用血清样品或质控样品重复测试所得的变异系数(CV)应不大于10.0%。
2.6.2 批间差试剂(盒)批间相对极差应不大于10.0%。
2.7 线性区间试剂线性在[3,300]U/L(37℃)区间内:a) 线性相关系数|r|应不小于0.990;b) [3,30]U/L区间内,线性绝对偏差应不超过±3U/L;(30,300]U/L区间内,线性相对偏差应不超过±10%。
2.8稳定性原包装试剂2~8℃避光保存有效期12个月,到效期后的样品检测试剂空白、分析灵敏度、准确度、重复性、线性区间应符合2.3、2.4、2.5、2.6.1、2.7的要求。

脂肪酶(LPS)测定试剂盒(甲基试卤灵底物法)适用范围:本产品用于体外定量测定人血清或血浆中脂肪酶的含量。
1.1 包装规格试剂1(R1):2×40mL;试剂2(R2):2×20mL;校准品(选配):1×5mL。
1.2 主要组成成分试剂盒由试剂和校准品(选配)组成。
试剂1(R1):PB缓冲液:100mmol/L pH=7.2;牛磺脱氧胆酸:34mmol/L;NaCl:40mmol/L。
试剂2(R2)(启动液):酒石酸缓冲液:9.5mmol/L,pH=4.0;共脂肪酶:500KU/L;1,2邻-二月桂宗甘油-3-戊二酸-(6’-甲基试卤灵)-酯:0.20mmol/L。
校准品:单水平冻干品,在牛血清基质中添加脂肪酶,定值范围:(80~200)U/L。
稳定剂<0.1%。
注:校准品浓度具有批特异性,具体浓度见标签。
2.1 外观液体双试剂:试剂1(R1)(缓冲液):无色透明液体,试剂2(R2)(启动液):桔红色液体。
校准品:冻干品,溶解后无色至浅黄色液体。
2.2 净含量液体试剂的净含量不得低于标示体积。
2.3 溯源性根据GB/T 21415及有关规定提供校准品的来源、赋值过程及测量不确定度等内容,该校准品溯源至利德曼企业标准品,且与已上市产品比对赋值。
2.4 试剂空白2.4.1空白吸光度在37℃、(570nm±10%范围内的)波长、1cm光径条件下,用去离子水或(生理盐水)作为样品加入试剂测试时,试剂空白吸光度应<0.5 ABS。
2.4.2空白吸光度变化率在37℃、(570nm±10%范围内的)波长、1cm光径条件下,用去离子水或(生理盐水)作为样品加入试剂测试时,试剂空白吸光度变化率(ΔA/min)应≤0.015 ABS/min。
2.5 分析灵敏度浓度为50U/L时,吸光度变化范围在(0.01~0.15)之间。
2.6 线性在[4,700]U/L线性范围内,线性相关系数r2≥0.996。

脂肪酶测定试剂盒(甲基试卤灵底物法)适用范围:本产品用于体外定量测定人血清中脂肪酶的活性。
1.1 规格具体产品规格见下表:1.2 组成成分1.2.1 试剂的组成试剂1:BICINE 缓冲液≥50mmol/L牛磺脱氧胆酸≥3.4mmol/L去氧胆酸≥1.6mmol/L 氯化钙≥10mmol/L共脂肪酶≥1mg/L试剂2:1,2-邻-二月桂基甘油-3-戌二酸-(6'-甲基试卤灵)-酯≥0.20mmol/L酒石酸缓冲液≥9.5mmol/L牛磺脱氧胆酸≥8.8mmol/L稳定剂适量1.2.2 校准品的组成(选配)水平1:脂肪酶(20.0~60.0)U/L该校准品为血清基质冻干校准品水平2:脂肪酶(55.0~200.0)U/L该校准品为血清基质冻干校准品1.2.3 质控品的组成(选配)水平1:脂肪酶(20.0~60.0)U/L该质控品为血清基质冻干质控品水平2:脂肪酶(60.1~200.0)U/L该质控品为血清基质冻干质控品校准品、质控品有批特异性,具体靶值见靶值表。
2.1 外观2.1.1 外包装完整无破损;2.1.2 试剂1:无色澄清透明无杂质的液体;2.1.3 试剂2:黄色或橙色澄清无杂质的液体;2.1.4 校准品:白色或浅黄色冻干粉,复溶后为浅黄色溶液,无不溶物;2.1.5 质控品:白色或浅黄色冻干粉,复溶后为浅黄色溶液,无不溶物。
2.2 净含量净含量不低于标示值。
2.3 试剂空白2.3.1 试剂空白吸光度在主波长570nm、副波长700nm、37℃条件下,试剂空白吸光度不大于0.5;2.3.2 试剂空白吸光度变化率在主波长570nm、副波长700nm、37℃条件下,试剂空白吸光度变化率不大于0.01。
2.4 线性2.4.1 线性范围[20.0,200.0]U/L,相关系数r不小于0.990。
2.4.2 线性偏差(60.0,200.0]U/L线性范围内,相对偏差不超过±10%;[20.0,60.0]U/L线性范围内,绝对偏差不超过±6.0U/L。

脂肪酶测定试剂盒性能指标统计分析与建议杨笑鹤;何琼;寇艳芹;甄辉【摘要】对浙江省脂肪酶测定试剂盒产品技术要求中的性能指标进行汇总,采用调查问卷形式对产品的实际性能指标进行调研,从统计学角度对脂肪酶测定试剂盒最低性能指标的制定提出了建议.旨在为脂肪酶测定试剂盒行业标准的制订和监管工作的改进提供建议,为技术审评人员提供技术参考,为注册申请人对相关产品的风险控制提供指导.【期刊名称】《中国医疗器械信息》【年(卷),期】2018(024)021【总页数】3页(P18-20)【关键词】脂肪酶测定试剂盒;性能指标;数据统计;安全有效性【作者】杨笑鹤;何琼;寇艳芹;甄辉【作者单位】浙江省医疗器械审评中心浙江杭州 310012;浙江省医疗器械审评中心浙江杭州 310012;浙江省医疗器械审评中心浙江杭州 310012;浙江省医疗器械审评中心浙江杭州 310012【正文语种】中文【中图分类】TH776脂肪酶是由胰腺及周围脂肪组织分泌的糖蛋白,由420或449个氨基酸残基组成。
血清脂肪酶主要来源于胰腺的分泌,分子量为32~39kDa,胰腺组织的脂肪酶浓度是血清脂肪酶的近20000倍[1]。
胰脂肪酶与肝脂肪酶、脂蛋白酯酶同属于脂肪酶基因家族,基因结构具有高度同源性,其中胰脂肪酶催化循环血液或食物中的甘油三酯水解生成甘油二酯、甘油一酯或甘油和脂肪酸[2]。
除胰腺疾病外,血清脂肪酶的升高可能还与急性胆囊炎、肠梗阻、腹部肿瘤等腹部各器官的病变,无症状慢性酒精中毒等全身性病变,肾功能不全、丙型病毒性肝炎等疾病有关[1]。
有研究表明,早期检测血清脂肪酶能较好的区分急性和非急性胰腺炎,其血清表达水平和胰腺炎病情进展程度呈显著正相关,阳性率达92.0%,呈较高的敏感性,是诊断胰腺炎病情的主要监测指标[2]。
目前,检测脂肪酶的方法学主要有甲基试卤灵底物法、橄榄油比浊法、干化学法等。
浙江省内绝大多数已注册产品采用甲基试卤灵底物法,检验原理如下:1,2-邻-二月桂宗甘油-3-戊二酸(6-甲基试卤灵)-酯作为底物,在碱性环境并有胆酸和共脂肪酶参与下,被脂肪酶水解,生成1,2-邻-二月桂基-消旋-甘油和一个不稳定的中间体戊二酸(6-甲基试卤灵)。

脂肪酶测定试剂盒(甲基试卤灵底物法)适用范围:用于体外定量检测人血清中脂肪酶的活性。
1.1规格a) 试剂1:2×40ml,试剂2:2×20ml;b) 试剂1:3×40ml,试剂2:3×20ml;c) 试剂1:4×40ml,试剂2:4×20ml;d) 试剂1:12×16ml,试剂2:12×8ml;e) 试剂1:2×200ml,试剂2:2×100ml;f) 试剂1:1×40ml,试剂2:1×20ml;g) 试剂1:1×20ml,试剂2:1×10ml;h) 试剂1:2×30ml,试剂2:2×15ml;i) 试剂1:1×30ml,试剂2:1×15ml;j) 试剂1:2×16ml,试剂2:2×8ml。
1.2 组成试剂主要组分见表1:表1 试剂主要组分2.1 外观外包装完整无破损,标签清晰;试剂1应为无色或淡粉色溶液;试剂2应为橙黄色溶液。
2.2 净含量应不低于试剂瓶标示装量。
2.3 试剂空白2.3.1 试剂空白吸光度在570nm处测定试剂空白吸光度,应<0.5;2.3.2 试剂空白吸光度变化率试剂空白吸光度变化率(△A/min)应≤0.05。
2.4 分析灵敏度测定浓度为500U/L的样品,吸光度变化率△A/min应不低于0.015。
2.5 线性2.5.1在[4,700]U/L范围内,线性回归的相关系数应不低于0.990;2.5.2测试浓度[100,700]U/L的样品,相对偏差应不超过±10%;测试浓度[4,100)U/L的样品,绝对偏差应不超过±10U/L。
2.6 重复性2.6.1 批内重复性变异系数(CV)应不超过5%。
2.6.2 批间差对同一份样品进行重复测定,相对极差(R)应不超过10%。

脂肪酶测定试剂盒(甲基试卤灵底物法)适用范围:用于体外定量检测人血清脂肪酶(LPS)活性。
1.1包装规格a) 试剂1:2×40ml,试剂2: 2×20ml;b) 试剂1:2×200ml,试剂2: 2×100ml;c) 试剂1:12×16ml,试剂2: 12×8ml;d) 试剂1:1×20ml,试剂2: 1×10ml。
1.2试剂主要组成成分试剂1主要组成成分BICIN缓冲液100mmol/l牛磺脱氧胆酸 34mmol/L氯化钠 40mmol/L试剂2主要成成分酒石酸缓冲液 9.5mmol/L共脂肪酶 500 U/L1,2-邻-二月桂宗甘油-3-戊二酸-(6-甲基试卤灵)-酯0.2mmol/L 2.1 外观和性状2.1.1 试剂盒各组分应齐全、完整、液体无渗漏;外包装完好、无破损,标签完好、字迹清晰。
2.1.2 试剂1应为无色或淡粉色液体,无沉淀、无悬浮物、无絮状物。
2.1.3 试剂2应为橙黄色液体,无沉淀、无悬浮物、无絮状物。
2.2 净含量液体试剂的净含量应不少于标示值。
2.3 试剂空白2.3.1 试剂空白吸光度在570nm处测定试剂空白吸光度,应<0.5。
2.3.2 试剂空白吸光度变化率试剂空白吸光度变化率△A/min≤0.01。
2.4 分析灵敏度测试500U/L的被测物时,吸光度变化率(ΔA/min)应不低于0.05。
2.5 准确性与比对试剂盒同时测试40例线性范围内的不同浓度的血清样本,样本浓度在(4,700)U/L范围内,其相关系数(r)≥0.975;测定浓度点在(4,100]U/L范围内绝对偏差不超过±15U/L;测定浓度在(100,700)U/L范围内相对偏差不超过±15%。
2.6 重复性批内变异系数(CV)应不超过5%。
2.7 线性2.7.1在(4,700)U/L区间内,线性相关系数r应不低于0.990;2.7.2 在(100,700)U/L区间内,相对偏差不超过±10%;在(4,100]U/L区间内,绝对偏差不超过±10U/L。

脂肪酶测定试剂盒(甲基试卤灵底物法)
适用范围:适用于体外定量测定人血清中脂肪酶的含量。
1.1 产品规格
1.2主要组成成分
2.1外观
2.1.1试剂盒标签标识清晰,外包装完整无破损;
2.1.2试剂1为无色澄清液体,目测不得有任何沉淀及絮状悬浮物;
2.1.3试剂2为黄色澄清液体,目测不得有任何沉淀及絮状悬浮物。
2.2净含量
净含量不低于标示值。
2.3试剂空白
2.3.1 空白吸光度
测定待检试剂在主波长570nm、副波长700nm、37℃条件下:A≤1.0;
2.3.2 空白吸光度变化率
空白吸光度变化率△A/min≤0.01。
2.4 线性范围
(10,260)U/L范围内,相关系数r≥0.990;
(10,50]U/L范围内,绝对偏差不超过±5U/L;
(50,260)U/L范围内,相对偏差不超过±10.0%。
2.5分析灵敏度
在产品说明书规定参数设定条件下,测定浓度为78U/L的样本,△A/min ≥0.02。
2.6 精密度
2.6.1批内重复性
CV≤10.0%。
2.6.2 批间差
相对极差R≤10.0%。
2.7 准确度
与已上市产品比对:(10,260)U/L范围内,相关系数r≥0.990;(10,50]U/L范围内,绝对偏差不超过±5U/L;(50,260)U/L范围内,相对偏差不超过±10.0%。
2.8 稳定性
未开封试剂2℃~8℃储存,可稳定12个月。
取到效期后2个月内产品进行检测, 检测结果应满足2.3、2.4和2.7的规定。
脂肪酶测定试剂盒技术审评要点概述杨笑鹤;寇艳芹;董沁芳;叶朝付;甄辉【摘要】脂肪酶是急性胰腺炎诊断的重要参考指标,目前脂肪酶测定试剂盒尚无国家标准及行业标准发布.文章从产品说明书、产品技术要求、临床评价等方面对该试剂盒在技术审评中的要点进行简要概述,旨在帮助注册申报人更好地把握产品的技术要点,有效指导注册申报工作.【期刊名称】《中国医疗器械信息》【年(卷),期】2017(023)015【总页数】3页(P33-35)【关键词】体外诊断试剂;脂肪酶;技术审评要点【作者】杨笑鹤;寇艳芹;董沁芳;叶朝付;甄辉【作者单位】浙江省医疗器械审评中心浙江杭州 310012;浙江省医疗器械审评中心浙江杭州 310012;浙江省医疗器械审评中心浙江杭州 310012;浙江省医疗器械审评中心浙江杭州 310012;浙江省医疗器械审评中心浙江杭州 310012【正文语种】中文【中图分类】R197.39Abstract: Lipase is an important reference indicatiors of risk stratifying acute pancreatitis. Currently there is no national standard existed, no industry standard is published. A research is carried out focused on in the product technical requirements, the brochures, the clinical evaluationl andother aspects in this paper. We hope it will help the manufacturer grasp of the key points of the product and help the registration application effectively.Key words: in vitro diagnostic reagents, lipase, evaluation guidance急性胰腺炎具有起病迅急、病情凶险,病死率高的特点,所以早期及时而正确的诊断显得尤为重要。
专利名称:脂肪酶检测试剂盒专利类型:实用新型专利
发明人:张冲,李立和
申请号:CN201620137553.6申请日:20160224
公开号:CN205382164U
公开日:
20160713
专利内容由知识产权出版社提供
摘要:本实用新型公开了一种脂肪酶检测试剂盒,属于荧光测试物的使用,本实用新型包括长方形盒体及与其一侧边弯折连体的盒盖,而在盒体一侧长边内形成有插孔的试剂架上,分别容纳脂肪酶定标液A试剂瓶,脂肪酶定标液B试剂瓶,质控液试剂瓶,盒体内的纵向分隔板一侧形成收容脂肪酶试剂Ⅰ试剂瓶,脂肪酶试剂Ⅱ试剂瓶的空间,应用终点法进行血清中脂肪酶检测,这样设计的本实用新型将所用检测时使用的试剂集中在一起,便于检测,操作简单,节省人力和时间,提供了工作效率。
申请人:天津市宝坻区人民医院
地址:301800 天津市宝坻区广川路8号
国籍:CN
更多信息请下载全文后查看。
医疗器械产品技术要求:脂肪酶测定试剂盒(甲基试卤灵底物法)1、产品型号/规格及其划分说明1.1 包装规格试剂1(R1): 60ml×2、试剂2(R2): 15ml×2;试剂1(R1): 60ml×1、试剂2(R2): 15ml×1;试剂1(R1): 40ml×1、试剂2(R2): 10ml×11.2主要组成成分1.3 适用范围/预期用途本试剂盒用于体外定量测定人血清中脂肪酶(LPS)的含量。
1.4 产品储存条件及有效期(体外诊断试剂适用)2℃~8℃避光保存,有效期为12个月。
2、性能指标2.1外观.R1为无色透明液体;.R2 应为浅黄色透明液体。
.试剂盒标签标识清晰,外包装完整无损。
2.2 净含量R1、R2净含量不少于标示值。
2.3 试剂空白在主波长580nm处(光径1cm),测定试剂空白吸光度吸光度A≤0.5。
在主波长580nm处(光径1cm),测定试剂空白吸光度变化率ΔA/min≤0.05。
2.4分析灵敏度测量1U/L的被测物时,吸光度变化率(ΔA/min)≥0.0002。
2.5 线性在[5,300]U/L线性范围内,线性相关系数r≥0.990。
在[5,50]U/L范围内,绝对偏差不超过±5U/L;在(50,300]U/L范围内,相对偏差不超过±10%。
2.6 精密度2.6.1 重复性重复测定高、低两个浓度的样品,所得结果的变异系数(CV)≤5%。
2.6.2 批间差随机抽取3批试剂盒,批间相对极差≤6%。
2.7 准确度本公司LPS试剂盒和已上市的产品进行比对试验:相关系数r≥0.975,在[5,50]U/L 范围内测定的偏差不超过±5U/L;在(50,300]U/L范围内测定的偏差不超过±10%。
2.8 稳定性原包装的LPS试剂盒在(2~8)℃避光保存,有效期为12个月。
试剂盒在规定的储存条件下保存至有效期满后,检测2.3、2.4、2.5、2.6.1、2.7项,结果应符合各项目的要求。
脂肪酶测定试剂盒(甲基试卤灵底物法)
适用范围:本试剂用于体外定量测定人血清或血浆中脂肪酶的活性。
1.1规格
液体双剂型
试剂1(R1):40mL×1,试剂2(R2):10mL×1;
试剂1(R1):60mL×1,试剂2(R2):15mL×1。
1.2规格划分说明
根据净含量划分规格。
1.3主要组成成分
试剂盒由试剂1(R1)液体和试剂2(R2)液体组成。
1.3.1 试剂1(R1)液体:
甘氨
酸 450mmol/L 氢氧化钠 3.6mmol/L 共脂肪酶 1mg/L
脱氧胆酸钠 1.6mmol/L 1.3.2 试剂2(R2)液体:
酒石酸缓冲液 19mmol/L
脂肪酶生色底物 3.4mmol/L
2.1 外观
试剂盒中各组件的外观应满足:
a) 试剂1 (R1)应为无色透明溶液,无杂质、无絮状物,外包装完整无破损;
b) 试剂2 (R2)应为橙色至红色微浊液体,外包装完整无破损。
2.2 试剂空白
2.2.1 试剂空白吸光度
在波长570nm(550nm~600nm)(光径1cm)处,试剂空白吸光度(A)应≤0.7000。
2.2.2试剂空白吸光度变化率
在波长570nm(550nm~600nm)(光径1cm)处,试剂空白吸光度变化率(△A/min)≤ 0.200。
2.3.准确度
测定BCR693,相对偏差应不超过±15%。
2.4分析灵敏度
对应于浓度为100U/L的脂肪酶所引起的吸光度变化率(△A/min)的绝对值应在0.020 ~0.200的范围内。
2.5重复性
重复测定高、中、低浓度样本,变异系数(CV)应≤15%。
2.6批间差
测定同一样本,批间差(R)应≤15%。
2.7线性范围
在[3,300]U/L范围内,线性相关系数(r)应≥0.990;
在(50,300]U/L范围内,线性相对偏差应不超过±10%;
在[3,50]U/L范围内,线性绝对偏差应不超过±5U/L。
2.8稳定性
原包装的试剂盒在2℃~8℃避光贮存,有效期为12月。
试剂有效期满后3个月以内,试剂性能应符合2.1、2.2、2.3、2.4、2.5、2.7的要求。
2.9净含量
液体试剂净含量应不少于标示值。