软化水装置氢氧化钠和碳酸钠加药量计算方法
- 格式:doc
- 大小:191.50 KB
- 文档页数:3

石化软化处理过程加药量计算及污泥量计算(二)引言概述:石化工业中的软化处理过程是确保原料水质满足工艺要求的关键步骤之一。
为了保证软化处理过程的高效性,需要合理计算加药量和污泥量。
本文将详细介绍石化软化处理过程中加药量的计算方法和污泥量的计算方法。
正文:一、加药量计算方法1. 根据原始水质确定软化剂种类a. 分析原始水质的硬度含量b. 根据硬度含量决定适合的软化剂种类2. 确定软化剂投加量a. 根据原始水质中硬度含量计算所需软化剂的最低投加量b. 考虑软化剂的过量投加量,确定最终的软化剂投加量3. 考虑水质变化的影响a. 根据水质变化情况,调整软化剂的投加量b. 定期监测水质,进行实时调整4. 考虑设备特性a. 考虑软化设备的处理能力和效率b. 根据设备的特点,确定软化剂的最佳投加量5. 记录投加量并定期评估a. 记录每次软化剂的投加量b. 定期评估加药量的效果,进行调整二、污泥量计算方法1. 计算进水污泥量a. 根据原始水质中的悬浮物含量计算进水污泥量b. 考虑软化剂投加量对污泥量的影响,进行调整2. 计算产生的污泥量a. 根据软化处理过程中生成的氢氢氧化物的量计算产生的污泥量b. 考虑软化剂种类和投加量对污泥量的影响,进行调整3. 根据处理效果评估污泥处理方案a. 根据软化处理后水质的要求,评估污泥的处理方案b. 考虑污泥的处理成本和环境影响,确定最终的污泥处理方案4. 优化污泥处理过程a. 定期评估污泥处理过程的效果,进行调整b. 探索新的污泥处理技术,以提高处理效率和降低处理成本5. 监测和管理污泥处理过程a. 定期监测污泥处理过程中的污泥产量和质量b. 严格管理污泥的处置和利用,确保环境安全和资源回收总结:石化软化处理过程中的加药量计算和污泥量计算是确保处理过程高效的重要步骤。
通过合理计算软化剂的投加量和评估污泥的处理方案,可以提高软化处理的效果,并实现污泥的有效处置和资源回收。
定期监测和管理软化处理过程中的加药量和污泥量,对于保证石化工业生产的稳定运行和环境安全具有重要意义。
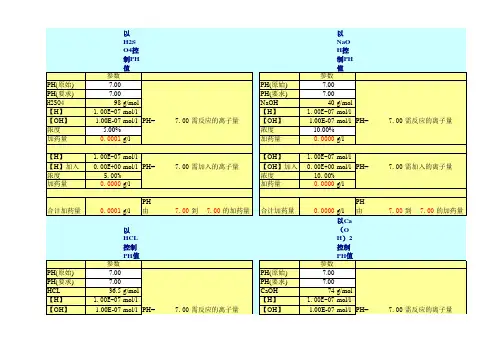

加药量计算
1、加碱量计算
一级反浸透产水按 PH=5计算,需加碱将 PH 值调到 9;
PH=5 - -9 mol/L ;
时, POH=14-5=9,OH 浓度为 10 PH=9 - -5
mol/L ; 时, POH=14-9=5,OH 浓度为 10
30%NaOH 摩尔浓度约为 10mol/L 。
一级反浸透单套进水量按 20m3/h 计算,则每小时加药量为
(10-5 mol/L-10 -9 mol/L )× 20m3/h ×1000
10mol/L。
稀释 10 倍则为。
加药泵选型为 P056,流量为。
两套系统加药量为 ,按 24 小时, 7 天的用量计算,则药
箱容积为: 0.4 ×24×7=67.2L 。
2、加氨量计算
EDI 产水按 PH=6计算,需加氨将 PH 值调到 10;
- -8 mol/L ;
PH=6 时, POH=14-6=8,OH 浓度为
10
-
-4 mol/L ; PH=10 时, POH=14-10=4,OH 浓度为
10
28% 液氨摩尔浓度约为 15mol/L 。
除盐水量按 30m3/h 计算,则每小时加药量为
(10-4 mol/L-10 -8 mol/L )× 30m/h ×1000
15mol/L。
稀释 10 倍则为 2L/H。
加药泵选型为P056,流量为。
按 24 小时, 7 天的用量计算,则药箱容积为:2×24×7=336L。
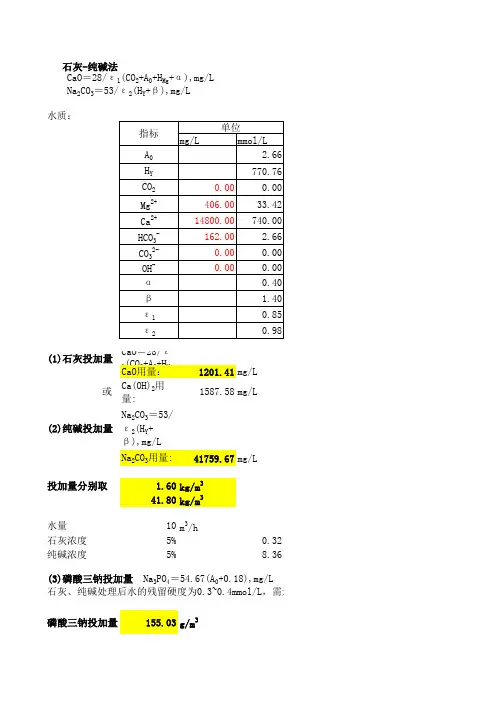

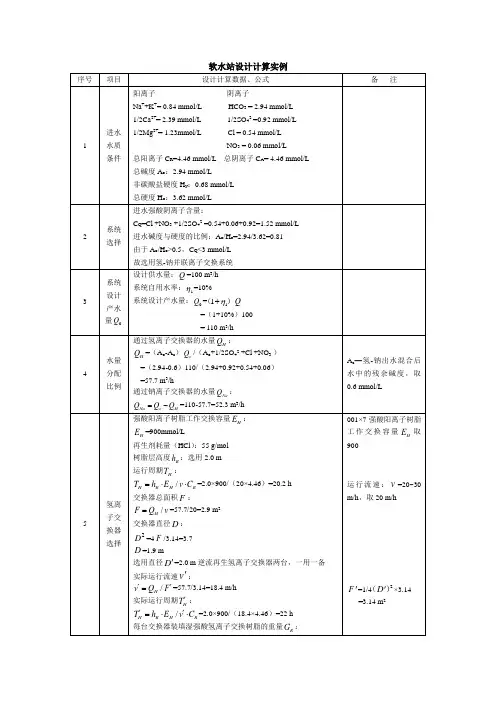
软化处理过程加药量及吨水费用计算一、计算基础(碱度、硬度均以CaCO3计)进水总硬度为1200PPm,12mmol/l;其中:钙硬650PPm,6.5 mmol/l(钙暂硬2.87 mmol/l,钙永硬3.63mmol/l);镁硬550PPm,5.5 mmol/l 总碱度:287PPm,2.87 mmol/l,均为HCO3-碱度根据离子选择性,其重碳酸根碱度均已重碳酸钙存在。
根据水中碳酸盐平衡计算水中CO2含量为0.013 mmol/l。
按软化处理后保留镁硬300PPm,钙硬100PPm,其余硬度除掉计算;考虑沉镁硬需将PH值提高到10所耗的碱量:假设进水PH值为9,要求提高至10,所需碱量为:PH值为9时水中〔OH-〕为10-5mol/l;PH值为10时水中〔OH-〕为10-4mol/l;所以需加〔OH-〕量为:10-4mol/l-10-5mol/l=0.1-0.01=0.09 mmol/l 约等于0.1 mmol/l. mmol/l。
用石灰软化需加石灰0.05 mmol/l;用烧碱软化需加烧碱0.1mmol/l。
石灰:400元/吨;纯碱:1400元/吨;烧碱:2200元/吨二、软化反应过程1、石灰-纯碱软化过程发生的主要反应可归到如下几个反应:加石灰发生如下反应:CO2 + Ca(OH)2= CaCO3 + H2O1 1 1 1Ca(HCO3)2+ Ca(OH)2= 2CaCO3 +2 H2O1 12 2Mg Cl2+ Ca(OH)2= Mg (OH)2 +Ca Cl2 (此反应的产生的钙硬要用后面加的纯碱去除)1 1 1 1加纯碱发生如下反应:CaCl2 + Na2CO3= CaCO3 + 2NaCl1 1 1 22、烧碱-纯碱软化过程发生的主要反应可归到如下几个反应:加烧碱发生如下反应:CO2 +2 NaOH= Na2CO3 + H2O1 2 1 1Ca(HCO3)2+ 2NaOH= CaCO3 +Na2CO3+2 H2O (此反应的产生的纯碱可用于后面永硬的去除)1 2 1 1 2Mg Cl2 + 2NaOH = Mg (OH)2 + Na2 Cl21 2 1 1加纯碱发生如下反应:CaCl2 + Na2CO3= CaCO3 + 2NaCl1 1 1 2(单位:mmol/l)排污水软化试验方案试验目的:验证不同方法对水中硬度的去处效果检测水中阻垢剂对硬度去除的影响试验理论基础:根据石灰-纯碱软化法和烧碱-纯碱软化法反应过程,计算出不同保留硬度的加药量。

水处理设备加药装置计量计算(仅供参考)一、阻垢剂的加药量(仅供参考)脱盐水处理系统一级反渗透系统回水率按75%计算,在20-50℃条件下,该水质有较强的结垢倾向,这说明必须加入适量的膜用分散剂,以保证反渗透系统长周期安全稳定运行,延长膜的使用周期。
二级反渗透进水为一级反渗透产水,硬度碱度低不需加入阻垢剂。
经过反渗透专用软件计算得知:水质在75%的回收率下的建议投加药量为:3ppm(以进水计),每天加药量=药剂浓度×进水量×24h≈8.64公斤(进水量按120m3/h计)二、PH调节(仅供参考)调节pH系统采用X015型隔膜泵和120L水箱,在水箱中配制浓度为0.1%~0.5%的Na0H溶液,通过隔膜泵进行药物的投加。
根据产水pH值以及产水电导率调节加碱量使产水的值达到适中值,根据实际二级产水电导率来确定投加浓度。
隔膜泵与二级反渗透同步运行。
调节加碱量的一般原则:1、当电导率急剧上升,则说明加碱量大。
2、当电导率较稳定但较高,则说明加碱量太小。
3、当加碱量太小再增大加碱量时,电导率急剧下降,但下降到一定程度又马上上升,则加碱量增加太大。
4、碱隔膜泵刻度调至最大还无法达到加碱量,则说明水箱碱浓度太小。
5、碱泵刻度在20以下且调节的灵敏度太高,则说明水箱碱浓度太高三、杀菌剂的投加(仅供参考)1、由于原水为市政自来水,系统中的细菌较少,但随着气温的升高,尤其是在夏季,会影响反渗透膜的正常运行,所以应投加一定量的杀菌剂,以控制细菌的生长,保护反渗透膜不受微生物的侵害,该药剂连续投加至系统预处理中,维持进水中余氯量以抑制细菌的滋生,因此药剂投加量应以系统实际所受生物污染程度来定,建议投加量为2ppm (以进水计)。
2、脱盐水处理系统每天加药=药剂浓度×进水量×24h≈5.76公斤(进水量按120m3/h计)四、还原剂的投加(仅供参考)1、为了避免氧化型杀菌剂进入反渗透膜将膜元件氧化,在反渗透系统前设置还原剂加药系统。
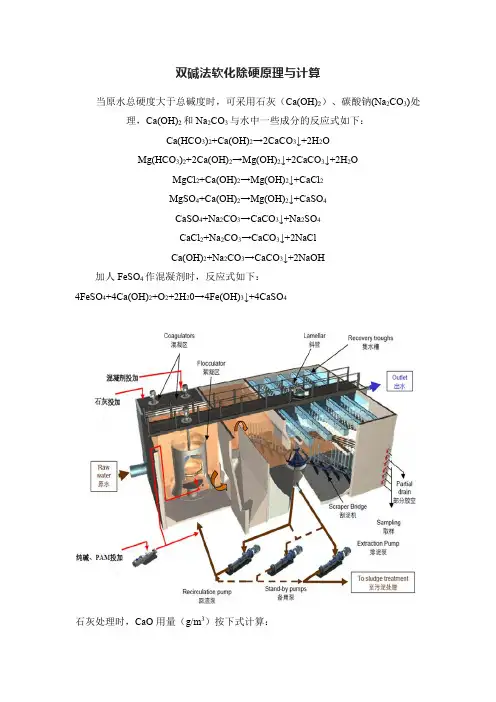
双碱法软化除硬原理与计算当原水总硬度大于总碱度时,可采用石灰(Ca(OH)2)、碳酸钠(Na2CO3)处理,Ca(OH)2和Na2CO3与水中一些成分的反应式如下:Ca(HCO3)2+Ca(OH)2→2CaCO3↓+2H2OMg(HCO3)2+2Ca(OH)2→Mg(OH)2↓+2CaCO3↓+2H2OMgCl2+Ca(OH)2→Mg(OH)2↓+CaCl2MgSO4+Ca(OH)2→Mg(OH)2↓+CaSO4CaSO4+Na2CO3→CaCO3↓+Na2SO4CaCl2+Na2CO3→CaCO3↓+2NaClCa(OH)2+Na2CO3→CaCO3↓+2NaOH加人FeSO4作混凝剂时,反应式如下:4FeSO4+4Ca(OH)2+O2+2H20→4Fe(OH)3↓+4CaSO4石灰处理时,CaO用量(g/m3)按下式计算:CaO用量=28×(H T+H M+[CO2]+[Fe2+]+K+0.35)式中,H T为碳酸盐硬度,mmmol/L;H M为镁硬度,mmmol/L;[CO2]为水中CO2浓度,mmmol/L;[Fe2+]为水中Fe2+浓度,mmmol/L;K为混凝剂用量,mmmol/L;0.35为石灰过剩量,mmmol/L。
Na2CO3用量(g/m3)按下式计算:CaO用量=53×(H F+K+1.4)式中,H F为非碳酸盐硬度,mmmol/L;K为混凝剂用量,mmmol/L;1.4为碳酸钠过剩量,mmmol/L。
举个例子,原水总硬度H=6.5mmol/L,[Fe2+]=0.2mmol/L,碳酸盐硬度H T=4.5mmol/L,游离[CO2]=0.3mmol/L,非碳酸盐硬度H F=2.0mmol/L,混凝剂用量K=0.35mmol/L,[Ca2+]=4.3mmol/L,CaO过剩量为0.35mmol/L,[Mg2+]=1.9mmol/L,Na2CO3过剩量为1.4mmol/L,那么CaO用量=28×(4.5+1.9+0.3+0.2+0.35+0.35)=212.8g/m3Na2CO3用量=53×(2.0+0.35+1.4)==198.8g/m3。


软化水中钠的含量计算公式在生活和工业生产中,水是一个非常重要的资源。
然而,有些地区的水含有大量的钠离子,这可能会对人体健康和工业生产产生不利影响。
因此,软化水处理成为一种常见的方法,以减少水中的钠含量。
软化水处理的过程中,我们需要计算软化后水中钠的含量,这样才能确保水质符合标准。
下面我们将介绍软化水中钠的含量计算公式及其相关知识。
软化水处理是通过去除水中的钙、镁离子,从而减少水的硬度。
通常使用离子交换树脂来进行软化水处理。
在软化水处理过程中,钠离子会替代水中的钙、镁离子,因此软化后的水中会含有一定量的钠离子。
为了确定软化后水中钠的含量,我们需要使用以下的计算公式:软化水中钠的含量(mg/L)= 软化前水中钠的含量(mg/L)+ (软化前水中钠的含量软化后水中钠的含量) × (软化前水中的钙和镁的含量 / 软化前水中的钠的含量)。
这个公式的推导是基于离子交换的原理。
在软化水处理过程中,树脂上的钠离子会与水中的钙、镁离子发生离子交换,从而软化水质。
因此,软化后水中钠的含量取决于软化前水中钠的含量、软化前水中的钙和镁的含量以及软化后水中的钠的含量。
在使用这个公式时,我们需要知道软化前水中钠的含量、软化前水中的钙和镁的含量以及软化后水中钠的含量。
软化前水中钠的含量可以通过水质检测来确定,软化前水中的钙和镁的含量也可以通过水质检测来确定。
而软化后水中钠的含量则可以通过软化水处理设备的性能参数来确定。
软化水中钠的含量计算公式的应用可以帮助我们了解软化后水的质量,从而保证水质符合标准。
此外,软化水处理还可以延长设备的使用寿命,减少管道和设备的结垢,提高生产效率。
因此,软化水处理在工业生产中具有重要的意义。
除了软化水处理外,我们还可以采取其他方法来降低水中的钠含量。
例如,可以通过反渗透膜、电渗析等技术来去除水中的钠离子。
这些方法各有优缺点,需要根据具体情况来选择合适的方法。
总之,软化水中钠的含量计算公式可以帮助我们确定软化后水的质量,从而保证水质符合标准。

氢氧化钠配制用量计算公式氢氧化钠是一种常用的化学试剂,广泛应用于化工、制药、冶金等多个领域。
在实际应用中,我们经常需要根据需要配制一定浓度的氢氧化钠溶液。
为了确保配制的溶液浓度准确,我们需要掌握氢氧化钠配制用量的计算方法。
氢氧化钠的化学式为NaOH,是一种强碱。
在配制氢氧化钠溶液时,我们通常需要根据实际需要来确定所需的氢氧化钠用量。
下面我们将介绍氢氧化钠配制用量的计算公式和方法。
首先,我们需要明确所需配制的氢氧化钠溶液的浓度。
氢氧化钠溶液的浓度通常用摩尔浓度(mol/L)来表示。
摩尔浓度是指在单位体积(升)的溶液中溶质的摩尔数。
在配制氢氧化钠溶液时,我们需要根据所需的摩尔浓度来确定所需的氢氧化钠用量。
氢氧化钠的摩尔质量为40.00 g/mol。
根据摩尔浓度的定义,我们可以使用下面的公式来计算所需的氢氧化钠用量:所需氢氧化钠用量(g)= 摩尔浓度(mol/L)×溶液体积(L)×氢氧化钠的摩尔质量(g/mol)。
例如,如果我们需要配制500 mL浓度为0.1 mol/L的氢氧化钠溶液,那么所需的氢氧化钠用量可以通过以下计算得出:所需氢氧化钠用量(g)= 0.1 mol/L × 0.5 L × 40.00 g/mol = 2.00 g。
通过这个计算公式,我们可以根据实际需要来确定所需的氢氧化钠用量,从而配制出所需浓度的氢氧化钠溶液。
需要注意的是,在实际操作中,我们还需要考虑到氢氧化钠的溶解度和配制过程中的一些细节。
氢氧化钠是一种易溶于水的固体,但在配制浓度较高的氢氧化钠溶液时,需要注意逐渐加入氢氧化钠固体并充分搅拌,以避免产生过多的热量和溅射。
此外,氢氧化钠溶液也是一种强碱,使用时需要注意安全防护措施,避免接触皮肤和眼睛。
总之,氢氧化钠配制用量的计算公式能够帮助我们准确地确定所需的氢氧化钠用量,从而配制出符合要求的氢氧化钠溶液。
在实际操作中,我们需要根据具体情况合理选择氢氧化钠用量,并严格遵守安全操作规程,确保操作安全和溶液质量。
家用软水机用盐量的计算方法家用软水机用盐量的计算方法导语:现如今,软水在生活中的作用已被越来越多的人所认识,它不仅可美白肌肤,润泽秀发,延缓皮肤衰老,而且可大大提高皮肤滋润舒适度,这正是美容会所和时尚家庭纷纷安装软水机之原因所在。
然而好多用户对于软水机用盐量不好把握,今天我们就为大家讲解一下软水机用盐量的具体计算方法。
家用软水机再生一次盐量的计算方法:软水机的用盐量,是根据其内部的树脂填充量来决定的,而树脂的填充的量也决定了你的软水机的再生周期。
一般来说,可以这样计算:树脂量(L)*160(最低)=盐量(克);如树脂量10L,一般每次再生为10*160=1600g即1.6公斤这个需要根据进水硬度和出水水质的要求。
知识拓展:软水机每月再生以及耗盐量情况理论的树脂再生的需盐量为每升160-260克盐,需盐量最低值时,每升树脂的理论交换能力为0.058千克,需盐量最高值时,每升树脂的理论交换能力为0.067千克.PPM(水中的百分比浓度); GPG(硬度单位);两者换算为:1GPG=17.1PPM一磅=0.454公斤一加仑水=3.8升水通常情况下在美国水中钙镁离子含量为250ppm每加仑,换算成格令为250÷17.1=15个grains硬度。
一磅软水盐可以置换4000个硬度的钙美离子(一公斤软水盐可以置换8810个硬度的钙美离子),软水机树脂可以吸附27000个硬度单位的钙美离子。
1. 按照普通三口之家每天用240加仑水来计算,每天产生的硬度数为15*240=3600个单位数。
那每天使用的软水盐为3600÷4000=0.9磅。
平均一个月用软水盐为0.9*30=27磅。
2. 如果以吨和公斤来换算为:每天使用240*3.8=912升=0.912吨水,一个月用水为27.36吨,每天使用的软水盐为0.9*0.454=0.409公斤盐,一个月用软水盐为0.409*30=12.3公斤。
3. 软水机每个月再生13次。