工业氢氧化钠中氢氧化钠和碳酸钠含量测定
- 格式:ppt
- 大小:1.67 MB
- 文档页数:16



工业氢氧化钠的分析方法一:工业氢氧化钠中氢氧化钠和碳酸钠含量的联合测定1测定原理1.1氢氧化钠含量的测定原理:试样溶液中首先加入氯化钡,则碳酸钠转化成碳酸钡沉淀,然后以酚酞为指示剂,用盐酸标准溶液滴定至终点,反应如下:Na2CO3 + BaCl2 = BaCO3 +2NaClNaOH +HCl = NaCl + H2O1. 2 碳酸钠含量的测定原理:试样溶液以甲基橙为指示剂,用盐酸标准溶液滴定至终点,则得氢氧化钠和碳酸钠含量的总和,再减去氢氧化钠的含量即得碳酸钠的含量。
2仪器和设备一般实验室仪器和磁力搅拌器。
3试剂和溶液本方法要求使用不含二氧化碳的蒸馏水或相当纯度的水。
3. 1 氯化钡(分析纯):10%。
使用前以酚酞为指示剂,用氢氧化钠溶液调至微红色。
3. 2 酚酞指示剂:1%乙醇溶液。
3. 3 甲基橙指示剂:0.1%。
3. 4 无水碳酸钠(基准试剂)。
3. 5 盐酸标准溶液(1M):3. 5. 1 配制:3. 5. 2 标定:称取1.6000克于280摄氏度灼烧至恒重的无水碳酸钠溶于50毫升水中,加2滴甲基橙指示剂,以盐酸标准溶液滴定至溶液呈橙色,加热煮沸2分钟,冷却后继续滴定至橙色为终点。
同时做空白试验。
按下式计算盐酸标准溶液的摩尔浓度:M(HCl) = M0/{ (V1-V0)*0.05299}式中:M O-------- 无水碳酸钠基准试剂的质量(g)。
V1 ------------- 滴定基准试剂所消耗的盐酸标准溶液体积(mL)。
V O------- 空白试验所消耗的盐酸标准溶液体积(mL)。
0.05299 ------------ 碳酸钠的毫克当量数。
3.6试样溶液的制备:用已知重量的称量瓶,迅速称取固体氢氧化钠38.00克或液体氢氧化钠50.00克,转入1000毫升容量瓶中,完全溶解并冷却到室温后稀释到刻度,混匀备用。
4测定手续4.1氢氧化钠含量的测定:吸取已制备好比的试样溶液50.0毫升于250毫升具塞磨口锥形瓶中,加入20.0毫升氯化钡溶液,加入3滴酚酞指示剂,以盐酸标准溶液密闭滴定至溶液呈微红色为终点。

氢氧化钠中碳酸钠的测定氢氧化钠是一种常用的化学试剂,广泛应用于化工、医药、食品加工、环保等领域。
碳酸钠则是氢氧化钠的一种衍生物,两者之间存在一定的关联。
本文将对氢氧化钠中碳酸钠的测定方法进行介绍。
碳酸钠是一种无色无臭的晶体,常用于制备碱性解剖、制浆、染料、玻璃等。
而氢氧化钠同样是具有强碱性的化合物,常见于清洁剂、肥皂、纸浆和纤维工业等领域。
在实际应用中,如果需要对氢氧化钠中的碳酸钠含量进行准确测定,可以通过以下几种方法进行分析。
首先,常用的一种方法是用酸作为滴定剂,将氢氧化钠与酸反应,生成盐和水。
这种方法的原理是,当酸与氢氧化钠反应时,碳酸钠会先转化为二氧化碳气体,然后通过酸碱中和反应生成相应的盐。
具体操作流程如下:1.取一定量的氢氧化钠溶液,加入少量的酸指示剂,使溶液呈红色。
2.用标准的酸溶液滴定,直至溶液颜色由红色变为黄色。
3.记录滴定所需的酸溶液的体积V1。
4.利用酸溶液的浓度C1,计算出氢氧化钠的摩尔浓度n1。
接下来,我们需要计算碳酸钠的摩尔浓度n2。
根据化学方程式,氢氧化钠和碳酸钠之间的反应为:2NaOH + Na2CO3 → 2Na2CO3 + H2O根据此反应,我们可以确定氢氧化钠和碳酸钠的化学计量比为2:1。
因此,氢氧化钠的摩尔浓度n1乘以2即为碳酸钠的摩尔浓度n2。
最后,通过测定氢氧化钠中的碳酸钠摩尔浓度,我们可以计算出溶液中碳酸钠的质量浓度。
假设溶液容积为V mL,那么碳酸钠的质量浓度等于碳酸钠的摩尔浓度n2乘以摩尔质量M。
需要注意的是,在进行测定前,必须进行准确的称量和稀释,以确保实验结果的准确性。
同时,温度、压力和pH值的变化可能会对测定结果产生影响,因此在实验过程中应尽量控制这些因素。
除了滴定法外,还可以利用红外光谱法、质谱法、原子吸收光谱法等进行氢氧化钠中碳酸钠的测定。
这些方法可以通过测量溶液中特定的光谱峰值或质谱峰值来确定碳酸钠的含量,具有高精度和快速的特点。
总结起来,氢氧化钠中碳酸钠的测定方法有多种选择,包括滴定法、红外光谱法、质谱法和原子吸收光谱法等。

有效氯含量的测定1.原理在酸性介质中,次氯酸根与碘化钾反应,析出碘,以淀粉为指示剂,用硫代硫酸钠标准滴定溶液滴定,至溶液兰色消失为终点。
反应式如下:2H++OCL-+2I-=I2+CL-+H2OI2+2S2O32-=S4O62-+2I-2.仪器和设备一般实验室仪器3.试剂和溶液a.盐酸(GB/T 622):1+1溶液;b.碘化钾(GB/T 1272):100g/L称取工业氢氧化钠中氢氧化钠和碳酸钠含量的测定(容量法)1.方法概要氢氧化钠的测定原理为在试样溶液中,以酚酞为指示剂,用盐酸标准溶液滴定,溶液由红色变为无色即为终点。
反应如下:NaOH+HCL→NaCL+H2O碳酸钠的测定原理为在试样溶液中,以甲基橙为指示剂,用盐酸标准溶液滴定,溶液由黄色变为橙色即为终点。
2.试剂0.1%甲基橙溶液(m/V)。
1%酚酞乙醇溶液(m/V)。
1mol/L盐酸(优级纯)标准溶液。
3.测定方法a.试样溶液的准备用已知质量的称量瓶迅速称取固态氢氧化钠35±1g或液态氢氧化钠50g(称准至0.01g),放入1000mL容量瓶中,加二级试剂水溶解,冷却到室温后稀释到刻度,摇匀。
b.氢氧化钠含量的测定吸取50.0mL试样溶液,注入250mL锥形瓶中,加入2~3滴酚酞指示剂溶液,充分摇匀,用1mol/L盐酸标准溶液滴定,溶液由红色变为无色即为终点,记录所消耗盐酸标准溶液的体积(V)。
c.氢氧化钠和碳酸钠含量的测定液,充分摇匀,用1mol/L盐酸标准溶液滴定,溶液由黄色变为橙色即为终点,记录所消耗盐酸标准溶液的体积(V1)。
4.计算和允许误差a.氢氧化钠含量X1(以质量百分数表示)按下式计算:X1=C(HCL)×(2V-V1)×M(NaOH)×100%50m式中:C——盐酸标准溶液的浓度,mol/L;V——以酚酞为指示剂滴定时,所消耗盐酸标准溶液的体积,ml; V1——以甲基橙为指示剂滴定时,消耗盐酸标准溶液的体积,ml; M(NaOH)——氢氧化钠的摩尔质量,M(NaOH)=40g/mol;m——试样质量,gb.碳酸钠含量X2(以质量百分数表示)按下式计算:X2=C(HCL)×(2V1-V)×M(1/2Na2CO3)×100%50m式中:C——盐酸标准溶液的浓度,mol/L;V——以酚酞为指示剂滴定时,所消耗盐酸标准溶液的体积,ml; V1——以甲基橙为指示剂滴定时,消耗盐酸标准溶液的体积,ml; M(1/2Na2CO3)——1/2碳酸钠摩尔质量,M(1/2Na2CO3)=52.99g/mol;m——试样质量,gc.允许误差:氢氧化钠含量平行测定的允许误差为0.10%;碳酸钠(液态)含量平行测定的允许误差为0.03%氨水含量测定1.试剂甲基红-亚甲基蓝指示剂0.5mol/L盐酸标准溶液2.方法将15mL水注入具塞锥形瓶中,称量,加1mL样品,立即盖好瓶塞,再称量(两次称量均需精确至0.0001g)。


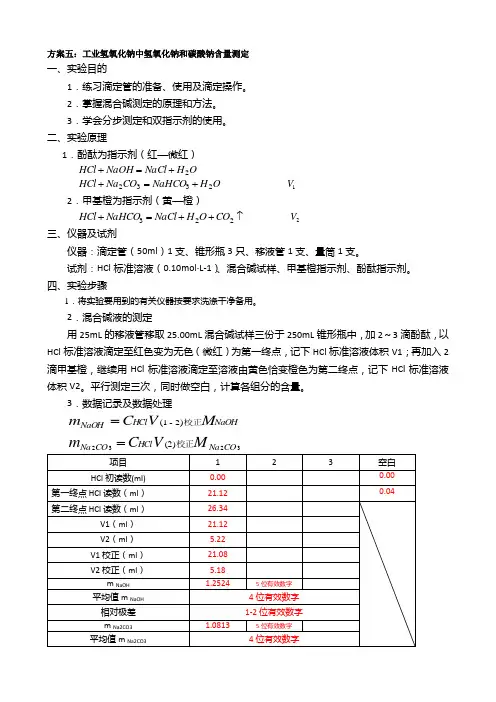
方案五:工业氢氧化钠中氢氧化钠和碳酸钠含量测定一、实验目的1.练习滴定管的准备、使用及滴定操作。
2.掌握混合碱测定的原理和方法。
3.学会分步测定和双指示剂的使用。
二、实验原理1.酚酞为指示剂(红—微红)O H NaCl NaOH HCl 2+=+O H NaHCO CO Na HCl 2332+=+ 1V 2.甲基橙为指示剂(黄—橙)↑++=+223CO O H NaCl NaHCO HCl 2V 三、仪器及试剂仪器:滴定管(50ml )1支、锥形瓶3只、移液管1支、量筒1支。
试剂:HCl 标准溶液(0.10mol ·L-1)、混合碱试样、甲基橙指示剂、酚酞指示剂。
四、实验步骤1.将实验要用到的有关仪器按要求洗涤干净备用。
2.混合碱液的测定用25mL 的移液管移取25.00mL 混合碱试样三份于250mL 锥形瓶中,加2~3滴酚酞,以HCl 标准溶液滴定至红色变为无色(微红)为第一终点,记下HCl 标准溶液体积V1;再加入2滴甲基橙,继续用HCl 标准溶液滴定至溶液由黄色恰变橙色为第二终点,记下HCl 标准溶液体积V2。
平行测定三次,同时做空白,计算各组分的含量。
3.数据记录及数据处理NaO HH Cl NaO H M V C m 校正)2-(1=3232)(2H Cl M V C m 校正=五、注意事项1.当混合碱为NaOH 和32CO Na 组成时,酚酞指示剂用量可适当多加几滴,否则常因滴定不完全而使NaOH 的测定结果偏低。
2.第一化学计量点的颜色变化为红——→微红色,不应有2CO 的损失,造成2CO 损失的操作是滴定速度过快,溶液中HCl 局部过量,引起O H CO NaCl NaHCO HCl 223++=+的反应。
因此滴定速度宜适中,摇动要均匀。
3.第二计量点时颜色变化为黄色——→橙色。
滴定过程中摇动要剧烈,使2CO 逸出避免形成碳酸饱和溶液,使终点提前。
六、实验思考1.用双指示剂法测定混合碱组成的方法原理是什么?2.采用双指示剂法测定混合碱,判断下列五种情况下,混合碱的组成? V1=0 ,V2>0 (2)V1>0 ,V2=0 (3)V1>V2 (4)V1<V2 (5)V1=V2方案六:EDTA 标准溶液的标定。

项目一工业氢氧化钠中氢氧化钠及碳酸钠含量测定一、实验目的(1)掌握酸碱滴定的相关知识在工业氢氧化钠分析检验的应用。
(2)掌握工业氢氧化钠分析检验中各项技术指标的分析条件二.实验原理1 氢氧化钠含量测定的原理试样溶液中先加入氯化钡,将碳酸钠转化为碳酸钡沉淀,然后以酚酞为指示剂,用盐酸标准滴定溶液滴定至终点。
反应如下:Na2CO3+BaCl2→BaCO3↓+2NaClNaOH+HCl→NaCl+H2O2 碳酸钠含量测定的原理试样溶液以溴甲酚绿一甲基红为指示剂,用盐酸标准滴定溶液滴定至终点,测得氢氧化钠和碳酸钠总和,再减去氢氧化钠含量,则可测得碳酸钠含量。
Na2CO3+2HCl→CO2+2NaCl+H2ONaOH+HCl→NaCl+H2O三.试剂仪器准备1、药品及试剂配制NaOH、无水Na2CO3、甲酚红、百里酚蓝、氯化钡、无水乙醇或95乙醇、溴甲酚绿、甲基红、酚酞[溴甲酚绿—甲基红混合指示剂配置]0.1%的溴甲酚绿乙醇溶液配制:称取0.10g溴甲酚绿,溶于乙醇,用乙醇稀释至100ml即可。
0.2%的甲基红乙醇溶液配制:称取0.20g甲基红,溶于乙醇,用乙醇稀释至100ml即可。
将0.1%的溴甲酚绿乙醇溶液与0.2%的甲基红乙醇溶液按3:1的体积比混合摇匀即得溴甲酚绿—甲基红混合指示剂。
甲酚红指示剂1份,0.1%百里酚蓝溶液3份混合即得甲酚红指示液取甲酚红0.1g,加0.05mol/L氢氧化钠溶液5.3ml使溶解,再加水稀释至100ml,即得。
百里酚蓝指示剂:0.1g百里酚蓝溶于20mL乙醇中,加水至100mL。
酚酞指示剂(10g/L)[盐酸滴定液(1.000mol/L)][配制] 取盐酸90ml ,加水适量使成1000ml ,摇匀。
[试样配制]取36g 工业氢氧化钠固体,溶解于1L 容量瓶内,摇匀。
(或称取180g 试样,溶于500ml 容量瓶内,使用使稀释10倍即可)2、器皿250ml 锥形瓶、50ml 移液管、磁力搅拌器、酸式滴定管四、实验步骤1、盐酸标准滴定液的标定取干燥至恒重的无水碳酸钠约1.5g ,精密称定,加水50ml 使溶解,加甲基红-溴甲酚绿混合指示剂10滴,用本液滴定至溶液由绿色变为紫红色,煮沸2分钟,冷却至室温,继续滴定至溶液由绿色变为暗紫色。


工业用氢氧化钠国标(实用版)目录1.氢氧化钠的概述2.工业用氢氧化钠国家标准的意义3.工业用氢氧化钠的主要产品4.工业用氢氧化钠中氢氧化钠和碳酸钠含量的测定方法5.工业用氢氧化钠的价格正文氢氧化钠,化学式为 NaOH,是一种强碱性化合物,常被用于工业生产中。
在我国,工业用氢氧化钠的生产和应用有着严格的国家标准,以确保其质量和安全。
一、氢氧化钠的概述氢氧化钠,也被称为烧碱、火碱或苛性钠,是一种常见的强碱性化学物质。
它在工业生产中有着广泛的应用,如用于制造肥皂、纸浆、纺织品等。
同时,氢氧化钠也是许多化学反应的常用试剂,如酸碱中和反应等。
二、工业用氢氧化钠国家标准的意义工业用氢氧化钠国家标准的制定,是为了保证产品质量,确保产品在使用过程中的安全。
标准中规定了工业用氢氧化钠的要求、采样、试验方法、检验规则及标志、包装、运输和储存、安全等内容,是工业用氢氧化钠生产和应用的指南。
三、工业用氢氧化钠的主要产品重庆远诚化工有限公司是一家专业生产工业用氢氧化钠的企业,其主要产品包括片碱、纯碱、氯化钙、聚合氯化铝、氯化铵、次氯酸钠、聚丙烯酰胺、石灰、活性炭、硫酸铵、硫酸钠等。
这些产品广泛应用于化工、冶金、建筑、纺织、造纸等行业。
四、工业用氢氧化钠中氢氧化钠和碳酸钠含量的测定方法工业用氢氧化钠中氢氧化钠和碳酸钠含量的测定,通常采用滴定法。
本标准等效采用 ISO 3196-1975《工业用氢氧化钠—碳酸盐含量测定—滴定法》。
本标准规定了工业用氢氧化钠中碳酸盐含量的测定方法,包括仪器和试剂的准备、采样、试验步骤等。
五、工业用氢氧化钠的价格工业用氢氧化钠的价格因生产厂家、地区、产品规格等因素而异。
一般来说,工业用氢氧化钠的价格在几千元到一万多元一吨之间。
具体价格需要咨询相关厂家或查阅行业报价。
综上所述,工业用氢氧化钠国家标准对于保证产品质量和安全有着重要的意义。
摘要:本文分别采用GB4348.1-2013中规定的氢氧化钠和碳酸钠含量的测定方法和双指示剂法对工业氢氧化钠品质进行分析。
通过实验测定得知用双指示剂法分析工业氢氧化钠中氢氧化钠和碳酸钠含量,与其实际值相差悬殊,不准确;GB4348.1-2013法分析工业氢氧化钠中氢氧化钠和碳酸钠含量与实际值相符;因此,建议采用GB4348.1-2013规定的氯化钡法进行分析。
关键词:工业氢氧化钠双指示剂法国标法0引言作为重要的基本化工原料,氢氧化钠在石油、化工、纺织等行业得到广泛的应用,具有较高的经济延伸价值。
氢氧化钠和碳酸钠含量作为主要性能指标,通常情况下可以反映工业用氢氧化钠产品的质量,所以,测定氢氧化钠和碳酸钠含量对氯碱生产具有重要的意义。
笔者利用国标规定方法———氯化钡法和双指示剂法对工业氢氧化钠产品中氢氧化钠和碳酸钠含量进行测定,并对实验结果进行分析。
1双指示剂法测定氢氧化钠和碳酸钠含量1.1测定原理利用盐酸滴定氢氧化钠和碳酸钠时,可用酚酞和甲基橙两种不同指示剂测定工业氢氧化钠中的氢氧化钠、碳酸钠含量,滴定过程中会出现两个终点,反应方程式为:NaOH+HCl→NaCl+H2O;Na2CO3+HCl→NaHCO3+NaCl。
加入甲基橙指示剂,这时碳酸氢钠生成二氧化碳,反应的方程式为:NaHCO3+HCl→NaCl+H2O+CO2↓。
氢氧化钠和碳酸钠的含量可以根据两次消耗盐酸标准溶液的体积及盐酸标准溶液的浓度进行计算。
1.2试剂和仪器浓度为1mol/L的盐酸标准溶液,质量浓度为1g/L的甲基橙指示剂,质量浓度为10g/L的酚酞指示剂;1支酸式滴定管,1只1000mL的容量瓶,1支50mL的移液管,若干个三角瓶、称量瓶。
1.3测定步骤1.3.1盐酸标准溶液的标定。
①准确称取一定量基准物质(碳酸钠)0.2g(精确至0.0001g)于100mL锥形瓶中,然后加入50mL的去离子水进行加热溶解。
②将碳酸钠溶解后,加入8-10滴甲基红———溴甲酚绿指示剂,利用0.1mol/L的HCl溶液将溶液由绿色滴定成暗红色,在电炉上加热煮沸2min,除去其中的二氧化碳。
项目一工业氢氧化钠中氢氧化钠及碳酸钠含量测定一、实验目的(1)掌握酸碱滴定的相关知识在工业氢氧化钠分析检验的应用。
(2)掌握工业氢氧化钠分析检验中各项技术指标的分析条件二.实验原理1 氢氧化钠含量测定的原理试样溶液中先加入氯化钡,将碳酸钠转化为碳酸钡沉淀,然后以酚酞为指示剂,用盐酸标准滴定溶液滴定至终点。
反应如下:Na2CO3+BaCl2→BaCO3↓+2NaClNaOH+HCl→NaCl+H2O2 碳酸钠含量测定的原理试样溶液以溴甲酚绿一甲基红为指示剂,用盐酸标准滴定溶液滴定至终点,测得氢氧化钠和碳酸钠总和,再减去氢氧化钠含量,则可测得碳酸钠含量。
Na2CO3+2HCl→CO2+2NaCl+H2ONaOH+HCl→NaCl+H2O三.试剂仪器准备1、药品及试剂配制NaOH、无水Na2CO3、甲酚红、百里酚蓝、氯化钡、无水乙醇或95乙醇、溴甲酚绿、甲基红、酚酞[溴甲酚绿—甲基红混合指示剂配置]0.1%的溴甲酚绿乙醇溶液配制:称取0.10g溴甲酚绿,溶于乙醇,用乙醇稀释至100ml即可。
0.2%的甲基红乙醇溶液配制:称取0.20g甲基红,溶于乙醇,用乙醇稀释至100ml即可。
将0.1%的溴甲酚绿乙醇溶液与0.2%的甲基红乙醇溶液按3:1的体积比混合摇匀即得溴甲酚绿—甲基红混合指示剂。
甲酚红指示剂1份,0.1%百里酚蓝溶液3份混合即得甲酚红指示液取甲酚红0.1g,加0.05mol/L氢氧化钠溶液5.3ml使溶解,再加水稀释至100ml,即得。
百里酚蓝指示剂:0.1g百里酚蓝溶于20mL乙醇中,加水至100mL。
酚酞指示剂(10g/L)[盐酸滴定液(1.000mol/L)][配制] 取盐酸90ml ,加水适量使成1000ml ,摇匀。
[试样配制]取36g 工业氢氧化钠固体,溶解于1L 容量瓶内,摇匀。
(或称取180g 试样,溶于500ml 容量瓶内,使用使稀释10倍即可)2、器皿250ml 锥形瓶、50ml 移液管、磁力搅拌器、酸式滴定管四、实验步骤1、盐酸标准滴定液的标定取干燥至恒重的无水碳酸钠约1.5g ,精密称定,加水50ml 使溶解,加甲基红-溴甲酚绿混合指示剂10滴,用本液滴定至溶液由绿色变为紫红色,煮沸2分钟,冷却至室温,继续滴定至溶液由绿色变为暗紫色。
中华人民共和国电力行业标准DL 425.2—91工业氢氧化钠中氢氧化钠和碳酸钠含量的测定——滴定法中华人民共和国能源部1991-10-04批准 1992-04-01实施本标准适用于 GB 209《工业用氢氧化钠》中规定的各级工业用氢氧化钠。
1 方法概要1.1 氢氧化钠含量的测定试样溶液中先加入氯化钡,则碳酸钠转化为碳酸钡沉淀,然后以酚酞为指示 剂,用盐酸标准溶液滴定,溶液由红色变为无色即为终点,反应如下:Na CO BaCl BaCO NaCl 2323+→↓+2NaOH HCl NaCl H O 2+→+1.2 碳酸钠含量的测定以甲基橙为指示剂,用盐酸标准溶液滴定,溶液由黄色变为橙色即为终点。
测 得氢氧化钠与碳酸钠的总和,再减去氢氧化钠含量,即可算出碳酸钠含量。
2 试剂2.1 10%氯化钡(分析纯)溶液(m/V )。
2.2 1%酚酞乙醇溶液(m/V )。
2.3 0.1%甲基橙溶液(m/V )。
2.4 1 mol/L 盐酸(优级纯)标准溶液。
3 测定方法3.1 试样溶液的制备用已知质量的称量瓶,迅速称取固态氢氧化钠35±1g 或液态氢氧化钠50g(称 准至0.01g),放入1000mL 容量瓶中,加二级试剂水溶解,冷却到室温后稀释至刻 度,摇匀。
3.2 氢氧化钠含量的测定吸取50.0mL 试样溶液(见3.1条),注入250mL 锥形瓶中,加入20mL 氯化钡 溶液(见2.1条),再加入2~3滴酚酞指示剂溶液(见2.2条),充分摇匀,用1mol/L 盐酸标准溶液(见2.4条)滴定,溶液由红色变为无色为终点,记录所消耗 盐酸标准溶液的体积(V)。
3.3 氢氧化钠和碳酸钠含量的测定吸取50mL 试样溶液(见3.1条),注入250mL 锥形瓶中,加2~3滴甲基橙指 示剂溶液(见2.3条),充分摇匀,用1mol/L 盐酸标准溶液(见2.4条)滴定,溶液由 黄色变为橙色为终点,记录所消耗盐酸标准溶液体积(V 1)。
工业烧碱中氢氧化钠和碳酸钠含量的测定目的掌握双指示剂滴定法的原理、操作及计算。
熟练掌握用甲基橙、酚酞指示剂判断滴定终点。
原理双指示剂法是用盐酸标准溶液滴定混合碱时,有两个差别较大的化学计量点,利用两种指示剂在不同的化学计量点的颜色变化,分别指示两个滴定终点的测定方法。
用双指示剂法测定烧碱中N aOH和Na2CO3的含量时,先以酚酞为指示剂,用HCl标准溶液滴定至溶液由红色变为无色,这是溶液中N a OH完全被中和,碳酸钠被中和为NaHC O3,其反应为NaOH +HCl =NaCl +H2ONa2CO3+HCl =NaCl +NaHCO3再加入甲基橙指示剂,继续用盐酸标准溶液滴定至溶液由黄色变为橙色,表示溶液中的NaHCO3完全被中和。
其反应为NaHCO3+HCl =NaCl +H2O +CO2根据到达各滴定终点时盐酸标准溶液的用量,计算氢氧化钠和碳酸钠的含量。
仪器与试剂仪器:250ml容量瓶1个,25ml移液管1支,5ml移液管1支,250ml锥形瓶3个,50ml酸式滴定管1支,洗耳球1个,滴瓶1个。
试剂:0.1mol/L HCl标准溶液,0.1%甲基橙指示剂,1%酚酞酒精溶液。
四、练习内容用移液管吸取5mL混合碱试样,转移至250 ml容量瓶中,用蒸馏水稀释至刻度,摇匀。
用移液管吸取上述溶液25 ml于250 ml锥形瓶中,加入酚酞指示剂1滴,用0.1 mol/L HCl标准溶液滴定至粉红色恰好消失为止,记下HCl标准溶液的用量V1 。
再加入甲基橙指示剂1-2滴,继续用HCl标准溶液滴定至溶液由黄色变为橙色为止,记下HCl标准溶液的用量V2。
平行测定3次。
记录与计算样品号123V1 mlV总mlV2 mlNaOH %平均值%相对极差%Na2CO3 %平均值%相对极差%CHCL = d = m样= V样*d =NaOH %Na2CO3 % 公式参考课本式中:C(HCl)—盐酸标准溶液的浓度,mol/L;V1—以酚酞为指示剂,滴定至终点时盐酸标准溶液的用量,ml;V2—以甲基橙为指示剂,滴定至终点时盐酸标准溶液的用量,ml;V总—滴定结束时盐酸标准溶液的总用量,m l;0.04000—NaOH的毫摩尔质量,g/mmol;0.05299—1/2 Na2CO3的毫摩尔质量,g/mmol;M样—混合碱试样的质量,g。