最新高中-化学第一章第二节化学计量在实验中的应用第2课时学案新人教版必修11
- 格式:docx
- 大小:27.32 KB
- 文档页数:4

课题:1.2.1化学计量在实验中的应用☆检测目标☆班级姓名物质的量、摩尔质量的概念的理解N/ NA=n=m/ M(A)关系的灵活应用◇要点强化☆N/ NA=n=m/ M(A)关系的灵活应用◇当堂检测☆1、下列说法正确的是()A. 物质的量是把物质的质量和微观粒子数联系起来的一个基本物理量B. 摩尔是国际单位制中七个基本物理量之一C、1摩尔氢气分子可以表示为1molH2D. 6.02×1023个H2所含分子的物质的量为1mol2、下列叙述错误的是()A.1mol任何物质都含有约6.02×1023个原子B.0.012kg12C 含有约6.02×1023个碳原子C.在使用摩尔表示物质的量的单位时,应用化学式指明粒子的种类D.物质的量是国际单位制中七个基本物理量之一3.摩尔是()A.物质的数量单位B.表示物质的质量单位C.表示物质的量的单位D.既是物质的数量单位又是物质的质量单位4.下列叙述错误的是()A.1mol任何物质都含有约6.02×1023个原子B.0.012kg12C 含有约6.02×1023个碳原子C.在使用摩尔表示物质的量的单位时,应用化学式指明粒子的种类D.物质的量是国际单位制中七个基本物理量之一5、下列物质中,物质的量最大的是__________,含分子个数最多的是__________ ,含原子个数最多的是___________,质量最大的是___________。
A、6 g H2B、0 . 5 mol CO2C、1 . 204×10 24个HCl 分子D、147 g H2SO4E、92 g C2H5OH(乙醇)6、4.5g水与g硫酸所含的分子数相等,它们所含氧原子数之比是,其中氢原子数之比是。
7、某硫酸钠溶液中含有3.01×1022个Na+,则溶液中SO42—的物质的量是该溶液中Na2SO4的质量为克。
☆(选作题) 4g NaOH溶解在水中,要使Na+离子数与水分子数之比为1:100,则需水的物质的量为 mol,其溶液中有 mol OH-,中和这些OH-,需要 mol H+,需要 g H2SO4。

高中化学《化学计量在实验中的应用》教案新人教版必修一、教学目标1. 理解化学计量的概念,掌握物质的量、摩尔、质量、体积等基本概念及其相互关系。
2. 学会运用化学计量知识进行物质的量计算,解决实际问题。
3. 了解化学实验中常用的计量仪器及其使用方法。
4. 培养学生的实验操作能力、观察能力及分析问题、解决问题的能力。
二、教学内容1. 物质的量、摩尔、质量、体积等基本概念及其相互关系。
2. 物质的量计算公式及应用。
3. 化学实验中常用的计量仪器:天平、量筒、容量瓶、滴定管等。
4. 实验操作注意事项及数据处理。
三、教学重点1. 物质的量、摩尔、质量、体积等基本概念及其相互关系。
2. 物质的量计算公式及应用。
3. 化学实验中常用的计量仪器及其使用方法。
四、教学难点1. 物质的量、摩尔、质量、体积等基本概念的理解与应用。
2. 实验数据的处理及误差分析。
五、教学方法1. 采用讲授法,讲解物质的量、摩尔、质量、体积等基本概念及其相互关系。
2. 采用实验法,让学生动手操作,掌握化学实验中常用的计量仪器及其使用方法。
3. 采用案例分析法,分析实验数据,培养学生解决实际问题的能力。
请根据实际需要自行并修改教案内容。
六、教学步骤1. 导入新课:通过一个与生活密切相关的化学实验案例,引发学生对化学计量的兴趣。
2. 讲解基本概念:讲解物质的量、摩尔、质量、体积等基本概念,并通过示例让学生理解它们之间的关系。
3. 物质的量计算:介绍物质的量计算公式,并通过例题讲解如何运用这些公式进行计算。
4. 实验操作:讲解化学实验中常用的计量仪器,如天平、量筒、容量瓶、滴定管等,以及它们的正确使用方法。
5. 数据处理与误差分析:介绍实验数据的处理方法,如何进行误差分析,以提高实验结果的准确性。
七、教学步骤1. 通过一个具体实验案例,让学生了解化学计量在实验中的应用。
2. 学生分组进行实验操作,亲身体验化学计量在实验中的实际应用。
3. 学生汇报实验结果,讨论实验中遇到的问题及解决方法。
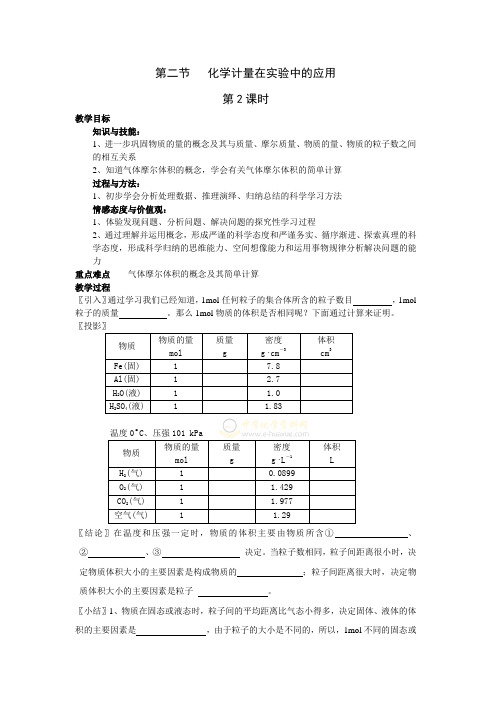
第二节化学计量在实验中的应用第2课时教学目标知识与技能:1、进一步巩固物质的量的概念及其与质量、摩尔质量、物质的量、物质的粒子数之间的相互关系2、知道气体摩尔体积的概念,学会有关气体摩尔体积的简单计算过程与方法:1、初步学会分析处理数据、推理演绎、归纳总结的科学学习方法情感态度与价值观:1、体验发现问题、分析问题、解决问题的探究性学习过程2、通过理解并运用概念,形成严谨的科学态度和严谨务实、循序渐进、探索真理的科学态度,形成科学归纳的思维能力、空间想像能力和运用事物规律分析解决问题的能力重点难点气体摩尔体积的概念及其简单计算教学过程〖引入〗通过学习我们已经知道,1mol任何粒子的集合体所含的粒子数目,1mol 粒子的质量。
那么1mol物质的体积是否相同呢?下面通过计算来证明。
〖投影〗物质物质的量mol质量g密度g·cm-3体积cm3Fe(固) 1 7.8 Al(固) 1 2.7 H2O(液) 1 1.0 H2SO4(液) 1 1.83物质物质的量mol质量g密度g·L-1体积LH2(气) 1 0.0899O2(气) 1 1.429CO2(气) 1 1.977空气(气) 1 1.29〖结论〗在温度和压强一定时,物质的体积主要由物质所含①、②、③决定。
当粒子数相同,粒子间距离很小时,决定物质体积大小的主要因素是构成物质的;粒子间距离很大时,决定物质体积大小的主要因素是粒子。
〖小结〗1、物质在固态或液态时,粒子间的平均距离比气态小得多,决定固体、液体的体积的主要因素是,由于粒子的大小是不同的,所以,1mol不同的固态或液态物质的体积是。
而气体物质分子之间的距离很大,故气体物质的体积主要决定于。
2、决定粒子间距离的主要因素是温度和压强(有何影响?),不同气体在相同的温度和压强下,分子之间的距离可以看作是的,所以,粒子数相同的气体在相同条件下有着近似相同的体积。
在相同温度和压强下,相同体积的任何气体应含有相同数目的粒子,这就是著名的阿伏加德罗定律。


教学准备1. 教学目标1、进行简单的计算;学会配制物质的量浓度溶液的方法和技能。
2、从概念的应用中,培养学生实验能力和思维能力。
培养学生发现问题和解决问题的能力。
3、通过概念的学习和溶液的配制,培养学生理论联系实际的学习自然科学的思想。
2. 教学重点/难点1、一定物质的量浓度的溶液的配制方法。
2、培养学生学习自然科学的学习兴趣以及严谨求实的学习态度。
3. 教学用具4. 标签教学过程一、物质的量浓度以单位体积溶液里所含溶质B的物质的量来表示溶液组成的物理量,叫做溶质B的物质的量浓度。
单位:mol/L.二、、物质的量浓度溶液的配制例:怎样配制0.1mol/L的Na2CO3溶液500mL?计算:Na2CO3物质的量=0.1mol/L×0.5L=0.05mol则Na2CO3质量=0.05mol×106g/mol=5.3克称量:(复习天平的使用)溶解:在烧杯中用100毫升蒸馏水使之完全溶解(注意:应冷却,不可在容量瓶中溶解)转移、洗涤:移入500mL容量瓶,洗涤烧杯和玻璃棒两到三次(用玻璃棒引流)定容:加水到接近刻度1~2厘米时,改用胶头滴管加水到刻度,摇匀。
装入试剂瓶,贴标签。
三、讨论在配制溶液中哪些操作可能引起溶液浓度的误差?1、固体药品的称量与液体药品的量取是否准确;2、把溶液向容量瓶中转移,溶液洒了;3、未洗涤烧杯和玻璃棒或洗涤了量筒;4、定容时水加多了或加少了;5、定容时未平视刻度线。
四、定容时俯视或仰视刻度线,对溶液的浓度有何影响?1、俯视或仰视刻度线对溶液浓度的影响2、俯视刻度线,实际加水量未到刻度线,使溶液的物质的量浓度增大;3、仰视刻度线,实际加水量超过刻度线,使溶液的物质的量浓度减小。
五、容量瓶的使用六忌1忌用容量瓶进行溶解(体积不准确)2忌直接往容量瓶倒液(洒到外面)3忌加水超过刻度线(浓度偏低)4忌读数仰视或俯视(仰视浓度偏低,俯视浓度偏高)5忌不洗涤玻璃棒和烧杯(浓度偏低)6忌标准液存放于容量瓶(容量瓶是量器,不是容器)六、小结物质的量浓度与溶液中溶质的质量分数一样,都是用来表示溶液组成的,但在应用中物质的量浓度有很多方便之处。

《化学计量在实验中的应用(第2课时)》学案(一)知识链接:1、摩尔是如何定义的?摩尔的对象是什么?使用它时注意什么?1、物质的体积与哪些量的大小有关?2、为什么1mol气体在标准状况下所占的体积都约是22.4升?3、什么是气体摩尔体积?表示符号是?单位?如何理解标准状况?4、气体摩尔体积、物质的量、气体的体积三者之间的关系式是如何?5、微观粒子的数量、宏观物质的质量和气体体积的关系?归纳总结三、阿伏加德罗理论:注意事项:.阿伏加德罗定律推论(1)同温、同压下:12VV= =(2)同温、同压下:12ρρ=(3)同温、同体积下:12PP= =(4)同温、同压、同体积下:12mm=努力一天成功的可能就增加一分松懈一天成功的可能就减少一分 11[巩固练习]1、判断下列说法的正误,并说明理由。
①、1mol氧气的体积约为22.4L。
()②、标准状况下,1mol水的体积约为22.4L。
()③、1mol任何气体,只有在标准状况下体积才约为22.4L。
()④、同温同压下,相同体积的两种气体所含的原子数一定相等。
()⑤、在通常状况下,1mol任何气体的体积都约是22.4L。
()⑥、体积相等的两种气体,所含的分子数一定相同吗?()2、下列有关气体体积的叙述中,正确的是()A、一定温度和压强下,各种气态物质的体积的大小,由构成气体的分子大小决定;B、一定温度和压强下,各种气态物质体积的大小,由构成气体的分子数决定。
C、不同的气体若体积不同,则它们所含的分子数也不同。
D、气体摩尔体积是指1mol任何气体所占的体积约为22.4L。
3、同压下,两种气体的物质的量相等,它们一定具有()A、相同的体积B、相同的质量C、相同的分子数D、相同的密度4、下列各项不为定值的是()A、气体的摩尔体积B、1mol气体的体积C、1mol物质的质量D、阿伏加德罗常数5、n摩尔N2和n摩尔CO相比较,下列叙述中正确的是()A、在同温同压下体积相等B、在同温同压下密度相等C、在标准状况下质量相等D、分子数相等6、在相同条件下,物质的量相同的两种气体()A 体积均为22.4L B具有相同的体积C具有相同的质量D具有相同的原子数目7、下列叙述正确的是()A镁原子的质量就是镁的相对原子质量B一个氧原子的实际质量约为16/6.02×1023gC水的相对分子质量为18g D二氧化硫的摩尔质量是64g8、同温同压下,两种气体的体积如果不相同,请你推测其主要原因是()A气体的分子大小不同B气体的物质的量不同C气体分子的化学性质不同D气体分子间的平均距离不同9、下列叙述正确的是()A同温同压下,相同体积的物质,它们的物质的量必相同B任何条件下,等物质的量的乙烯(C2H4)和一氧化碳所含的分子数必相等C 1L一氧化碳气体一定比1L氧气的质量小D等体积、等物质的量的强酸中所含的氢离子数一定相等。
第2课时教学设计三维目标知识与技能1.使学生了解摩尔质量的概念。
了解摩尔质量与相对原子质量、相对分子质量之间的关系。
2.使学生了解物质的量、摩尔质量、物质的质量之间的关系,掌握有关概念的计算。
3.进一步加深理解巩固物质的量和摩尔的概念。
过程与方法1.培养学生的逻辑推理、抽象概括的能力。
2.培养学生的计算能力,并通过计算帮助学生更好地理解概念和运用、巩固概念。
情感、态度与价值观1.使学生认识到微观和宏观的相互转化是研究化学的科学方法之一。
培养学生尊重科学的思想。
2.强调解题规范化,单位使用准确,养成良好的学习习惯。
教学重点摩尔质量的概念和相关计算教学难点摩尔质量与相对原子质量、相对分子质量之间的关系教具准备多媒体课件、投影仪教学过程引入新课师:什么是物质的量?什么是摩尔?它们的使用范围是什么?生:物质的量是表示物质所含粒子多少的物理量,摩尔是物质的量的单位。
每摩尔物质都含有阿伏加德罗常数个粒子,阿伏加德罗常数的近似值为6.02×1023mol—1。
物质的量和摩尔都只适用于表示微观粒子,不能用于表示宏观物体。
在使用物质的量时应该用化学式指明粒子的种类。
师:既然物质的量是联系微观粒子和宏观物质的桥梁,那么如何通过物质的量求出物质的质量呢?也就是说1mol物质的质量到底有多大呢?我们先填写下面的表格,看是否可以从这些数据中得出有用的结论。
[多媒体展示]生:讨论、计算、填表。
[多媒体展示]H2O的相对分子质量是18,1mol水含6.02×1023个水分子,质量是18 g,Al的相对原子质量为27,1mol铝含6.02×1023个铝原子,质量是27 g。
C的相对原子质量为12,1mol碳原子含有6.02×1023个碳原子,1mol碳原子的质量为6.02×1023个×1.993g/个=12g。
同理Fe的相对原子质量是56,1mol铁原子含6.02×1023个铁原子,是56 g。
《化学计量在实验中的应用》教学设计◆模式介绍本节的教学,采用探究式教学方式,培养学生科学的学习态度及方法。
【来源:1】本节课的教学对象是高一学生,他们具有一定的搜集处理信息的能力,对“溶剂体积”与“溶液体积”可能存在一定程度的混淆。
【来源:1】在本节课的学习中,引导学生自主探究感受概念、具体实例运用概念、交流评价强化概念、归纳小结升华概念,加深学生对概念的理解,使学生在学习过程中掌握了自主探究获取知识、应用知识的方法,解决教学的难点问题。
◆教材分析本节课选自人教版全日制普通高级中学教科书化学1(必修)第一章第二节《物质的量在化学实验中的应用》第一课时。
本节教材是在学习了“物质的量”的基础上引入的新的表示溶液组成的物理量,通过本节的探究既巩固对“物质的量”的运用,又在初中化学的基础上扩充对溶液组成表示方法的认识,提高化学计算的能力。
同时为电解质溶液、中和滴定的学习奠定基础。
◆思路说明“从教学方式与实现促进学生科学素养,主动、全面发展目标的关系来看,探究式教学应成为化学新课程教学的主要教学方式之一。
教学方式应体现学生学习科学的过程,因为学习科学的过程是学生构建知识、技能、方法、情感的过程,理解了过程的学生可以更好地学会方法,从而自主地获取科学知识。
”也就是说教师要处理好“鱼”和“渔”的关系,真正让学生成为学习的主人。
◆教学目标【知识与技能】1.使学生认识摩尔是物质的量的基本单位,了解物质的量与微观粒子之间的关系;了解摩尔质量的概念。
2.了解提出摩尔这一概念的重要性和必要性,懂得阿伏加德罗常数的涵义。
3.使学生了解物质的量、摩尔质量、物质的质量之间的关系。
能用于进行简单的化学计算。
4.理解气体摩尔体积的概念;5.掌握气体体积与物质的量之间的转换关系。
【过程与方法】1、初步培养学生演绎推理、归纳推理、逻辑推理和运用化学知识进行计算的能力。
2、通过对物质的量概念的理解,尝试从定量的角度去认识物质,体会定量研究方法对研究和学习化学的重要作用;3、经历物质的量与微观粒子数、物质的质量之间的换算,理解概念、运用和巩固概念,提高化学计算能力。
第二节化学计量在实验中的应用(第一课时)教学目标:1、使学生认识摩尔是物质的量的基本单位,了解物质的量与微观粒子之间的关系;了解摩尔质量的概念。
2、了解提出摩尔这一概念的重要性和必要性,懂得阿伏加德罗常数的涵义。
3、使学生了解物质的量、摩尔质量、物质的质量之间的关系。
能用于进行简单的化学计算。
4、初步培养学生演绎推理、归纳推理、逻辑推理和运用化学知识进行计算的能力。
情感目标:通过对概念的透彻理解,培养学生严谨、认真的学习态度,体会定量研究的方法对研究和学习化学的重要作用。
教学重点:物质的量及其单位。
教学过程:[引言]古时有一个勇敢的小伙子想娶国王美丽的公主,国王出题刁难,其中一个问题是:10kg小米是多少粒?同学们你们能不能帮帮他?[思考、讨论、回答][追问]这些方法中,那种方法最科学?[追问]谁能介绍几种生活中相似的例子?[讨论回答]箱、打、令、包、条…设计意图:引发学习兴趣,引出把微小物质扩大倍数形成一定数目的集体以便于方便生活、方便科学研究、方便相互交流。
[引入] 复习C + O2 =CO2指出化学方程式的意义。
在实验中,我们可以取12gC和32gO2反应,而无法只取1个C原子和1个氧分子反应,那么12gC中含多少个C呢?要解决这个问题,我们来学习“第2节化学计量在实验中的作用”。
[板书] 第一节化学计量在实验中的作用[讲述]可称量物质与分子、原子和离子这些微观的看不见的粒子之间有什么联系?能否用一定数目的离子集体为单位来计量它们之间的关系。
答案是肯定的。
国际科学界建议采用“物质的量”将它们联系的。
[板书] 一物质的量的单位—摩尔[讲解]物质的量也是与质量、长度一样的物理量是国际单位制中的7个基本物理量。
单位为摩尔,符号为mol。
[投影] 国际单位制(SI)的7个基本单位强调:1、物质的量表示物质所含微粒的多少,这四个字是一个整体,不得简化或增添任何字,物质的量实际上表示含有一定数目粒子的集体。
教学准备1. 教学目标(1了解物质的量及其单位,了解物质的量与微观粒子数之间的关系;(2了解摩尔质量的概念以及摩尔质量和相对原子质量、相对分子质量之间的关系;(3 通过对摩尔质量概念的理解,让学生了解物质的量、摩尔质量和物质的质量之间的关系;2. 教学重点/难点教学重点:(1)物质的量及其单位、阿伏加德罗常数;(2)摩尔质量概念和有关摩尔质量概念的计算;教学难点:物质的量概念的教学3. 教学用具4. 标签教学过程[教师] 我们在初中已经知道分子、原子、离子等我们肉眼看不见的微观粒子,可以构成我们看得见的、客观存在的、具有一定质量的宏观物质。
在化学实验室做实验时取药品都是称量的,而物质间的化学反应是原子、离子按一定数目关系进行的,这说明,在我们肉眼看不见的微观粒子与看得见的宏观物质之间必定存在某种联系。
例如S + O2 === SO2微观角度:1个硫原子 1个氧分子 1个SO2分子宏观角度: 32g 32g 64g从上述方程式我们可以看到什么呢?[学生]看到反应物、生成物的数目和质量关系。
那么我们就需要一个桥梁把宏观的质量和微观的粒子数联系起来,这个物理量就是物质的量。
[教师]第14届国际计量大会通过以“物质的量”作为化学计量的基本单位量,至此,物质的量和长度、质量、时间等成为国际单位制中的7个基本单位。
1.物质的量及摩尔老师:我们用长度来表示物体的长短,用电流来表示通电的强度,而物质的量是用来表示物质所含粒子数的集体,用符号n表示。
物质的量的单位为摩尔,符号为mol.那么1mol所含有的粒子数是多少呢?下面我们先回顾一下长度的单位--米。
[教师]在我们的计量上,多长为1米呢?“米”这个单位是如何得来的呢?[教师]国际计量组织规定光在真空中于1/299792458秒时间间隔内所经路径的长度为1m,那么1mol的粒子数是多少呢?请同学们先完成以下计算,看看有什么发现。
[学生]计算并填写[结果]粒子数都是6.02×1023个,所以人们也规定了含有6.02×1023个粒子的物质为1mol.1mol就像我们平时所说的一个、一打一样,表示的是数量的单位。
最新高中-化学第一章第二节化学计量在实验中的应用第2课时学案新人教版必修11
【学习目标】
1.知道影响气体体积大小的因素;
2. 能说出气体摩尔体积的含义;
3. 能运用气体摩尔体积的计算公式进行简单的计算。
【学习过程】
物质的体积与组成物质粒子有什么关系?
(1)总结规律:①相同条件下,相同物质的量的不同物质所占的体积:固体<液体<气体。
②相同条件下,相同物质的量的气体体积近似相等,而固体、液体却不相等。
(2)决定物质体积大小的因素:①物质粒子数的多少;②物质粒子本身的大小;③物质粒子之间距离的大小。
(3)决定气体体积大小的因素:气体分子间平均距离比分子直径大得多,因此,当气体的物质的量(粒子数)一定时,决定气体体积大小的主要因素是粒子间平均距离的大小。
(4)影响气体分子间平均距离大小的因素:温度和压强,温度越高,体积越大;压强越大,体积越小。
当温度和压强一定时,气体分子间的平均距离大小几乎是一个定值,故粒子数一定时,其体积是一定值。
1. 气体摩尔体积:一定的温度和压强下,单位物质的量气体所占的体积叫气体摩尔体积。
V m = V/n,单位为L·mol-1和m3·mol-1。
(1)标准状况即0℃、1个大气压(101 kPa),简写为STP。
(2)在相同的温度和压强下,1mol任何气体所占的体积在数值上近似相等。
任何气体包
括纯净气体和混合气体。
(3)标准状况下,气体的摩尔体积约为22.4 L ·mol -1。
(4)气体摩尔体积受温度和压强的影响,不同条件下,气体的摩尔体积可能不同,标况下约为22.4 L ·mol -1
,但不是标况时也可能是22.4 L ·mol -1(比如温度高于0℃,压强小于101 kPa)。
2. 阿伏加德罗定律:
(1)定义:相同温度和压强下,相同体积的任何气体都含有相同数目的分子。
(即同温同压同体积同分子数)
(2)推论:(n:物质的量;ρ:气体的密度;M :气体的摩尔质量;V :气体的体积;m :气体的质量;N :气体的分子数)
①同温、同压下:V 1/V 2 = n 1/n 2 = N 1/N 2 ②同温、同体积下:P 1/P 2 = n 1/n 2 = N 1/N 2
③同温、同压下:ρ1/ρ2 = (M 1/M 2) ·(m 2/m 1) ④同温、同压、同体积下:m 1/m 2 = M 1/M 2
⑤同温、同压、同质量下:V 1/V 2 = M 2/M 1
同温、同体积、同质量下:P 1/P 2 = M 2/M 1
(1)标准状况下的气体摩尔体积:
(2)计算公式:n =m M =N N A =
V
22.4
(标准状况)。
(3)若没有给出标准状况下.........,不能..直接应用22.4L ·mol -1
进行计算;已知在标准状况下,而给出的是非气体物质(如H 2O ),不能..直接应用22.4L ·mol -1
进行计算。
【当堂检测】
1. 下列说法中正确的是 ( )
A .标准状况下,22.4 L·mol -1
就是气体摩尔体积 B .1 mol H 2的质量只有在标准状况下才约为2 g C .标准状况下,18 g 水的体积为22.4 L
D .H 2和O 2的混合气体1 mol 在标准状况下的体积约为22.4 L 2. 在标准状况下,与12 g H 2的体积相等的N 2的( )
A .质量为12 g
B .物质的量为6 mol
C .体积为22.4 L
D .物质的量为12 mol 3. 标准状况下,下列物质占体积最大的是( )
A .98 g H 2SO 4
B .6.02×1023个CO 2
C .44.8 L HCl
D .6 g H 2
4. (1)9.03×1023
个CH 4中,含________mol 碳原子,________mol 氢原子,________mol 质
子,________mol电子,与________个NH3含有相同数目的氢原子,标准状况下9.03×1023个CH4所占的体积为________。
(2)相同温度和压强下,等质量的SO2和O2。
二者体积比为___,分子个数比________,密度比________。
(3)标准状况下的甲烷和一氧化碳的混合气体8.96 L,其质量为7.60 g,则混合气体平均相对分子质量为________;混合气体中甲烷的体积为________;一氧化碳的质量为________。
5. 对一定量气体体积的探究。
已知1 mol不同气体在不同条件下的体积:
(1)________。
②1 mol不同的气体,在不同的条件下,体积_____(填“一定”、“一定不”或“不一定”)相等。
(2)理论依据:相同条件下,1 mol任何气体的体积几乎相等,原因是①__________,
②__________。
(3)应用:在标准状况下,4 g O2的体积为多少升?(写出计算过程)
答案与解析。