实验二 离子交换柱层析分离纯化蔗糖酶-20080917
- 格式:ppt
- 大小:450.00 KB
- 文档页数:18



蔗糖酶的提取及活力、含量和相对分子质量测定摘要:本学期共做了六次生化实验。
.第一次是提取及纯化蔗糖酶,以为后续实验提供样品。
实验主要目的是要求学生掌握高速离心机的使用。
实验共得到不同纯化度的三种提取液,标记为A、B、C。
将三种提取液分别放入冰箱保存,做为后续实验样品。
也因此做此实验时必须保证各个操作无误,及准确,以免影响后续实验的结果。
第二次是有关蔗糖酶的柱层析法,主要目的是要求同学掌握离子交换层析的原理及柱层析的操作技术及紫外吸收的分析方法。
此次实验通过柱层析及紫外吸收法得到2~3管的活力最大的分离液合并为分离液D,放入冰箱作为后续实验样品。
第三次实验为蔗糖酶的活力测定,目的为掌握酶的活力测定方法,了解各个酶的纯化情况。
利用分光度计测出各个样品的OD值,再对照葡萄糖的标准曲线来得出剩余葡萄糖的含量,从而获得各个酶的活力大小,了解各个酶的纯化情况。
并得出结论酶的纯化度越高,活力越小。
第四次实验为蔗糖酶蛋白质的含量测定,目的为掌握学习Folin-酚测定蛋白质含量的原理及方法,制备标准曲线测定未知样品中蛋白质含量。
同样利用与标准曲线对照来得到试样的蛋白质含量,并测出酶的比活力。
测量蛋白质的方法有多种,我们必须根据所做实验的具体选择合适的方法来测定蛋白质。
第五次的实验是微量凯氏定氮测总蛋白。
目的是要求同学掌握凯氏定氮法测定蛋白质含量的原理及方法。
本实验除利用了凯氏定氮法外还加上了酸式滴定法最后得出了毫克级别的总蛋白含量。
其结果与上一实验所测得的总蛋白质含量有所不同,正证明了不同的方法测量蛋白质造成的误差不同,致所得结果不同。
最后一次实验为SDS-PAGE测定蛋白质分子质量,目的为掌握SDS-聚丙烯酰胺凝胶电泳和测定蛋白质分子量技术。
此实验操作复杂,需先制作凝胶再结果染色脱色,最后还要制作标准蛋白分子质量曲线图来进行试样对照。
最后得到蔗糖酶的分子量在5万左右及9万左右。
关键字:实验;提取液;比活;蛋白质;SDS-PAGE;OD正文:1,蔗糖酶的提取及提纯1.1,文献综述:蔗糖酶的分离利用的是细胞破壁法。


1. 掌握从酵母中提取蔗糖酶的基本方法。
2. 了解酶的提取、纯化及活力测定的原理和操作。
3. 掌握酶活性测定的方法。
二、实验原理蔗糖酶(Invertase)是一种能够催化蔗糖水解成葡萄糖和果糖的酶。
本实验采用酵母作为原料,通过破碎细胞、离心、沉淀、透析等步骤提取蔗糖酶,并对其进行活力测定。
三、实验材料与仪器材料:1. 酵母(安琪酵母粉)2. 蔗糖3. 葡萄糖4. 果糖5. 磷酸盐缓冲液(pH6.0)6. 3,5-二硝基水杨酸(DNS)仪器:1. 电子天平2. 离心机3. 恒温水浴锅4. 分光光度计5. 试管6. 烧杯7. 移液器1. 酵母细胞的制备:- 称取1g酵母粉,加入10ml磷酸盐缓冲液(pH 6.0),搅拌均匀,置于37℃恒温水浴锅中保温30分钟。
- 将保温后的酵母悬液以3000r/min离心10分钟,收集上清液。
2. 酶液的提取:- 向上清液中加入等体积的50%饱和硫酸铵溶液,搅拌均匀,置于4℃冰箱中过夜。
- 将沉淀物以3000r/min离心10分钟,收集上清液即为粗酶液。
3. 酶液的透析:- 将粗酶液置于透析袋中,置于磷酸盐缓冲液(pH 6.0)中透析过夜,以去除硫酸铵等小分子杂质。
4. 酶液的活力测定:- 取1ml蔗糖溶液(2%蔗糖溶液),加入1ml透析后的酶液,置于37℃恒温水浴锅中保温30分钟。
- 取0.5ml反应液,加入2ml DNS试剂,沸水浴5分钟。
- 取出后,加入4ml蒸馏水,在540nm波长下测定吸光度。
五、实验结果与分析1. 酶液活力测定结果:- 通过DNS试剂显色,根据吸光度计算出酶的活力。
2. 结果分析:- 通过对比不同处理条件下的酶活力,分析提取、纯化过程中酶活力的影响因素。
六、实验结论1. 通过本实验,成功从酵母中提取了蔗糖酶。
2. 酶的提取、纯化过程中,酶活力受到pH、温度、离子强度等因素的影响。
3. 透析法是一种有效的酶纯化方法,可以去除小分子杂质,提高酶的纯度。

蔗糖酶的提取、分离、纯化及活性检测摘要随着分子生物学的发展,不论对酶分子本身作用机制的研究还是其他研究,越来越需要纯度更高的酶制剂,这就要求我们熟悉酶提纯的一般操作步骤及酶的提纯及活力测定等重要的生物实验技术。
本次实验主要通过提取啤酒酵母中的蔗糖酶并经过两次纯化测定其活力与Km。
在实验过程中用乙醇分级分离法,DEAE-Cellulose柱层析,分子筛(凝胶过滤)层析提取纯化蔗糖酶。
在实验过程中,虽然我们很努力,但由于我们对实验的程序不熟悉,因此在实验的一些过程中有一些明显的操作失误,使得实验的最后测定结果与理论值有一定出入。
关键词啤酒酵母蔗糖酶乙醇分级分离 DEAE-Cellulose柱层析分子筛层析Km前言生物体内所发生的一切化学反应,几乎都是在专一性酶的催化下进行的,因此酶的研究对了解生命活动的规律以及生命本质的阐述具有十分重要的意义。
随着分子生物学的发展,不论对酶分子本身作用机制的研究以及分子生物学其他重要课题的研究都越来越多地需要使用作用专一,纯度高的酶制剂。
这就要求人们建立各种方法,以便从各种生物来源的材料中分离提纯酶。
由于酶本身也是蛋白质,因此酶分离提存的方法大体上与蛋白质纯化方法相同,一般来说,没有一种固定的方法,而往往根据实验者所要分离提纯酶的取材以及酶本身的物理﹑化学及生物学性质来确定分离提纯方法。
各种酶的纯化通常有五个阶段:①材料的选择与预处理;②细胞破碎;③抽提;④纯化;⑤浓缩﹑干燥及保存。
酶分离纯化成功与否的重要标志:一是要有较高的收率;二是达到所要求的纯度,这两个指标通常是矛盾的,可根据需要来有所侧重,一般来说,好的方法与步骤应该是简单易行,最终的酶制剂有较高的收率和纯度。
就单独的每种分离提纯的方法而言,有盐析法、有机溶剂分级法、调PH分级沉淀法、选择变性法、吸附法、层析法(纸层析、薄板层析、柱层析等)。
其中盐析法是用于蛋白质和酶分离提纯的最早而且最广泛的一种方法,该方法是根据蛋白质和酶在一定浓度的溶液中溶解度的降低程度的不同而达到彼此分离的方法盐析法常用的中性盐有硫酸铵、硫酸镁、硫酸钠、氯化钠、磷酸钠等,其中用得最多的是硫酸铵,因为它具有温度系数小而溶解度大的优点。

生物化学实验示范报告:实验名称:蔗糖酶的分离提取与纯化实验目的:1.掌握蔗糖酶分离提纯的原理与实验操作方法;2.掌握有机溶剂分级纯化蔗糖酶的原理和操作方法,了解蔗糖酶的离子交换层析法纯化原理;3.掌握酶活、酶比活等基本概念及测定原理、计算和操作方法;4.巩固并熟练掌握Folin法测定牛血清蛋白和3、5 -二硝基水杨酸法测定葡萄糖标准曲线制作方法,并能通过回归方程测定还原糖及蛋白质的含量。
实验原理:蔗糖酶分离提纯原理:酵母中的蔗糖酶含量很丰富,实验以安琪酵母粉为原料,首先采用自溶法破碎细胞壁、再用乙醇分级和DEAE—纤维素柱层析两步分离提纯,制备纯度较高的蔗糖酶制剂。
酶分离提纯的原理与蛋白质的相同。
但酶是有催化活性的蛋白质,在分离提纯过程中必须注意:防止酶变性失活;随时测定酶的比活力,并跟踪酶的去向、衡量酶提纯的程度及得率。
有机溶剂分级纯化蔗糖酶原理:利用不同蛋白质在不同浓度的有机溶剂—乙醇中溶解度的差异将蔗糖酶蛋白与其它蛋白质杂质进行有机溶剂分级沉淀,而使提取的蔗糖酶得以纯化(32%的乙醇饱和度沉淀分离杂蛋白,47.5%的乙醇饱和度沉淀分离酶蛋白)。
操作必须在低温下进行且避免有机溶剂局部过浓;分离后应立刻除去有机溶剂并用水或缓冲溶液溶解沉淀的酶蛋白(复溶),确保酶的活性;pH多选在酶蛋白的等电点附近;有机溶剂在中性盐存在时能增加蛋白质的溶解度减少变性,提高分离效果。
蔗糖酶的离子交换层析法纯化原理:本实验采用DEAE-纤维素(DEAE-C11)微粒状的、弱碱性的阴离子纤维素为柱料,进行蔗糖酶的进一步纯化。
它具有分辨率高、化学性质稳定、有开放性的长链结构、有较大的表面积、对蛋白质的吸附容量大等优点;纤维素上离子基团的数量不多,排列疏散,对蛋白质的吸附不是太牢固,用缓和的洗脱条件即可达到分离的目的,不致引起蛋白质的变性。
蔗糖酶活力与比活的测定:在蔗糖酶的纯化过程中,通过3、5-二硝基水杨酸法测定蔗糖酶催化蔗糖生成还原糖的量,测定酶活力大小,跟踪酶的活力。

实验报告一、实验目的和要求 三、实验材料和主要仪器 五、实验数据记录和处理 七、实验讨论和心得二、实验内容和原理 四、实验方法和步骤 六、实验结果和分析一、实验目的和要求1、学习离子交换层析的基本原理2、学习离子交换层析分离蛋白质的基本方法和技术3、学习蔗糖酶活性检测的基本原理和方法二、实验内容和原理1、离子交换层析由于蔗糖酶的偏酸性,所以在7.3 缓冲液的环境中,粗分离纯化样品蔗糖酶带负电荷,因此我们用阴离子交换剂可以先与蔗糖酶样品可逆交换吸附,然后通过用盐离子强度逐渐提高的洗脱液,使蔗糖酶和其他杂蛋白质的电荷被中和,与离子交换剂的亲和力降低,把不同的蛋白质按所带电荷的强弱逐一被洗脱下来,从而达到分离蔗糖酶的目的。
2、酶活力检测蔗糖酶是一种水解酶,它能蔗糖水解为等量的葡萄糖和果糖(还原糖)。
(50℃水解) 3.5-二硝基水杨酸与还原糖共热被还原成棕红色的氨基化合物,在一定范围内还原糖的量和反应液的颜色深度成正比。
(100℃显色)三、实验材料和主要仪器1、实验材料蔗糖酶粗分离纯化(溶解即为样品Ⅲ) 2、实验试剂 ⑴⑵ 20 7.3 缓冲液⑶ 20 (1 )7.3缓冲液 ⑷ 0.2乙酸缓冲液,4.5 ⑸ 5%蔗糖溶液⑹ 3,5-二硝基水杨酸试剂 3、实验仪器(1)高速冷冻离心机(2)层析柱(φ1.0×20㎝ )(1支/组)(3)Ä (1套/组)(4)部分收集器及收集试管(4管)(1台/组)(5)-20℃冰箱(保存样品用)(6)微量移液枪 200、1000(7)1.5离心管(留样品Ⅲ和样品Ⅳ用)(8)7离心管(留样品Ⅳ用)(9)恒温水浴(50℃、100℃)(10)试管、移液管、试管架等四、实验方法和步骤1、仪器连接(1)接通各仪器电源,将泵头分别放置A,B两个溶液瓶中。
注意B为含溶液。
(2)点击电脑桌面上软件图标,打开软件。
选择,点击,进入操作界面。
点击(3)在操作界面的工具栏,点击。

实验报告一、实验目的和要求 三、实验材料和主要仪器 五、实验数据记录和处理 七、实验讨论和心得二、实验内容和原理 四、实验方法和步骤 六、实验结果和分析一、实验目的和要求1、学习离子交换层析的基本原理2、学习离子交换层析分离蛋白质的基本方法和技术3、学习蔗糖酶活性检测的基本原理和方法二、实验内容和原理1、离子交换层析由于蔗糖酶的pI 偏酸性,所以在pH7.3 缓冲液的环境中,粗分离纯化样品蔗糖酶带负电荷,因此我们用阴离子交换剂可以先与蔗糖酶样品可逆交换吸附,然后通过用盐离子强度逐渐提高的洗脱液,使蔗糖酶和其他杂蛋白质的电荷被中和,与离子交换剂的亲和力降低,把不同的蛋白质按所带电荷的强弱逐一被洗脱下来,从而达到分离蔗糖酶的目的。
2、酶活力检测蔗糖酶是一种水解酶,它能蔗糖水解为等量的葡萄糖和果糖(还原糖)。
(50℃水解) 3.5-二硝基水杨酸与还原糖共热被还原成棕红色的氨基化合物,在一定范围内还原糖的量和反应液的颜色深度成正比。
(100℃显色)三、实验材料和主要仪器1、实验材料蔗糖酶粗分离纯化(溶解即为样品Ⅲ) 2、实验试剂⑴ DEAE-Sepharose Fast Flow⑵ 20mmol/L Tris-HCl pH7.3 缓冲液⑶ 20mmol/L Tris-HCl (1mol/L NaCl )pH7.3缓冲液 ⑷ 0.2mol/L 乙酸缓冲液,pH4.5 ⑸ 5%蔗糖溶液⑹ 3,5-二硝基水杨酸试剂 3、实验仪器(1)高速冷冻离心机(2)层析柱(φ1.0×20㎝ )(1支/组)(3)ÄKTA TM start(1套/组)(4)部分收集器及收集试管(4ml/管)(1台/组)(5)-20℃冰箱(保存样品用)(6)微量移液枪 200ul、1000ul(7)1.5ml离心管(留样品Ⅲ和样品Ⅳ用)(8)7ml离心管(留样品Ⅳ用)(9)恒温水浴(50℃、100℃)(10)试管、移液管、试管架等四、实验方法和步骤1、仪器连接(1)接通各仪器电源,将A,B泵头分别放置A,B两个溶液瓶中。

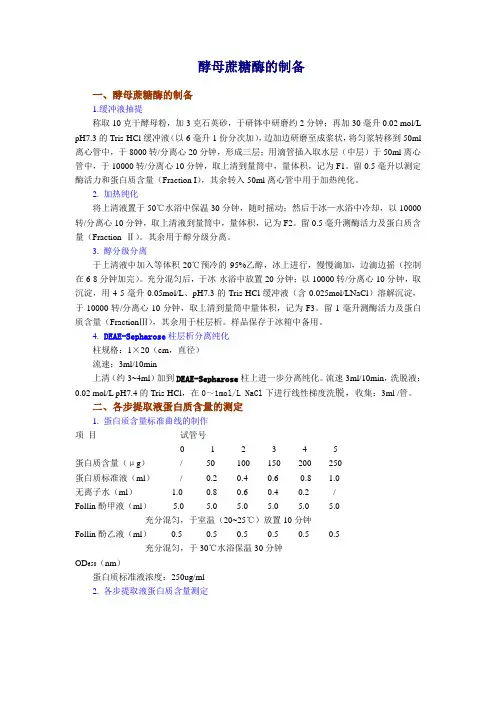
酵母蔗糖酶的制备一、酵母蔗糖酶的制备1.缓冲液抽提称取10克干酵母粉,加3克石英砂,于研钵中研磨约2分钟;再加30毫升0.02 mol/L pH7.3的Tris-HCl缓冲液(以6毫升1份分次加),边加边研磨至成浆状,将匀浆转移到50ml 离心管中,于8000转/分离心20分钟,形成三层;用滴管插入取水层(中层)于50ml离心管中,于10000转/分离心10分钟,取上清到量筒中,量体积,记为F1。
留0.5毫升以测定酶活力和蛋白质含量(Fraction I),其余转入50ml离心管中用于加热纯化。
2. 加热纯化将上清液置于50℃水浴中保温30分钟,随时摇动;然后于冰—水浴中冷却,以10000转/分离心10分钟,取上清液到量筒中,量体积,记为F2。
留0.5毫升测酶活力及蛋白质含量(Fraction Ⅱ)。
其余用于醇分级分离。
3. 醇分级分离于上清液中加入等体积-20℃预冷的95%乙醇,冰上进行,慢慢滴加,边滴边摇(控制在6-8分钟加完)。
充分混匀后,于冰-水浴中放置20分钟;以10000转/分离心10分钟,取沉淀,用4-5毫升0.05mol/L、pH7.3的Tris-HCl缓冲液(含0.025mol/LNaCl)溶解沉淀,于10000转/分离心10分钟,取上清到量筒中量体积,记为F3。
留1毫升测酶活力及蛋白质含量(FractionⅢ),其余用于柱层析。
样品保存于冰箱中备用。
4.DEAE-Sepharose柱层析分离纯化柱规格:1×20(cm,直径)流速:3ml/10min上清(约3~4ml)加到DEAE-Sepharose柱上进一步分离纯化。
流速3ml/10min,洗脱液:0.02 mol/L pH7.4的Tris-HCl,在0~1mol/L NaCl下进行线性梯度洗脱,收集:3ml /管。
二、各步提取液蛋白质含量的测定1. 蛋白质含量标准曲线的制作项目试管号0 1 2 3 4 5蛋白质含量(μg)/ 50 100 150 200 250蛋白质标准液(ml)/ 0.2 0.4 0.6 0.8 1.0无离子水(ml) 1.0 0.8 0.6 0.4 0.2 /Follin酚甲液(ml) 5.0 5.0 5.0 5.0 5.0 5.0充分混匀,于室温(20~25℃)放置10分钟Follin酚乙液(ml)0.5 0.5 0.5 0.5 0.5 0.5充分混匀,于30℃水浴保温30分钟OD650(nm)蛋白质标准液浓度:250ug/ml2. 各步提取液蛋白质含量测定(已预热到37℃)项 目 试管号空白 Fraction Ⅰ(1:10) Ⅱ(1:5) Ⅲ(1:2)1 2 3 4 5 6 7 稀释酶液(ml ) 0 0.1 0.2 0.1 0.2 0.1 0.2 无离子水(ml ) 1.0 0.9 0.8 0.9 0.8 0.9 0.8 Follin-酚甲液(ml ) 5.0 5.0 5.0 5.0 5.0 5.0 5.0充分混匀,于室温放置10分钟 Follin-酚乙液(ml ) 0.5 0.5 0.5 0.5 0.5 0.5 0.5 充分混匀,于30℃水浴保温30分钟OD 650nm蛋白质含量(μg ) 平均值(μg )提取液蛋白质总含量(mg )三、各步提取液酶总活力及比活力测定1. 葡萄糖标准曲线的制作 项目 试管号0 12 3 4 5 6 8含糖量()葡萄糖标准液(ml ) / 0.1 0.20.3 0.40.5 0.6 0.7无离子水(ml ) 2.0 1.9 1.8 1.7 1.6 1.5 1.4 1.3 DNS 试剂(ml ) 0.8 0.8 0.8 0.8 0.8 0.8 0.8 0.8混匀,于100℃水浴中保温5分钟,取出经流动水冷却后,再加5ml 蒸馏水,混匀。
生物化学实验示范报告:实验名称:蔗糖酶的分离提取与纯化实验目的:1.掌握蔗糖酶分离提纯的原理与实验操作方法;2.掌握有机溶剂分级纯化蔗糖酶的原理和操作方法,了解蔗糖酶的离子交换层析法纯化原理;3.掌握酶活、酶比活等基本概念及测定原理、计算和操作方法;4.巩固并熟练掌握Folin法测定牛血清蛋白和3、5 -二硝基水杨酸法测定葡萄糖标准曲线制作方法,并能通过回归方程测定还原糖及蛋白质的含量。
实验原理:蔗糖酶分离提纯原理:酵母中的蔗糖酶含量很丰富,实验以安琪酵母粉为原料,首先采用自溶法破碎细胞壁、再用乙醇分级和DEAE—纤维素柱层析两步分离提纯,制备纯度较高的蔗糖酶制剂。
酶分离提纯的原理与蛋白质的相同。
但酶是有催化活性的蛋白质,在分离提纯过程中必须注意:防止酶变性失活;随时测定酶的比活力,并跟踪酶的去向、衡量酶提纯的程度及得率。
有机溶剂分级纯化蔗糖酶原理:利用不同蛋白质在不同浓度的有机溶剂—乙醇中溶解度的差异将蔗糖酶蛋白与其它蛋白质杂质进行有机溶剂分级沉淀,而使提取的蔗糖酶得以纯化(32%的乙醇饱和度沉淀分离杂蛋白,47.5%的乙醇饱和度沉淀分离酶蛋白)。
操作必须在低温下进行且避免有机溶剂局部过浓;分离后应立刻除去有机溶剂并用水或缓冲溶液溶解沉淀的酶蛋白(复溶),确保酶的活性;pH多选在酶蛋白的等电点附近;有机溶剂在中性盐存在时能增加蛋白质的溶解度减少变性,提高分离效果。
蔗糖酶的离子交换层析法纯化原理:本实验采用DEAE-纤维素(DEAE-C11)微粒状的、弱碱性的阴离子纤维素为柱料,进行蔗糖酶的进一步纯化。
它具有分辨率高、化学性质稳定、有开放性的长链结构、有较大的表面积、对蛋白质的吸附容量大等优点;纤维素上离子基团的数量不多,排列疏散,对蛋白质的吸附不是太牢固,用缓和的洗脱条件即可达到分离的目的,不致引起蛋白质的变性。
蔗糖酶活力与比活的测定:在蔗糖酶的纯化过程中,通过3、5-二硝基水杨酸法测定蔗糖酶催化蔗糖生成还原糖的量,测定酶活力大小,跟踪酶的活力。
实验一、蔗糖酶的提取及粗分离一、实验目标1. 选择含蔗糖酶丰富的、价廉物美的材料,采用提取得率比较高的方法进行蔗糖酶的提取,得到初提取液。
2. 对初提取液进行初步分离,为后续的纯化提供样品。
二、导学问题1.蔗糖酶的用途,研究蔗糖酶的意义?蔗糖酶(Sucrase,EC 3.2.1.26)叉称转化酶(Invertase)。
可作用于B-1,2糖苷键,将蔗糖水解为n葡萄糖和n果糖。
由于果糖甜度高,约为蔗糖的1.36~1.60倍,在工业上具有较高的经济价值‘“。
可用以转化蔗糖,增加甜味,制造人造蜂蜜,防止高浓度糖浆中的蔗糖析出,制造含果糖和巧克力的软心糖,还可为果葡糖浆的工业化生产提供新的方法。
10分2.蔗糖酶有哪些性质?包括酶的适用pH和温度、等电点等。
蔗糖酶的最适温度为45℃~50℃,最适ph为4.0~4.5。
CuCl:对蔗糖酶有激活作用,而AgC]对蔗糖酶则其抑制作用,NaCI,KCl,FeSO。
对蔗糖酶活性无明显作用,但相对活力都保持在70%以上。
等电点5.610分3.蔗糖酶存在于什么材料中?你选择哪种材料来提取?为什么?10分4.蔗糖酶属于胞内酶,提取前需要破壁,破壁方法有哪些? 15分5.蔗糖酶提取溶剂如何选择?为什么? 10分7.蛋白质的粗分离方法有哪些?各有什么优缺点?如何选择? 25分实验二、蔗糖酶的层析分离(一)一、实验目标根据初步纯化以后的样品性质选择一种柱层析方法进行纯化,目标是纯化效果好,回收率高。
二、导学问题1.蛋白质层析分离方法有哪些? 10分2.各层析分离方法的原理?适用范围? 15分3.准备用哪种层析方法进行纯化? 5分4.针对本实验的层析方法,选择实验条件有哪些?如何选择? 10分5.如何评价纯化方法的优劣? 10分6.如何快速测定纯化过程中样品的酶活力?5分7.什么是穿透峰?穿透峰中包含哪些物质? 10分8.穿透峰如果有酶活需要保存作为下个实验的样品吗?为什么?10分9.什么是柱子的平衡?平衡的目的是什么? 5分10. 梯度洗脱方法有哪几种?各有什么优点? 10分11. 洗脱液的 pH如何选择? 5分12. 实验过程中要注意的事项? 5分实验三、蔗糖酶的层析分离(二)一、实验目标根据上个实验纯化以后的样品性质选择另一种层析方法进行纯化,目标是纯化效果好,回收率高。