蔗糖酶的提取分离
- 格式:doc
- 大小:998.00 KB
- 文档页数:7
蔗糖酶的分离提纯【实验目的】1.了解蔗糖酶分离提纯的方法。
2.掌握离心技术、电泳技术、层析技术、膜分离技术和分光光度法。
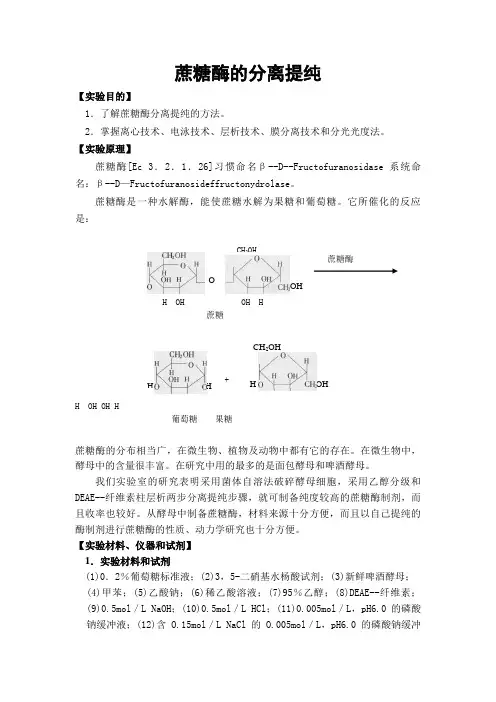
【实验原理】蔗糖酶[Ec 3.2.1.26]习惯命名β--D--Fructofuranosidase 系统命名:β--D —Fructofuranosideffructonydrolase 。
蔗糖酶是一种水解酶,能使蔗糖水解为果糖和葡萄糖。
它所催化的反应是:H OH OH H蔗糖+H OH OH H葡萄糖 果糖蔗糖酶的分布相当广,在微生物、植物及动物中都有它的存在。
在微生物中,酵母中的含量很丰富。
在研究中用的最多的是面包酵母和啤酒酵母。
我们实验室的研究表明采用菌体自溶法破碎酵母细胞,采用乙醇分级和DEAE--纤维素柱层析两步分离提纯步骤,就可制备纯度较高的蔗糖酶制剂,而且收率也较好。
从酵母中制备蔗糖酶,材料来源十分方便,而且以自己提纯的酶制剂进行蔗糖酶的性质、动力学研究也十分方便。
【实验材料、仪器和试剂】 1.实验材料和试剂(1)0.2%葡萄糖标准液;(2)3,5-二硝基水杨酸试剂;(3)新鲜啤酒酵母; (4)甲苯;(5)乙酸钠;(6)稀乙酸溶液;(7)95%乙醇;(8)DEAE--纤维素;(9)0.5mol /L NaOH ;(10)0.5mol /L HCl ;(11)0.005mol /L ,pH6.0的磷酸钠缓冲液;(12)含O.15mol /L NaCl 的O.005mol /L ,pH6.0的磷酸钠缓冲CH 2OHH OHHHOHCH 20H液;(13)5%蔗糖;(14)测定蛋白质浓度试剂;(15)聚丙烯酰胺凝胶电泳试剂2.仪器(1)恒温水浴;(2)烧杯、量筒、移液管、容量瓶、玻棒;(3)冰盐浴;(4)离心机;(5)721型分光光度计;(6)柱层析装置;(7)天平;(8)pH计; (9)滴管、试管和血糖管;(10)秒表【实验操作】一、葡萄糖浓度标准曲线的制作1.取10支血糖管,按下表加入0.2%葡萄糖溶液、水及3,5一二硝基水上述试剂混匀后,在沸水浴中加热5min,取出立即冷却,以蒸馏水稀释至25mL,摇匀,于540nm测光密度。



实验一、蔗糖酶的提取及粗分离
1. 蔗糖酶的用途,研究蔗糖酶的意义?蔗糖酶(Sucrase , EC 3.
2. 1. 26)叉称转化酶(Invertase)。
可作用于B-1 , 2糖苷键,将蔗糖水解为n葡萄糖和n果糖。
由于果糖甜度高,约为蔗糖的1. 36〜1. 60 倍,在工业上具有较高的经济价值‘“。
可用以转化蔗糖,增加甜味,制造人造蜂蜜,防止高浓度糖浆中的蔗糖析出,
制造含果糖和巧克力的软心糖,还可为果葡糖浆的工业化生产提供新的方法。
10分
2. 蔗糖酶有哪些性质?包括酶的适用pH和温度、等电点等。
蔗糖酶的最适温度为45 °C
~50 C,最适ph为4.0~4.5。
CuCl:对蔗糖酶有激活作用,而AgC]对蔗糖酶则其抑制作用,NaCI,KCI,FeSQ对蔗糖酶活性无明显作用,但相对活力都保持在70 %以上。
等电点5.6
10分
3. 蔗糖酶存在于什么材料中?你选择哪种材料来提取?为什
么?10分
4 .蔗糖酶属于胞内酶,提取前需要破壁,破壁方法有哪些?15分
5 .蔗糖酶提取溶剂如何选择?为什么?10分
7.蛋白质的粗分离方法有哪些?各有什么优缺点?如何选择?25
分
实验二、蔗糖酶的层析分离(一)
一、实验目标
根据初步纯化以后的样品性质选择一种柱层析方法进行纯化,目
标是纯化效果好,回收率高。
二、导学问题
1蛋白质层析分离方法有哪些?10分
1蛋白质层析分离方法有哪些?10分
2 .各测定方法的原理?20分。


1. 掌握从酵母中提取蔗糖酶的基本方法。
2. 了解酶的提取、纯化及活力测定的原理和操作。
3. 掌握酶活性测定的方法。
二、实验原理蔗糖酶(Invertase)是一种能够催化蔗糖水解成葡萄糖和果糖的酶。
本实验采用酵母作为原料,通过破碎细胞、离心、沉淀、透析等步骤提取蔗糖酶,并对其进行活力测定。
三、实验材料与仪器材料:1. 酵母(安琪酵母粉)2. 蔗糖3. 葡萄糖4. 果糖5. 磷酸盐缓冲液(pH6.0)6. 3,5-二硝基水杨酸(DNS)仪器:1. 电子天平2. 离心机3. 恒温水浴锅4. 分光光度计5. 试管6. 烧杯7. 移液器1. 酵母细胞的制备:- 称取1g酵母粉,加入10ml磷酸盐缓冲液(pH 6.0),搅拌均匀,置于37℃恒温水浴锅中保温30分钟。
- 将保温后的酵母悬液以3000r/min离心10分钟,收集上清液。
2. 酶液的提取:- 向上清液中加入等体积的50%饱和硫酸铵溶液,搅拌均匀,置于4℃冰箱中过夜。
- 将沉淀物以3000r/min离心10分钟,收集上清液即为粗酶液。
3. 酶液的透析:- 将粗酶液置于透析袋中,置于磷酸盐缓冲液(pH 6.0)中透析过夜,以去除硫酸铵等小分子杂质。
4. 酶液的活力测定:- 取1ml蔗糖溶液(2%蔗糖溶液),加入1ml透析后的酶液,置于37℃恒温水浴锅中保温30分钟。
- 取0.5ml反应液,加入2ml DNS试剂,沸水浴5分钟。
- 取出后,加入4ml蒸馏水,在540nm波长下测定吸光度。
五、实验结果与分析1. 酶液活力测定结果:- 通过DNS试剂显色,根据吸光度计算出酶的活力。
2. 结果分析:- 通过对比不同处理条件下的酶活力,分析提取、纯化过程中酶活力的影响因素。
六、实验结论1. 通过本实验,成功从酵母中提取了蔗糖酶。
2. 酶的提取、纯化过程中,酶活力受到pH、温度、离子强度等因素的影响。
3. 透析法是一种有效的酶纯化方法,可以去除小分子杂质,提高酶的纯度。

蔗糖酶的提取、分离、纯化及活性检测摘要随着分子生物学的发展,不论对酶分子本身作用机制的研究还是其他研究,越来越需要纯度更高的酶制剂,这就要求我们熟悉酶提纯的一般操作步骤及酶的提纯及活力测定等重要的生物实验技术。
本次实验主要通过提取啤酒酵母中的蔗糖酶并经过两次纯化测定其活力与Km。
在实验过程中用乙醇分级分离法,DEAE-Cellulose柱层析,分子筛(凝胶过滤)层析提取纯化蔗糖酶。
在实验过程中,虽然我们很努力,但由于我们对实验的程序不熟悉,因此在实验的一些过程中有一些明显的操作失误,使得实验的最后测定结果与理论值有一定出入。
关键词啤酒酵母蔗糖酶乙醇分级分离 DEAE-Cellulose柱层析分子筛层析Km前言生物体内所发生的一切化学反应,几乎都是在专一性酶的催化下进行的,因此酶的研究对了解生命活动的规律以及生命本质的阐述具有十分重要的意义。
随着分子生物学的发展,不论对酶分子本身作用机制的研究以及分子生物学其他重要课题的研究都越来越多地需要使用作用专一,纯度高的酶制剂。
这就要求人们建立各种方法,以便从各种生物来源的材料中分离提纯酶。
由于酶本身也是蛋白质,因此酶分离提存的方法大体上与蛋白质纯化方法相同,一般来说,没有一种固定的方法,而往往根据实验者所要分离提纯酶的取材以及酶本身的物理﹑化学及生物学性质来确定分离提纯方法。
各种酶的纯化通常有五个阶段:①材料的选择与预处理;②细胞破碎;③抽提;④纯化;⑤浓缩﹑干燥及保存。
酶分离纯化成功与否的重要标志:一是要有较高的收率;二是达到所要求的纯度,这两个指标通常是矛盾的,可根据需要来有所侧重,一般来说,好的方法与步骤应该是简单易行,最终的酶制剂有较高的收率和纯度。
就单独的每种分离提纯的方法而言,有盐析法、有机溶剂分级法、调PH分级沉淀法、选择变性法、吸附法、层析法(纸层析、薄板层析、柱层析等)。
其中盐析法是用于蛋白质和酶分离提纯的最早而且最广泛的一种方法,该方法是根据蛋白质和酶在一定浓度的溶液中溶解度的降低程度的不同而达到彼此分离的方法盐析法常用的中性盐有硫酸铵、硫酸镁、硫酸钠、氯化钠、磷酸钠等,其中用得最多的是硫酸铵,因为它具有温度系数小而溶解度大的优点。

蔗糖酶的提取过程的原理蔗糖酶是一种重要的酶类物质,其作用是分解蔗糖,将其转化为葡萄糖和果糖等单糖。
蔗糖酶现已被广泛应用于工业和食品加工等领域,因此对于蔗糖酶的提取过程和原理的研究十分重要。
蔗糖酶的提取原理:蔗糖酶主要是存在于细胞内的酶类物质,在提取过程中需要破碎细胞壁、细胞膜等障碍物,使酶类物质释放出来。
因此,蔗糖酶的提取过程可步骤分为细胞破碎、酶的提取、分离纯化等环节。
细胞破碎细胞破碎是蔗糖酶提取的第一步,其目的是将细胞壁、细胞膜等保护层破碎,以便获得高含量的酶液。
细胞破碎主要有三种方法:物理方法、生物方法、化学方法。
物理方法:包括高压破碎法、超声波破碎法、微波破碎法等技术,其中高压破碎法是最为常用的破碎方法,可通过高压融合,将含有酶的细胞破裂。
生物方法:是利用生物体内酶的辅助作用,通过胰蛋白酶等酶的介入,使细胞膜被破坏,从而释放出酶来。
化学方法:通过化学物质对生物组织进行不同程度的破坏,使细胞膜等基本单位出现裂缝,酶液就可以自由地流出。
酶的提取酶的提取是蔗糖酶提取过程的第二步,其目的是从破碎的细胞内提取蔗糖酶。
酶的提取常用的方法有:水解法、溶剂法、膜过滤法等技术。
水解法:是指通过水解反应从生物物质中分离有用成分的方法。
例如,将蔗糖酶浸泡在50温水中,持续2小时左右,使蔗糖酶转化成有利于提取的热变性酶。
溶剂法:即将蔗糖酶和溶剂混合,应用分离纯化技术获得有用的酶液。
溶剂法有界面法、反相分配法、油相萃取法、溶液萃取法等。
膜过滤法:是利用一定的压力,将蔗糖酶溶液通过一定孔径大小的膜片,将酶体分离纯化出来。
分离纯化分离和纯化是蔗糖酶提取过程中的最后一步,其目的是获得高纯度和高活性的酶液。
常用的分离和纯化技术有:离子交换层析法、凝胶过滤层析法、亲和色谱法等。
其,默认是将酶液溶液经某些方法处理后,将酶从其他的杂质中过滤出来,其中离子交换层析法是最为常用的手段。
在这种方法下,蔗糖酶分子通过吸附原理与活性生物载体进行相互作用,去除杂质,实现酶活性的提高和纯度的提高。
蔗糖酶的分离提纯【实验目的】1.了解蔗糖酶分离提纯的方法。
2.掌握离心技术、电泳技术、层析技术、膜分离技术和分光光度法。
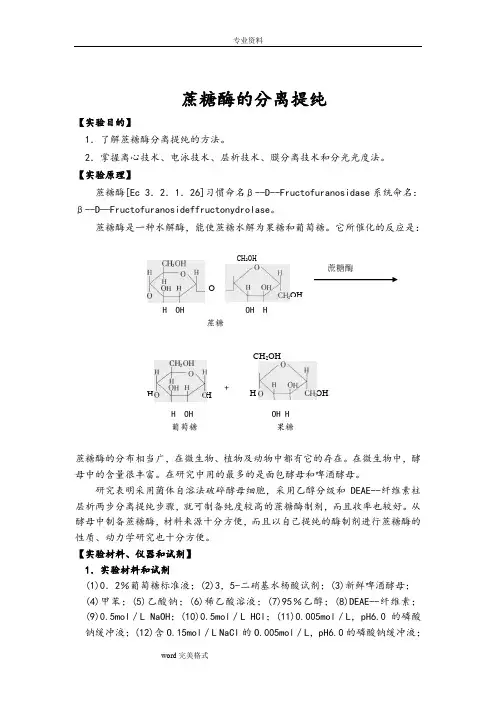
【实验原理】蔗糖酶[Ec 3.2.1.26]习惯命名β--D--Fructofuranosidase 系统命名:β--D —Fructofuranosideffructonydrolase 。
蔗糖酶是一种水解酶,能使蔗糖水解为果糖和葡萄糖。
它所催化的反应是:H OH OH H蔗糖+H OH OH H 葡萄糖 果糖蔗糖酶的分布相当广,在微生物、植物及动物中都有它的存在。
在微生物中,酵母中的含量很丰富。
在研究中用的最多的是面包酵母和啤酒酵母。
研究表明采用菌体自溶法破碎酵母细胞,采用乙醇分级和DEAE--纤维素柱层析两步分离提纯步骤,就可制备纯度较高的蔗糖酶制剂,而且收率也较好。
从酵母中制备蔗糖酶,材料来源十分方便,而且以自己提纯的酶制剂进行蔗糖酶的性质、动力学研究也十分方便。
【实验材料、仪器和试剂】 1.实验材料和试剂(1)0.2%葡萄糖标准液;(2)3,5-二硝基水杨酸试剂;(3)新鲜啤酒酵母; (4)甲苯;(5)乙酸钠;(6)稀乙酸溶液;(7)95%乙醇;(8)DEAE--纤维素;(9)0.5mol /L NaOH ;(10)0.5mol /L HCl ;(11)0.005mol /L ,pH6.0的磷酸钠缓冲液;(12)含O.15mol /L NaCl 的O.005mol /L ,pH6.0的磷酸钠缓冲液;CH 2OHH OHHHOHCH 20H(13)5%蔗糖;(14)测定蛋白质浓度试剂;(15)聚丙烯酰胺凝胶电泳试剂2.仪器(1)恒温水浴;(2)烧杯、量筒、移液管、容量瓶、玻棒;(3)冰盐浴;(4)离心机;(5)721型分光光度计;(6)柱层析装置;(7)天平;(8)pH计;(9)滴管、试管和血糖管;(10)秒表【方法】一、葡萄糖浓度标准曲线的制作1.取10支血糖管,按下表加入0.2%葡萄糖溶液、水及3,5一二硝基水杨上述试剂混匀后,在沸水浴中加热5min,取出立即冷却,以蒸馏水稀释至25mL,摇匀,于540nm测光密度。

蔗糖酶的提取及活力、含量和相对分子质量测定摘要:本学期共做了六次生化实验。
.第一次是提取及纯化蔗糖酶,以为后续实验提供样品。
实验主要目的是要求学生掌握高速离心机的使用。
实验共得到不同纯化度的三种提取液,标记为A、B、C。
将三种提取液分别放入冰箱保存,做为后续实验样品。
也因此做此实验时必须保证各个操作无误,及准确,以免影响后续实验的结果。
第二次是有关蔗糖酶的柱层析法,主要目的是要求同学掌握离子交换层析的原理及柱层析的操作技术及紫外吸收的分析方法。
此次实验通过柱层析及紫外吸收法得到2~3管的活力最大的分离液合并为分离液D,放入冰箱作为后续实验样品。
第三次实验为蔗糖酶的活力测定,目的为掌握酶的活力测定方法,了解各个酶的纯化情况。
利用分光度计测出各个样品的OD值,再对照葡萄糖的标准曲线来得出剩余葡萄糖的含量,从而获得各个酶的活力大小,了解各个酶的纯化情况。
并得出结论酶的纯化度越高,活力越小。
第四次实验为蔗糖酶蛋白质的含量测定,目的为掌握学习Folin-酚测定蛋白质含量的原理及方法,制备标准曲线测定未知样品中蛋白质含量。
同样利用与标准曲线对照来得到试样的蛋白质含量,并测出酶的比活力。
测量蛋白质的方法有多种,我们必须根据所做实验的具体选择合适的方法来测定蛋白质。
第五次的实验是微量凯氏定氮测总蛋白。
目的是要求同学掌握凯氏定氮法测定蛋白质含量的原理及方法。
本实验除利用了凯氏定氮法外还加上了酸式滴定法最后得出了毫克级别的总蛋白含量。
其结果与上一实验所测得的总蛋白质含量有所不同,正证明了不同的方法测量蛋白质造成的误差不同,致所得结果不同。
最后一次实验为SDS-PAGE测定蛋白质分子质量,目的为掌握SDS-聚丙烯酰胺凝胶电泳和测定蛋白质分子量技术。
此实验操作复杂,需先制作凝胶再结果染色脱色,最后还要制作标准蛋白分子质量曲线图来进行试样对照。
最后得到蔗糖酶的分子量在5万左右及9万左右。
关键字:实验;提取液;比活;蛋白质;SDS-PAGE;OD正文:1,蔗糖酶的提取及提纯1.1,文献综述:蔗糖酶的分离利用的是细胞破壁法。

一、实验目的和要求学习掌握蔗糖酶的提取、分离纯化的基本原理和方法,学习使用高速冷冻离心机,认识制冰机。
二、实验内容和原理1.蔗糖酶简介:蔗糖酶为水解酶类,主要存在于酵母中,如啤酒酵母、面包酵母,也存在于曲霉、青霉和毛霉等霉菌和细菌及植物中,可专一性地催化蔗糖水解为果糖和葡萄糖的反应。
酵母蔗糖酶的分子量约为270000D(因来源不同,分子量也存在差异)。
本实验中所用酵母蔗糖酶的PI约为4.8,最适pH为4.6,耐酸和热,最适温度50C,耐乙醇,在47.5%的乙醇溶液中能够沉淀且活性保持,因此可用乙醇纯化法进行分离提纯。
2. 酵母蔗糖酶的制备原理:上层:脂溶性物质(本实验用的提取液关系本酵母缓冲液、石英砂破细离心层不明显)细胞研磨胞中层(水层):蔗糖酶、可溶性杂质等下层(沉淀):细胞碎片、变性蛋白等上清:蔗糖酶、可溶性杂质(如糖类、 50℃水浴中代谢中间物、RNA、DNA和未变取中层保温30min 使热不稳定离心性的酶和蛋白质)等(水层)蛋白变性沉淀:变性蛋白上清:杂蛋白及可溶性杂质等加入等体积95%乙醇使蔗糖酶离心取上清沉淀冰浴20min 沉淀:蔗糖酶、杂蛋白(已变性或者与蔗糖酶在乙醇中行为一的酶)等3. 本实验中由于蔗糖酶位于酵母细胞内,所以需要先将细胞破碎,将蔗糖酶从细胞中提取出来。
细胞破碎常用的方法如下图所示:本实验采取研磨的方法,通过固体剪切法(研磨)将酵母细胞破碎。
三、实验材料和试剂1.实验材料:市售干酵母粉 10g/组(3人)。
2.实验试剂:⑴石英砂;⑵ 95% 乙醇(-20℃);⑶ 20mmol/L Tris-HCl pH7.3 缓冲液。
四、实验器材与仪器1. 电子天平(称量样品);2. 研砵(每组一套);3. 50ml高速离心管(4支/组、4孔50ml离心管架一个/组);4. 托盘天平(离心管平衡用);5. 高速冷冻离心机;6. 恒温水浴箱(50℃);7. 制冰机;8. 1.5ml离心管(留样品Ⅰ、Ⅱ用)及离心管架;9. 7ml离心管(留样品Ⅲ用)及离心管架;10. -20℃冰箱。
蔗糖酶的提取、分离、纯化及活性检测蔗糖酶是一种能够催化蔗糖水解反应的酶,广泛存在于生命体内,具有重要的应用价值。
本文主要介绍了蔗糖酶的提取、分离、纯化及活性检测方法。
一、蔗糖酶的提取1、选择合适的菌株:蔗糖酶广泛存在于细菌、真菌、植物和动物等生物体中,但不同菌株对蔗糖酶的产生能力存在差异,因此需要根据实际需求选择产酶能力较高的菌株。
2、液态培养:选用适宜的培养基和培养条件,促进菌株生长和蔗糖酶的合成。
一般情况下,最佳培养条件为温度在35℃左右,pH值为7.0左右,培养时间为24-48小时。
3、离心沉淀:将菌液离心,取上清液即为蔗糖酶提取液。
1、离子交换层析:通过调节液相pH值,利用离子交换材料对蔗糖酶进行吸附、洗脱和分离。
2、凝胶过滤层析:利用凝胶材料对蔗糖酶进行筛分,分离出不同分子量的蔗糖酶。
3、亲和层析:在固相材料上引入亲和基团,用于特异性地吸附蔗糖酶,洗脱和分离目标蛋白。
1、透析:通过半透膜对蔗糖酶真空透析,去除杂质。
2、浓缩:利用超滤膜对蔗糖酶进行浓缩。
3、电泳:运用电泳等方法对混合蛋白进行分离和分析,以实现蔗糖酶的纯化。
蔗糖酶的活性检测方法多种多样,以下介绍其中几种常见的方法。
1、邻苯二甲酸法:通过对邻苯二甲酸恒量反应条件下,测量比色产物的吸光度来检测蔗糖酶的活性。
2、甲酚磺酸法:测量甲酚磺酸转化为带电离子的速率,来判断蔗糖酶活性的多少。
3、蔗糖酶显色法:在蔗糖酶的作用下,蔗糖水解生成葡萄糖和果糖,再利用淀粉-碘酒作为指示剂,显色程度来反映蔗糖酶的活性。
总结:蔗糖酶是一种重要的酶类,在生命科学和工业生产等领域具有广泛应用。
其提取、分离、纯化及活性检测方法多种多样,需要根据不同的实验条件和需求来选择合适的方法。
生物化学实验示范报告:实验名称:蔗糖酶的分离提取与纯化实验目的:1.掌握蔗糖酶分离提纯的原理与实验操作方法;2.掌握有机溶剂分级纯化蔗糖酶的原理和操作方法,了解蔗糖酶的离子交换层析法纯化原理;3.掌握酶活、酶比活等基本概念及测定原理、计算和操作方法;4.巩固并熟练掌握Folin法测定牛血清蛋白和3、5 -二硝基水杨酸法测定葡萄糖标准曲线制作方法,并能通过回归方程测定还原糖及蛋白质的含量。
实验原理:蔗糖酶分离提纯原理:酵母中的蔗糖酶含量很丰富,实验以安琪酵母粉为原料,首先采用自溶法破碎细胞壁、再用乙醇分级和DEAE—纤维素柱层析两步分离提纯,制备纯度较高的蔗糖酶制剂。
酶分离提纯的原理与蛋白质的相同。
但酶是有催化活性的蛋白质,在分离提纯过程中必须注意:防止酶变性失活;随时测定酶的比活力,并跟踪酶的去向、衡量酶提纯的程度及得率。
有机溶剂分级纯化蔗糖酶原理:利用不同蛋白质在不同浓度的有机溶剂—乙醇中溶解度的差异将蔗糖酶蛋白与其它蛋白质杂质进行有机溶剂分级沉淀,而使提取的蔗糖酶得以纯化(32%的乙醇饱和度沉淀分离杂蛋白,47.5%的乙醇饱和度沉淀分离酶蛋白)。
操作必须在低温下进行且避免有机溶剂局部过浓;分离后应立刻除去有机溶剂并用水或缓冲溶液溶解沉淀的酶蛋白(复溶),确保酶的活性;pH多选在酶蛋白的等电点附近;有机溶剂在中性盐存在时能增加蛋白质的溶解度减少变性,提高分离效果。
蔗糖酶的离子交换层析法纯化原理:本实验采用DEAE-纤维素(DEAE-C11)微粒状的、弱碱性的阴离子纤维素为柱料,进行蔗糖酶的进一步纯化。
它具有分辨率高、化学性质稳定、有开放性的长链结构、有较大的表面积、对蛋白质的吸附容量大等优点;纤维素上离子基团的数量不多,排列疏散,对蛋白质的吸附不是太牢固,用缓和的洗脱条件即可达到分离的目的,不致引起蛋白质的变性。
蔗糖酶活力与比活的测定:在蔗糖酶的纯化过程中,通过3、5-二硝基水杨酸法测定蔗糖酶催化蔗糖生成还原糖的量,测定酶活力大小,跟踪酶的活力。
酵母蔗糖酶的提取工艺摘要蔗糖酶是一种水解酶, 广泛存在于动物、植物、微生物等各种生物体内。
它可以不可逆的催化蔗糖水解为D-葡萄糖和D-果糖,为微生物的生长提供碳源和能源。
采用甲苯自溶法、冻融法、SDS抽提法3种方法从酵母中提取蔗糖酶[1],冻融法和SDS抽提法的提取效率远高于传统的甲苯自溶法。
其中冻融法的效率最高(纯化倍数比活力与总活力),加之其操作简便,更适合于酵母蔗糖酶大规模的制备提取。
比较了乙醇分级沉淀、硫酸铵分级沉淀对于冻融法得到的粗提物的沉淀效果,结果表明:50%(w/w)乙醇分级沉淀效果较好(比活力与总活力),乙醇分级沉淀所得蔗糖酶经DEAE-Sepharose 离子交换层析纯化后,制得高纯度的酵母蔗糖酶(比活力与总活力)。
纯化倍数为16.14倍,比活性为947.805U/mg,回收率为51.6%。
蔗糖酶的酶促动力学性质表明,蔗糖酶的最适PH值为4.5,最适温度为50℃,酶的特征米氏常数Km值为13.8mmol/L,最大反应速度Vmax为5.98ug/min。
关键词:酵母;蔗糖酶;提取;纯化Study on Purification of Invertase from YeastAbstractSucrase is widespread in prokaryotes and eukaryotes .Sucrase catalyzes the irreversible hydrolysis of sucrose into glucose and fructose.the mainfroms 实用文档of carbon and energy supplies in microorganism growth and development.This paper used three methods to extract invertase from yeast,which included in this manuscript, three different extraction method breaking cells by adding methylbenzene,frost grinding,and adding SDS for extracting invertase from yeast were investigated.Then the purified invertase was obtained by precipitatation with 50% ethyl alcohol、sequential ammonium sulpate precipitation and DEAE-Sepharose lon-exchange chromatography.The purified sucrase was characterized by SDS-PAGE.The results showed all three methods had both advantages and disadvantages.The invertase extracted by adding SDS and frost grinding had much more total activity than that of extracted by adding methylbenzene.A highest total invertase activity was found in the forst grinding,and it was a convent and economical method for commercial production of invertase from yeast.The results of our study were followed:1、Purification of invertase from yeastThe specific activity was 947.805U/mg,purification fold was 32.28.The activity recovery of sucrase was 51.6%.2、Properties of sucrase实用文档The kinetic characters of the enzyme have been studied.The optimum PH and optimum temperature for the enzyme are PH4.5 and 50℃.Km is 21mmol/Land Vmax is 6.57ug/min.Key words : yeast;invertase;extraction;purification第一部分文献综述蔗糖酶(Sucrase,EC 3.2.1.26)又称转化酶(Invertase),是将蔗糖水解成D-葡萄糖和D-果糖的ß-D-果糖苷酶的一种。
蔗糖酶的发酵生产及酶学性质研究摘要:本实验酵母中蔗糖酶进行分离纯化并对酶学性质进行了初步的研究。
结果表明:酵母蔗糖酶的最适pH为5.0, 最适温度为45℃。
关键词:蔗糖酶、酶学性质1前言蔗糖酶(Sucrase, EC3.2.1.26) 又称转化酶(Invertase)。
可作用于β-1,2糖苷键,将蔗糖水解为D-葡萄糖和D-果糖。
由于果糖甜度高,可用以转化蔗糖,增加甜味,制造人造蜂蜜,防止高浓度糖浆中的蔗糖析出,制造含果糖和巧克力的软心糖,还可为果葡糖浆的工业化生产提供新的方法。
本实验对酶的动力学性质分析, 是酶学研究的重要方面。
本研究通过一系列实验对酵母蔗糖酶的动力学性质如最适温度、最适pH、酶的固定化等进行了初步研究,更好的了解了没得性质。
2材料与方法2.1 材料与设备2.1.1 实验材料酵母、活性干酵母、壳聚糖2.1.2 试剂及配制方法葡萄糖、蔗糖、豆芽汁浸汁、Na2HPO4、KH2PO4、MgSO4、NaCl、NaOH、Na2CO3、盐酸、氨水、琼脂、酒精均为国产分析纯。
95%乙醇溶液、DEAE-Sepharose Fast Flow、1 mol/L醋酸溶液、0.05 mol/L Tris-HCl缓冲液(pH值7.3)0.05 mol/L Tris-HCl缓冲液(内含0.5 mol/L NaCl溶液,pH值7.3)葡萄糖标准液配制(1mg/ml):预先将分析纯葡萄糖置80℃烘箱内约12小时。
准确称取500mg葡萄糖于烧杯中,用蒸馏水溶解后,移至500ml容量瓶中,定容,摇匀(冰箱中4℃保存期约一星期)。
1% 3,5-二硝基水杨酸(DNS)试剂:酒石酸钾钠100 g溶于400 mL蒸馏水,加热中依次加入NaOH 5 g,3,5-二硝基水杨酸5 g,苯酚1 g,亚硫酸钠0.25 g,搅拌至溶。
冷却后定容至500 mL,储于棕色瓶室温保存。
10%蔗糖溶液:10g蔗糖溶解于蒸馏水中,定容至100ml0.1 mol/L pH 7.8 Tris-HCl缓冲液1%戊二醛溶液:将4 mL 25%戊二醛溶液用上述Tris-HCl缓冲液稀释至100mL 0.2 mol/L pH 4.5醋酸缓冲液:称取16.4g无水乙酸钠,溶解于800ml蒸馏水,用冰乙酸调节其ph至4.5,然后定溶至1000mL。
1mol/L NaoH溶液:4gNaoH溶解于100ml蒸馏水中2.1.3实验器材微生物恒温培养箱、紫外分光光度计、超净工作台高速离心机、恒温水浴锅、层析柱(1.0 cm×10 cm)、梯度混合器、核酸蛋白检测仪、台式记录仪移液管、注射器、分光光度计、水浴锅、铁架台等。
2.2 实验方法2.2.1酵母发酵液制备2.2.1.1培养基配置斜面培养基(豆芽汁葡萄糖培养基):豆芽汁浸汁 100mL葡萄糖 5.0g琼脂 2.0g自然pH0.1MPa高压蒸汽灭菌20min摇瓶培养基:蔗糖 20.0g/L蛋白胨 5.0 g/LNa2HPO44.0 g/LMgSO40.5 g/LKH2PO41.0 g/LpH 5.0~5.50.1MPa高压蒸汽灭菌20min2.2.1.2试验方法2.2.1.2.1斜面培养基的制备及斜面接种称取新鲜豆芽10.0g置于烧杯中,再加入100mL水,小火煮沸30min,用纱布过滤,补足到100mL,即制成10%豆芽汁。
按每100mL10%豆芽汁加入5.0g葡萄糖,煮沸后加入2.0g琼脂,加热融化,补足水到100mL。
分装、加塞、包扎,0.1MPa高压蒸汽灭菌20min。
将灭过菌的斜面菌种培养基摆成斜面放置一段时间看有无染菌,用未染菌的斜面培养基接种菌种,该操作在超净工作台上完成。
2.2.1.2.2斜面菌种的培养将接种后的斜面试管培养基置于28℃的恒温培养箱中培养2d至斜面培养基上长满菌体。
2.2.1.2.3液体培养准确称取蔗糖糖20.0g,蛋白胨5.0g,Na2HPO44.0g,MgSO40.5g,KH2PO41.0g,加1000mL水加热,调pH5.0~5.5,每50mL培养基加到250mL三角瓶,包扎,0.1MPa 高压蒸汽灭菌20min。
将斜面菌体用接种环接种两环,在28℃的恒温摇床110r/min中培养2d。
2.2.2酵母蔗糖酶的部分纯化2.2.2.1.破碎细胞取5 g干酵母,加5 g石英砂,置于预先冷却的研钵中,加30 mL去离子水,研磨30 min,在冰箱中冰冻约10 min(研磨液面上刚出现冰结为宜),重复2次。
将研磨液转移至大离心管中,12000 r/min离心15 min,弃去沉淀。
留0.5 mL 上清液为第一组分。
2.2.2.2.加热除杂蛋白将上清液转入三角瓶,用1 mol/L醋酸溶液逐滴加入,调其pH值至5.0,然后迅速放入50℃的水浴中,保温30 min。
在温育过程中,注意经常缓慢搅拌液体。
之后在冰浴中迅速冷却之,以12000 r/min的转速离心20 min,弃去沉淀。
留0.5 mL上清液为第二组分。
2.2.2.3.乙醇沉淀量出上清液的体积,加入等体积的95%冷乙醇溶液(预先放在-20℃低温下的时间不少于30 min),于冰浴中温和搅拌20 min。
然后以12000 r/min的转速离心25 min,小心弃去上清液,沉淀沥干。
将沉淀溶解在6 mL 0.05 mol/L Tris-HCl 缓冲液(pH值7.3)中,搅拌(5 min以上)使其完全溶解,以12000 r/min的转速离心25 min,取出0.5 mL上清液作为第三组分,剩余部分(乙醇抽提液)进行第4步操作。
2.2.3蔗糖酶酶学性质的研究2.2.3.1pH对蔗糖酶活动性的影响按下表配制7种缓冲溶液(公用):将两种缓冲试剂混合后总体积均为10ml,其溶液pH值以酸度计测量值为准。
2. 准备二组各7支试管,第一组7支试管每支都加入0.2ml上表中相应的缓冲液,然后加入一定量的蔗糖酶(此时的蔗糖酶只能用H2O稀释,酶的稀释倍数和加入量要选择适当,以便在当时的实验条件下能得到0.6~1.0的光吸收值(A650)。
另一组7支试管也是每支都加入0.2ml上表中相应的缓冲液,但不再加酶而加入等量的去离子水,分别作为测定时的空白对照管。
所有的试管都用水补足到0.8ml。
3. 所有的试管按一定时间间隔加入0.2ml蔗糖(0.2mol/L)开始反应,反应10min 后分别加入1 mL 1 mol/L NaOH终止酶促反应,加水杨酸试剂1ml,沸水浴精确反应5 min,冷却后定容至25 mL,然后测定A540的吸光值。
4. 画出不同pH下蔗糖酶活性( moles/min)与pH的关系曲线,注意画出pH 值相同,而离子不同的两点,观察不同离子对酶活性的影响。
2.2.3.2温度对酶活性的影响本实验要测定0℃~100℃,之间7个不同温度下蔗糖酶催化和酸催化的反应速度。
这7个温度是:30℃、40℃、50℃、60℃、70℃、80℃、90℃。
每个温度准备1支试管,以乙酸缓冲液作为缓冲液。
2.2.3.2.1. 确定酶的稀释倍数,试管中加入0.2ml 0.2mol/L pH4.9的乙酸缓冲液,0.2ml稀释的酶,加水至0.8ml 加入0.2ml 0.2mol/L的蔗糖开始计时,在室温下反应10min,后分别加入1 mL 1 mol/L NaOH终止酶促反应,加水杨酸试剂1ml,沸水浴精确反应5 min,冷却后定容至25 mL,然后测定A540的吸光值。
须得到0.2~1.0A的吸光度,准备一个水的空白对照管用于测定所有的样品管。
2.2.3.2.2. 测定上列各个温度下的反应速度,每次用1支试管,均加入0.2ml 乙酸缓冲液均用水调至0.8ml,放入水浴温度下使反应物平衡30秒,加入0.2mol/L 蔗糖0.2ml,准确反应10分钟,后分别加入1 mL 1 mol/L NaOH终止酶促反应,加水杨酸试剂1ml,沸水浴精确反应5 min,冷却后定容至25 mL,然后测定A540的吸光值。
记录每个水浴的准确温度。
2.2.3.2.3. 酶催化的各管A540值均进行酸催化的校正。
画出酶催化的反应速度对温度的关系曲线。
2.2.4酵母蔗糖酶的固定化2.2.4.1.壳聚糖载体的制备及戊二醛的偶联(1)称取3 g壳聚糖溶于98 mL蒸馏水中,搅拌均匀,再滴加2 mL冰醋酸,搅拌至均匀的粘稠状。
(2)称取8 g NaOH置大烧杯中,加入180 mL蒸馏水及20 mL甲醇。
(3)将拔出推塞的注射器架在铁架台上,倒入粘稠状的壳聚糖溶液,使壳聚糖溶液从20 cm高的注射器出口滴入大烧杯中,以制备壳聚糖微球载体。
注意:为保证适宜的流速,注射器中的壳聚糖溶液不宜超过10 mL,随着壳聚糖溶液逐滴滴入大烧杯,应随时补充壳聚糖溶液至刻度,并不断轻轻晃动大烧杯。
若液体表面壳聚糖微球过于密集,应静置片刻,待微球沉入烧杯底部后继续滴加。
(4)壳聚糖溶液滴加完毕后,静止片刻,待微球完全沉入烧杯底部时,反复水洗多次至pH值中性,沥干水分。
加入1%戊二醛溶液100 mL,静置2 h,使戊二醛偶联于壳聚糖载体上。
2.2.4.2.固定化酶的制备(1)将静置2 h后的壳聚糖微球载体中的戊二醛溶液倒掉,再用蒸馏水洗涤5次,以除去多余的戊二醛。
(2)将实验一纯化得到的酵母蔗糖酶酶液1 mL用蒸馏水稀释至100 mL,与偶联戊二醛的壳聚糖载体混合,静置偶联过夜。
2.2.4.3.固定化酶的评价分别测游离酶、固定化酶以及残留酶液的酶活力。
具体如下:33.1pH对蔗糖酶活动性的影响3.2 温度对酶活性的影响活力回收=固定化酶总活力数溶液酶总活力数×100%=10.8%相对活力=固定化酶总活力数溶液酶总活力数-残留酶活力数×100% =12.6%4 结论与展望通过初步的酶学研究, 蔗糖酶的最适pH为5、最适温度为35℃、固定化酶活力回收为10.8%,相对活力为12.6%。
蔗糖酶在pH2.0~6.5之间和温度25℃~55℃之间是稳定的, 即使在65℃时, 仍保留70%以上的酶活。
研究结果表明: 蔗糖酶的酶反应受果糖的竞争性抑制, 葡萄糖对蔗糖酶没有抑制效应。
参考文献[1] 孙国志,冯惠勇,徐亲民. 蔗糖酶提取方法的研究[J]. 工艺技术,2002, 1(23): 54- 55.[2] 张楚富.生物化学原理.北京:高等教育出版社,2003,9.[3] 邵雪玲, 毛歆, 郭一清.生物化学与分子生物学实验指导.武汉:武汉大学出版社,2003,10.[4] 王镜岩等. 生物化学实验指导. 北京: 高等教育出版社,2003, 8.。