2020年高中物理竞赛辅导课件★★理想气体的等温过程和绝热过程
- 格式:ppt
- 大小:1.34 MB
- 文档页数:20



理想气体的等温过程与绝热过程理想气体是指在一定温度下,气体分子之间完全没有相互作用的气体模型。
在理想气体的热力学过程中,等温过程和绝热过程是两个重要的概念。
本文将分别介绍理想气体的等温过程和绝热过程,并探讨它们的特点和应用。
一、理想气体的等温过程等温过程是指在气体发生变化的过程中,温度保持不变。
对于理想气体而言,等温过程可以用以下方程来描述:PV = 常数(1)式中,P表示气体的压强,V表示气体的体积。
根据理想气体状态方程,PV = nRT,式中,n表示气体的物质的量,R是气体常数,T是气体的绝对温度。
结合方程(1)和PV = nRT,我们可以得到:nRT = 常数(2)由方程(2)可知,在等温过程中,气体的物质的量n和体积V是成反比的关系。
也就是说,在体积增大的同时,物质的量会减少,反之亦然。
这说明了在等温过程中,气体分子会随着体积的改变而发生数量的变化。
等温过程还有一个重要的特点是气体对外做功。
根据热力学的能量守恒定律,气体所做的功等于外界对气体做的功。
在等温过程中,气体扩大或收缩的功可以通过以下公式计算:W = - nRT * ln(V2/V1) (3)式中,W表示气体所做的功,V1和V2分别表示气体的初始体积和最终体积。
二、理想气体的绝热过程绝热过程是指在气体发生变化的过程中,没有热量的交换。
绝热过程的特点是温度和压强同时变化。
对于理想气体而言,绝热过程可以用以下方程来描述:PV^γ = 常数(4)式中,γ表示气体的绝热指数,对于大多数单原子理想气体而言,γ约等于5/3。
根据理想气体状态方程,PV = nRT,我们可以推导出绝热过程中,温度和压强的关系:T = (Pv^(γ-1))/(nR) (5)式中,Tv表示绝热过程中气体的温度。
由方程(5)可知,在绝热过程中,随着气体体积的减小,气体的温度也会随之降低。
反之,体积的增大会导致温度的升高。
这与等温过程中温度保持不变的特点形成了鲜明的对比。




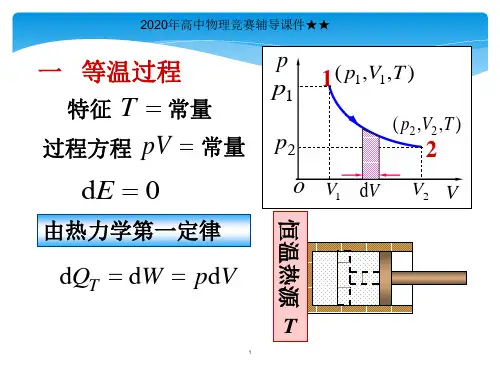

§6-5 理想气体的等温过程和绝热过程一、等温过程(Isothermal Process )1.特点:理想气体的温度保持不变,T =const 。
2.过程曲线:在PV 图上是一条双曲线,叫等温线。
3.过程方程:P 1V 1= P 2V 24.内能、功和热量的变化系统经过等温过程,从状态()T V P ,,11变成()T V P ,,22内能 012=-=∆E E E功 ⎰=21V V T PdV W由气体状态方程 RT M m PV =得 VRT M m P 1= 12ln 121V V RT M m dV V RT M m W V V T ==⎰——用体积表示。
用压强表示为21ln P P RT M m W T = 热量:由热力学第一定律得 1221ln ln V V RT M m P P RT M m Q T ==5.特征:在等压过程中,系统从外界吸收的热量,全部用来对外作功。
注意:对于等温过程,不能定义摩尔热容;如果要定义,则∞=C 。
二、绝热过程(Adiabatic Process )1.特点:系统与外界没有热量交换的过程,Q =0。
2.内能、功和热量的变化系统经过绝热过程,从状态()11T V P ,,变成()22T V P ,,内能 ()12,12T T C Mm E E E m V -=-=∆ 热量 Q =0由热力学第一定律 0=+∆=W E Q ,得功 ()12,T T C Mm W m V -=- 用状态参量P ,V 表示,根据状态方程R PV T M m =,可知()1 22112211,-=-γV P V P V P V P R C W mV --= 证明:由定义可知,m V m V m V m V mP C R C R C C C ,,,,,1+=+==γ 因而1,-=γm V C R 故 11,-=γR C m V 因而 12211-γV P V P W -= 3.特征:在绝热过程中,系统对外界所作的功是由于系统内能的减少来完成的。

理想气体的等温过程与绝热过程理想气体是指在一定的条件下,遵循理想气体状态方程的气体。
理想气体的性质在热力学中扮演着重要的角色,而等温过程和绝热过程是描述理想气体行为的两个重要过程。
本文将详细介绍理想气体的等温过程和绝热过程。
一、等温过程等温过程是指气体在恒定温度下发生的过程。
在等温过程中,气体的温度保持不变,但是压强和体积会相应发生变化。
根据理想气体状态方程PV=nRT(其中P为气体的压强,V为气体的体积,n为气体的摩尔数,R为气体常数,T为气体的温度),我们可以得出等温过程中的关系式为PV=常数。
在等温过程中,当压强增加时,体积减小;当压强减小时,体积增大,使得PV的乘积保持不变。
这说明等温过程中,气体的压强和体积呈反比关系。
等温过程可以用P-V图表示,图中等温过程是一条双曲线。
二、绝热过程绝热过程是指气体在无热交换的条件下发生的过程。
在绝热过程中,气体的内能不发生改变,即Q=0(其中Q为气体的热量变化)。
根据理想气体状态方程,我们可以推导出绝热过程中的关系式为PV^γ=常数(其中γ为绝热指数)。
在绝热过程中,当气体被压缩时,压强和温度会增加;当气体被膨胀时,压强和温度会减小,使得PV^γ的乘积保持不变。
这说明绝热过程中,气体的压强和体积呈正比关系。
三、等温过程与绝热过程的比较1. 温度变化:等温过程中气体的温度保持不变,而绝热过程中气体的温度会随着压缩或膨胀而改变。
2. 热量交换:等温过程中气体和外界之间有热量的交换,而绝热过程中气体和外界之间没有热量的交换。
3. 压强与体积关系:等温过程中,气体的压强和体积呈反比关系;绝热过程中,气体的压强和体积呈正比关系。
4. 图示表示:等温过程在P-V图上是一条双曲线;绝热过程在P-V 图上是一条陡峭的曲线。
四、结论理想气体的等温过程和绝热过程是描述气体行为的两个重要过程。
在等温过程中,气体的温度保持不变,压强和体积呈反比关系;在绝热过程中,气体的内能不发生改变,压强和体积呈正比关系。