生理学--氨基酸代谢
- 格式:ppt
- 大小:427.50 KB
- 文档页数:31

2025年研究生考试考研动物生理学与生物化学(415)测试试题及答案解析一、选择题(动物生理学部分,10题,每题2分,总分20分)1、在动物体内,脂肪酸合成的主要部位是()A. 肝脏和脂肪组织B. 心肌和脑C. 肾脏和胰腺D. 脾脏和肺答案:A解析:脂肪酸是动物体内重要的脂质成分,参与构成生物膜、作为能量储存形式以及合成其他复杂脂质。
在动物体内,脂肪酸合成的主要部位是肝脏和脂肪组织。
这两个部位含有丰富的脂肪酸合成酶系,包括乙酰CoA羧化酶、脂肪酸合成酶等,这些酶是脂肪酸合成所必需的。
同时,肝脏和脂肪组织也是脂类代谢的重要场所,能够调节脂肪酸的合成与分解,维持体内脂质平衡。
2、在糖异生过程中,关键酶之一是()A. 丙酮酸激酶B. 果糖二磷酸酶-1C. 磷酸果糖激酶-1D. 己糖激酶答案:B解析:糖异生是指生物体将多种非糖物质转变成葡萄糖或糖原的过程。
在糖异生过程中,存在一系列的关键酶,它们催化不可逆反应,从而控制糖异生的速度和方向。
其中,果糖二磷酸酶-1是糖异生过程中的关键酶之一。
它催化果糖-1,6-二磷酸水解生成果糖-6-磷酸和无机磷酸,这是糖异生中的一个重要步骤。
3、在动物体内,葡萄糖分解产生ATP最多的阶段是()A. 糖酵解阶段B. 柠檬酸循环C. 氧化磷酸化D. 磷酸戊糖途径答案:C解析:葡萄糖在动物体内通过糖酵解、柠檬酸循环和氧化磷酸化三个阶段进行分解,并产生ATP。
其中,氧化磷酸化是产生ATP最多的阶段。
在氧化磷酸化过程中,NADH和FADH₂通过电子传递链传递电子给氧,并在此过程中释放大量能量,这些能量被用于合成ATP。
相比之下,糖酵解阶段和柠檬酸循环虽然也产生ATP,但数量较少。
磷酸戊糖途径则主要用于生成NADPH和磷酸戊糖,而不是产生ATP。
4、下列关于蛋白质合成后加工过程的描述,错误的是:A. N-糖基化主要发生在内质网和高尔基体中B. C-端加工包括切除信号肽和新生肽链的C-端多余氨基酸C. 磷酸化通常发生在细胞质中,增强蛋白质的功能D. 蛋白质折叠通常由分子伴侣辅助完成答案:C解析:蛋白质合成后的加工过程包括多个步骤,每个步骤都有其特定的发生位置和作用。

微⽣物⽣理复习题及答案第⼀章绪论1、什么是微⽣物⽣理学?研究热点是什么?微⽣物⽣理学是从⽣理⽣化的⾓度研究微⽣物的形态与发⽣、结构与功能、代谢与调节、⽣长于繁殖等的机理,以及这些过程与微⽣物⽣长发育以及环境之间的关系的学科。
研究热点:环境修复;微⽣物发电、⽣物燃料;资源开发利⽤。
2、简要说明微⽣物⽣理学与其他学科的关系。
微⽣物⽣理学既是⼀门基础学科⼜是⼀门应⽤学科。
它的发展与其他学科有着密切的联系,既依赖于微⽣物学、⽣物化学、细胞⽣物学、遗传学基础学科的理论和技术,还需要数学、物理学、化学、化学⼯程、电⼦信息学和设备制造⼯程等的理论和技术。
3、简述微⽣物⽣理学中常⽤的技术与⽅法。
(1)电⼦显微技术,⼀种公认的研究⽣物⼤分⼦、超分⼦复合体及亚细胞结构的有⼒⼿段,也是研究微⽣物不可缺少的⼿段。
(2)DNA分⼦铺展技术,可⽤来检查细菌、噬菌体的染⾊体结构,还可进⾏动态跟踪。
(3)超速离⼼技术(4)光谱分析技术,包括可见光光度法(定量分析),紫外分光光度法,荧光分光光度法,红外分光光度法。
(5)层析技术,⼀种基于被分离物质的物理、化学及⽣物学特性的不同,使它们再某种基质中移动速度不同⽽进⾏分离和分析的⽅法。
纸层析,薄层层析,柱层析。
(6)电泳技术,⽤于对样品进⾏分离鉴定或提纯的技术。
等电聚焦电泳,双向电泳,⽑细管电泳,变性梯度凝胶电泳。
(7)同位素⽰踪技术,利⽤放射性核素作为⽰踪剂对研究对象进⾏标记的威廉分析⽅法。
(8)基因芯⽚与⾼通量测序技术第⼆章微⽣物的细胞结构与功能1.细胞壁及细胞膜的⽣理作⽤是什么?(2)控制细胞⽣长扩⼤(3)参与胞内外信息的传递(4)防御功能(5)识别作⽤(ps1、维持细胞形状,控制细胞⽣长,保护原⽣质体。
细胞壁增加了细胞的机械强度,并承受着内部原⽣质体由于液泡吸⽔⽽产⽣的膨压,从⽽使细胞具有⼀定的形状,这不仅有保护原⽣质体的作⽤,⽽且维持了器官与植株的固有形态.另外,壁控制着细胞的⽣长,因为细胞要扩⼤和伸长的前提是要使细胞壁松弛和不可逆伸展.2.细胞壁参与了物质运输与信息传递细胞壁允许离⼦、多糖等⼩分⼦和低分⼦量的蛋⽩质通过,⽽将⼤分⼦或微⽣物等阻于其外。
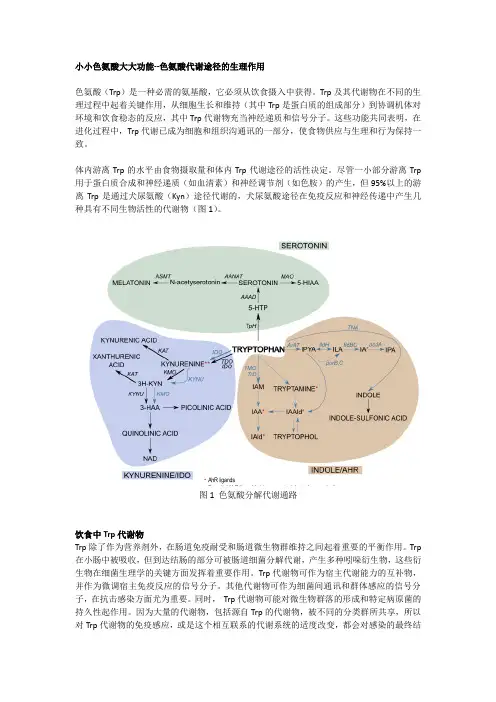
小小色氨酸大大功能--色氨酸代谢途径的生理作用色氨酸(Trp)是一种必需的氨基酸,它必须从饮食摄入中获得。
Trp及其代谢物在不同的生理过程中起着关键作用,从细胞生长和维持(其中Trp是蛋白质的组成部分)到协调机体对环境和饮食稳态的反应,其中Trp代谢物充当神经递质和信号分子。
这些功能共同表明,在进化过程中,Trp代谢已成为细胞和组织沟通讯的一部分,使食物供应与生理和行为保持一致。
体内游离Trp的水平由食物摄取量和体内Trp代谢途径的活性决定。
尽管一小部分游离Trp 用于蛋白质合成和神经递质(如血清素)和神经调节剂(如色胺)的产生,但95%以上的游离Trp是通过犬尿氨酸(Kyn)途径代谢的,犬尿氨酸途径在免疫反应和神经传递中产生几种具有不同生物活性的代谢物(图1)。
图1 色氨酸分解代谢通路饮食中Trp代谢物Trp除了作为营养剂外,在肠道免疫耐受和肠道微生物群维持之间起着重要的平衡作用。
Trp 在小肠中被吸收,但到达结肠的部分可被肠道细菌分解代谢,产生多种吲哚衍生物,这些衍生物在细菌生理学的关键方面发挥着重要作用。
Trp代谢物可作为宿主代谢能力的互补物,并作为微调宿主免疫反应的信号分子。
其他代谢物可作为细菌间通讯和群体感应的信号分子,在抗击感染方面尤为重要。
同时,Trp代谢物可能对微生物群落的形成和特定病原菌的持久性起作用。
因为大量的代谢物,包括源自Trp的代谢物,被不同的分类群所共享,所以对Trp代谢物的免疫感应,或是这个相互联系的代谢系统的适度改变,都会对感染的最终结果产生重大影响。
除了内源性宿主源性Trp代谢物外,AHR还可结合细菌分解代谢的Trp代谢产物,包括吲哚、吲哚丙酸、吲哚乙酸和色胺,这些代谢物能够在中枢神经系统局部和远端调节炎症和疾病发展。
图2 色氨酸分解代谢-关键器官参与Trp代谢物在神经元功能中的生理作用Trp犬尿氨酸途径代谢物表现出明显的神经活性特性(图3)。
喹啉酸QA刺激兴奋性N-甲基-d-天冬氨酸(NMDA)受体,犬尿氨酸作为三种离子谷氨酸受体的拮抗剂,被认为是α7-烟碱受体(α7nAChRs)的内源性负变构调节剂。

生理生化病理知识点总结
1. 生理:
- 细胞生理学:细胞的结构和功能,细胞膜的通透性,细胞的代谢和增殖等。
- 神经生理学:神经元的结构和功能,神经传导的机制,神经递质的作用等。
- 肌肉生理学:骨骼肌的结构和功能,肌肉收缩的机制,肌肉的代谢等。
2. 生物化学:
- 碳水化合物代谢:糖的分解代谢,糖原的合成和分解等。
- 脂类代谢:脂肪的合成和分解,胆固醇代谢等。
- 蛋白质代谢:蛋白质的合成和降解,氨基酸代谢等。
3. 病理:
- 炎症和免疫病理:炎症的机制和类型,免疫系统的功能和失调等。
- 肿瘤病理:肿瘤的类型和发生机制,肿瘤的治疗方法等。
- 循环系统病理:心血管疾病的发生机制,动脉粥样硬化的病理过程等。
以上是一些生理生化病理的知识点,你可以根据自己的需求添加或者修改这些知识点,组织成一篇满足你要求的文章。
希望这些知识点能对你有所帮助。

研究生考试考研动物生理学与生物化学(415)测试试卷及答案解析一、选择题(动物生理学部分,10题,每题2分,总分20分)1、下列关于动物细胞呼吸的叙述,错误的是:A. 有氧呼吸的三个阶段中,只有第三阶段能产生ATPB. 无氧呼吸过程中,葡萄糖中大部分能量储存在不彻底的氧化产物中C. 无氧呼吸时,葡萄糖中大部分能量是以热能形式散失D. 酵母菌既可进行有氧呼吸,也可进行无氧呼吸答案:C解析:本题主要考查动物细胞呼吸的过程和特点。
A. 有氧呼吸的三个阶段中,第一阶段(糖酵解)和第二阶段(柠檬酸循环)均产生少量的ATP,但第三阶段(氧化磷酸化)是产生ATP的主要阶段,通过电子传递链和ADP的磷酸化生成大量的ATP。
因此,A选项的表述是错误的,因为前两个阶段也能产生ATP,但数量远少于第三阶段。
B. 在无氧呼吸过程中,由于缺少氧气作为电子受体,葡萄糖的氧化过程被阻断在某一中间阶段,产生乳酸或酒精等不彻底的氧化产物。
这些产物中储存了葡萄糖中大部分未能释放的能量。
因此,B选项正确。
C. 在无氧呼吸中,由于缺少氧气,葡萄糖的氧化过程被阻断,导致大部分能量储存在不彻底的氧化产物中,而不是以热能形式散失。
热能主要是在有氧呼吸的第三阶段,通过氧化磷酸化过程与ADP的磷酸化偶联而产生的。
因此,C选项错误。
D. 酵母菌是一种兼性厌氧菌,既能在有氧条件下进行有氧呼吸,产生大量的ATP 和二氧化碳及水;也能在无氧条件下进行无氧呼吸,产生酒精和二氧化碳(或乳酸,取决于酵母菌的种类)。
因此,D选项正确。
2、下列关于DNA复制的说法,正确的是:A. DNA复制发生在细胞周期的分裂期B. DNA复制是半保留复制,即子代DNA分子中,一条链来自亲代,另一条链是新合成的C. DNA复制时,两条链的复制方向是相反的,但速度相同D. 原核生物和真核生物的DNA复制过程完全相同答案:B解析:本题主要考查DNA复制的过程和特点。
A. DNA复制主要发生在细胞周期的间期,特别是S期(DNA合成期),而不是分裂期。

蛋白质降解和氨基酸的分解代谢蛋白质的降解细胞总是不断地从氨基酸合成蛋白质,又把蛋白质降解为氨基酸。
从表面上看,这样的变化过程看似是一种浪费,实际上它有二重功能,其一是排除那些不正常的蛋白质,它们一旦积聚,将对细胞有害;其二是通过排除积累过多的酶和调节蛋白使细胞代谢的井然有序得以进行。
蛋白质降解的特性蛋白质有选择地降解非正常蛋白质,例如血红蛋白与缬氨酸类似物结合,得到的产物在网织红细胞中的半存活期约10min,而正常血红蛋白可延续红细胞的存活期最终可达120天。
正常的胞内蛋白被排除的速度是由它们的个性决定的,绝大多数快速降解的酶都居于重要的“代谢控制”位置,而较稳定的酶在所有生理条件下有较稳定的催化活性。
降解速度还因它的营养及激素状态而有所不同。
在营养条件被剥夺的情况下,细胞提高它的蛋白质降解速度,以维持它的必需营养源使不可或缺的代谢过程得以进行。
蛋白质降解的反应机制真核细胞对于蛋白质降解有两种体系,一个是溶酶体的降解体质和一种ATP-依赖性的以细胞溶胶为基础的机制。
溶酶体溶酶体是具有单层被膜的细胞器,其中个含有50多种水解酶,包括不同种的蛋白酶,称之为组织蛋白酶。
溶酶体保持其内部PH在5左右,而它含有的酶的最适PH就是酸性。
如此可以抵制偶然的溶酶体渗漏从而保护了细胞,因此在细胞溶胶PH下,溶酶体的大部分酶都是无活性的。
溶酶体对细胞各组分的再利用是通过它融合细胞质的膜被点块即自(体吞)噬泡,并随即分解其内容物实现的。
溶酶体的阻断剂有抗虐药物——氯代奎宁(是一种弱碱,在不带电形式随意穿透溶酶体,在溶酶体内积累形成特电荷型,因此增高了溶酶体内部的pH,并阻碍了溶酶体的功能。
溶酶体降解蛋白质是无选择性的,而rong'mei't'抑制剂对于非正常蛋白或短寿命酶无快速的降解效应,但是它们可以防止饥饿状态下蛋白质的加速度崩溃。
许多正常的和病理活动都伴随溶酶体活性的升高。
ATP-依赖真核细胞蛋白质的降解主要是溶酶体的作用,但是缺少溶酶体的网织红细胞却可选择性的降解非正常蛋白质,这里有ATP-依赖的蛋白质水解体系存在ATP依赖蛋白质需要有泛肽存在。

618医学综合参考书目:618《医学综合》包括:生物化学与分子生物学、医学细胞生物学、生理学、医学免疫学。
其参考书目录如下:《生物化学与分子生物学》(第九版),查锡良、药立波主编,人民卫生出版社,2018年。
《医学细胞生物学》(第6版)陈誉华,陈志南主编,人民卫生出版社,2018年。
《生理学》(第九版),朱大年、王庭槐主编,人民卫生出版社,2018年。
《医学免疫学》(第七版),曹雪涛主编,人民卫生出版社,2018年。
一、考试要求掌握生物化学与分子生物学、细胞生物学、生理学和医学免疫学所涉及的主要概念、理论和方法,能够运用相关知识和方法解决基础医学实验中的实际问题。
二、考试内容(包括但不仅限于以下内容)1.生物化学与分子生物学(1)蛋白质的结构与功能:蛋白质元素组成特点,氨基酸的结构通式、氨基酸的分类;蛋白质一级结构的概念及其主要的化学键;蛋白质的二级结构的概念、肽单元概念、主要化学键和形式:α-螺旋,β-折叠,β-转角与无规卷曲;α-螺旋,β-折叠的结构特点;蛋白质的三级结构概念和维持其稳定的化学键;蛋白质的四级结构的概念和维持稳定的化学键;蛋白质的结构与功能的关系;蛋白质的理化性质:两性电离,胶体性质,蛋白质变性的概念和意义,紫外吸收和呈色反应。
蛋白质的沉淀,等电点沉淀,盐析、电泳的原理(2)核酸的结构与功能:核酸分子中核苷酸的连接方式,核酸的一级结构及其表示法;DNA的二级结构的特点、原核生物DNA的超螺旋结构、真核生物染色体的基本单位-核小体的结构;DNA的生物学功能RNA的种类与功能;信使RNA 和转运RNA的结构特点;tRNA二级结构的特点与功能;DNA的变性和复性概念和特点;解链曲线与Tm;核酸分子杂交原理。
(3)酶学:酶的分子组成、单纯酶和全酶;酶的活性中心的概念、必需基团的分类及其作用;酶促反应的特点:高效性、高特异性和可调节性。
底物浓度对酶促反应的影响:米一曼氏方程,Km与Vmax值的意义;抑制剂对酶促反应的影响:不可逆抑制的作用,可逆性抑制包括竞争性抑制、非竞争性抑制、反竞争性抑制的动力学特征及其生理学意义;酶原与酶原激活的过程与生理意义;变构酶和变构调节的概念;酶的共价修饰的概念和作用特点;同工酶的概念和生理意义。

中国科学院0107年生物化学与分子生物学真题中国科学院0107年生物化学与分子生物学真题一.是非题(1X10)1. 所有a氨基酸中的a碳原子差不多上一个不对称的碳原子( )2. 蛋白质的四级结构能够定义为一些特定的三级结构的肽链通过共价键形成的大分子体系的组合( )3. 依照凝胶过滤层析的原理,分子量愈小的物质,因为愈容易通过,因此最先被洗脱出来( )4. 两个或几个二级结构单元被连接多肽连接在一起,组成有专门的几何排列的局部空间结构,如此的结构称为超二级结构,有称为模体(MOTIF)( )5. 抑制剂不与底物竞争酶结合部位,则可不能表现为竞争性抑制( )6. 酶反应最适PH不仅取决于酶分子的解离情形,同时也取决于底物分子的解离情形( )7. 寡聚酶一样是指由多个相同亚基组成的酶分子( )8. 糖异生途径是由相同的一批酶催化的糖酵解途径的逆转( )9. 线粒体内膜ADP-ATP载体蛋白在促进ADP由细胞质进入完整线粒体基质的同时ATP由完整线粒体基质进入细胞质的过程是需要能量的( )10. 脂质体的直径能够小到150 ?( )11. 质膜上糖蛋白的糖基都位于膜的外侧( )12. 雄性激素在机体内可变为雌性激素( )13. CoA,NAD和FAD等辅酶中都含有腺苷酸部分( )14. 黄嘌呤氧化酶的底物是黄嘌呤,也能够是次黄嘌呤( )15. RNA连接酶和DNA连接酶的催化连接反应都需要模板( )16. DNA聚合酶和RNA聚合酶的催化反应都需要引物( )17. 真核生物m RNA两端都含有3'-OH.( )18. 在细菌中RNA聚合酶和核糖体蛋白质的合成由共同的调剂系统( )19. 所有氨酰-t RNA合成酶的作用差不多上把氨基酸连接在Trna 末端核糖的3'-羟基上( )20. 核小体中的核心组蛋白在细胞活动过程中都可不能被化学修饰( )二.选择题(1x25)1. 绒毛膜促性激素是一种_____________A. 甾醇类激素B. 脂肪酸衍生物激素C. 含氮激素2,溴化氰(CNBr)作用于____________A. 甲硫氨酰-XB. 精氨酰-XC. X-色氨酸D. X-组氨酸3.肌球蛋白分子具有下述哪一种酶的活力____________A. ATP酶B. 蛋白质激酶C. 蛋白水解酶4.神经生长因子(NGF)的活性分子由下列肽链组成________A. ααB. ββC. α2βγ25.胰岛素原是由一条"连接肽"通过碱性氨基酸残基连接其他二条链的C端和N端,这条"连接肽"称为_________A. A链B. B链C. C肽6.米氏方程双到数作图的总轴截距所对应的动力学常数为___________A. KmB. VmaxC. Km/VmaxD. Vmax/Km7.磷酸化酶激酶催化磷酸化酶的磷酸化,导致该酶__________________A. 由低活性形式变为高活性形式B. 由高活性形式变为低活性形式C. 活性不受阻碍8.底物引进一个基团以后,引起酶与底物结合能增加,现在酶催化反应速度增大,是由于______A. 结合能增大B. 增加的结合能被用来降低反应活化能C. 增加的结合能被用来降低KmD. 增加的结合能被用来增大Km9.TGFβ受体具有下列哪一种酶的活性___________A. 酪氨酸激酶B. 酪氨酸磷酸酯酶C. 丝氨酸/苏氨酸激酶D. 腺苷酸环化酶10.2000年诺贝尔生理学或医学奖予下列哪一个领域的重大奉献有关:_______________A. 结构生理学B. 发育生理学C. 神经生物学D. 免疫学11.苍术钳是一种抑制剂,它的作用位点在_______________A. 钠钾ATP酶B. 线粒体ADP-ATP载体C. 蛋白激酶CD. 线粒体呼吸链还原辅酶Q-细胞色素c氧化还原酶12.膜固有蛋白与膜脂的相互作用要紧通过__________A. 离子键B. 疏水键C. 氢键D. Van der Waal氏力13.生物膜的差不多结构是___________A. 磷脂双层两侧各附着不同蛋白质B. 磷脂形成片层结构,蛋白质位于各个片层之间C. 蛋白质为骨架,二层林脂分别附着与蛋白质的两侧D. 磷脂双层为骨架,蛋白质附着与表面或插入磷脂双层中14.辅酶Q是____________A. NADH脱氢酶的辅基B. 电子传递链的载体C. 琥珀酸脱氢酶的辅基D. 脱羧酶的辅酶15.完整线粒体在状态4下的跨膜电位可达_____________A. 1mvB. 10mvC. 100mvD. 200mv16.基因有两条链,与mRNA序列相同(T代替U)的链叫做___________A. 有义链B. 反义链C. 重链D. cDNA链17.一段寡聚合糖核苷酸TψCGm1Acmm5CC,其中含有几个修饰碱基(非修饰核苷):A. 3个B. 4C. 5D. 618.已知有的真核内含子能编码RNA,这类RNA是___________A. 核小分子RNA(sn RNA)B. 核仁小分子RNA(sno RNA)C. 核不均一RNA(hnRNA)19.别嘌呤醇可用于治疗痛风症,因为它是____________A. 鸟嘌呤脱氨酶的抑制剂,减少尿酸的生成B. 黄嘌呤氧化酶的抑制剂,减少尿酸的生成C. 尿酸氧化酶的激活剂,加速尿酸的降解20.α-鹅膏覃碱能强烈抑制___________A. 细菌RNA聚合酶B. 真核RNA聚合酶C. 细菌DNA聚合酶D. 真核DNA聚合酶21. 在核糖体上进行蛋白质合成,除了肽链形成本身以外的每一个步骤都与什么有关?A. ATP的水解B. GTP的水解C. Camp的水解D. 烟酰胺核苷酸参与22. 基因重组确实是DNA分子之间的:A. 共价连接B. 氢键连接C. 离子键连接23. DNA复制过程中双链的解开,要紧靠什么作用__________A. 引物合成酶B. Dnase IC. 限制性内切酶D. 拓扑异构酶24. 包括中国在内,有专门多国家科学家参与的人类基因组打算,到目前为止的进展情形如何?A. 仅完成23对染色体的遗传图谱和物理图谱B. 仅测定了7,10合22号染色体的核苷酸序列C. 测定了人基因组3X10^9碱基的全序列,但只是一部"天书",无法明白它的全部意义D. 测定了人基因组全序列,分析了他们代表的遗传信息,差不多了解大部分基因的功能25. 催化转氨作用的转氨酶所含的辅基是:________A. 磷酸吡哆醛B. 泛酸C. 烟酰胺D. 硫氨素三填空题(每空一分)1. 胰岛素最初合成的单链多肽称为__________________然后是胰岛素的前体,称为_________2. 原胶原蛋白分子的二级结构是一种三股螺旋,这是一种___________结构,其中每一股又是一种专门的_____________结构.3. 有一类不可逆抑制剂具有被酶激活的性质,被称为_________型不可逆抑制剂,又可被称作酶的_____________4. "蛋白质组"是指____________________5. 蛋白激酶A的专一活化因子是Camp,蛋白激酶C的专一活化因子是__________,此外还有某类型的蛋白激酶能够由_______作为专一激活因子6. 已阐明原子辨论率三维结构的膜固有蛋白有______________,__________________等(仅写两个)7. 霍乱毒素的受体是一种____________化合物8. 线粒体内膜催化氧化磷酸化合成ATP的F1F0酶的F1部分的亚基组成的结构是__________9. 除了膜脂脂肪酰链的长度外,阻碍膜脂流淌性的要紧因素是_____________--10. 左旋的Z-DNA与右旋的B-DNA相比,前者的每对核苷酸之间的轴向距离_________于后者;前者的直径__________于后者11. 已知二类核糖体失活蛋白(RIP)差不多上通过破坏核糖体大亚基RNA而使核糖体失活,这二类蛋白质分别具有___________和____________活性12. 5-磷酸核糖-1-焦磷酸PRPP)除了参与嘌呤和嘧啶核苷酸生物合成外,还与___________和_____________氨基酸代谢有关.13. 大肠杆菌的启动子序列包含有___________-,_______________及____________等信息.14. 逆转录病毒含有单链RNA,感染细胞后转变成双链DNA,这种DNA必须__________,才能发生病毒的复制.15. 真核RNA聚合酶I要紧位于细胞__________中,合成大分子核糖体RNA前体四.问答题(5X6)1. 蛋白质化学测序法的原则和程序可归纳为哪5个时期?(仅需写出时期名称)2. 在酶的醇化过程中必须考虑尽量减少酶活性的缺失,因此操作过程通常要求在低温下进行.假如醇化一个热稳固(耐温)的酶,是否不需要在低温条件下操作?请简述你的见解.3. 由一个抑制剂抑制完整线粒体β-羟基丁酸或琥珀酸的氧化,但不抑制(维生素C+四甲基对苯二胺)的氧化,那个抑制剂的抑制部位应该在电子传递链的什么部位?什么缘故?4. 简述RNA剪接和蛋白质剪接5. 酵母细胞利用半乳糖的几种酶基因GAL7-GAL10-GAL1,它们的转录是如何受调控因子GAL4和GAL80调剂的?中国科学院2002年研究生入学试题《生物化学与分子生物学》一、是非题:15题,每题1分,共15分。


一:何谓相容性物质简述甜菜碱的主要合成途径及生理功能?相容性物质(渗透调节物质)通过细胞增加或减少溶质调节细胞渗透势以期与细胞外渗透势平衡,是指细胞渗透势变化所表现出的调节作用。
1外界环境进入植物细胞的无机离子,K+, C「,NO32细胞内合成的有机溶质:脯氨酸,甜菜碱,可溶性糖(分子量小,易溶于水。
在生理pH范围内不带净电荷。
必须能为细胞膜所保持。
引起酶变化的作用最小。
生产迅速。
)简述甜菜碱的主要合成途径及生理功能?甜菜碱:是一类季铵化合物,化学名称为N-甲基代氨基酸。
植物中的甜菜碱主要有12种,研究最多的是甘氨酸甜菜碱,简称甜菜碱。
生物合成:以胆碱为底物经两部酶催化生成,即:胆碱——(1)—甜菜碱醛——(2)甜菜碱催化上述途径反应(2)的甜菜碱醛脱氢酶(,BADH)。
在高等植物中,甜菜碱由胆碱单氧化酶(CMO和甜菜碱醛脱氢酶(BADH催化合成。
在哺乳动物及微生物,如大肠杆菌细胞中,甜菜碱由胆碱脱氢酶(CDH和甜菜碱醛脱氢酶(BADH催化合成。
土壤微生物球形节杆菌中,甜菜碱仅由一种酶,即胆碱氧化酶(COD催化合成。
功能:1参与细胞渗透调节作用溶质区域化理论甜菜碱只有区域化地分布在占有细胞体积很小的细胞质中,在渗透胁迫条件下,其积累的浓度才有可能起主要的渗透调节作用。
2参与稳定生物大分子的结构与功能1 )甜菜碱对光合放氧即PSII外周多肽的稳定起作用。
2)对有氧呼吸和能量代谢也有良好的保护作用。
3)影响离子在细胞内的分布:可能调节膜载体蛋白或通道活性4)其它相容性物质的特殊功能:参与羟自由基的清除(5)对Rubisco活化酶的作用。
在高温、低温及盐胁迫下,外源甜菜碱和转甜菜碱合成酶基因植株体内合成甜菜碱都能促进HSP70勺表达,这可能是甜菜碱能够提高植物对多种逆境胁迫抗逆性的原因之一。
二:相容性物质的作用机制一一两种主要假说1、表面结合假说:其主要思想是,相容性物质与蛋白质表面特别是疏水表面结合,提高蛋白质表面水化程度。

氨基酸代谢的生物化学过程氨基酸代谢是生物体内一个重要的生物化学过程。
在人体中,氨基酸代谢主要发生在肝脏中,包括蛋白质的降解和新合成。
在这个过程中,一系列酶参与了氨基酸的转化,将其转化为能量或者供应新的蛋白质合成所需的氨基酸。
首先,氨基酸代谢的第一步是氨基基团的去除,这一过程称为脱氨作用。
脱氨酶是参与脱氨作用的关键酶,它能够催化氨基酸与α-酮酸反应,生成α-酮酸和氨气。
在这个过程中,氨基酸被转化为不同的代谢产物,例如α-酮酸、氨氨基酸和氨基酸。
这些代谢产物可以进一步参与能量代谢或者合成新的蛋白质。
其次,氨基酸的碳骨架可以被进一步代谢,主要通过三羧酸循环进行。
三羧酸循环是细胞内一个重要的代谢通路,能够将氨基酸的碳骨架转化为能量和有机物。
在这个过程中,氨基酸的碳骨架会被氧化分解,生成辅酶A和NADH等还原辅酶,并最终产生ATP。
此外,氨基酸代谢还涉及氨基酸的合成。
在蛋白质合成过程中,氨基酸可以被合成成新的蛋白质。
氨基酸的合成过程往往需要多种酶的参与,例如转氨酶、缬氨酸合成酶等。
这些酶能够催化氨基酸的合成反应,从而满足细胞对新蛋白质的需求。
总的来说,氨基酸代谢是一个复杂而严密的生物化学过程,通过一系列酶的协同作用,将蛋白质分解为氨基酸,进而参与能量代谢或者蛋白质合成。
这个过程的正常进行对维持生物体内稳态至关重要,任何环节的紊乱都可能导致疾病的发生。
因此,对氨基酸代谢过程的深
入研究不仅有助于我们更好地理解生物体内的代谢调控机制,也为相关疾病的防治提供了新的思路和方法。
【316字】。
绪论学习目标:知识目标:掌握:生物化学的定义和研究方法;了解:生物化学的发展史;认识:生物化学与医学、药学的关系。
技能目标:熟悉:生物化学的研究方法一、生物化学的概念生物化学是从分子水平研究生物体中各种化学变化规律的科学。
因此生物化学又称为生命的化学(简称:生化),是研究生命分子基础的学科。
生物化学是一门医学基础理论课。
二、生物化学的主要内容1.研究生物体的物质组织、结构、特性及功能。
蛋白质、核酸2.研究物质代谢、能量代谢、代谢调节。
研究糖、脂、蛋白质、核酸等物质代谢、代谢调节等规律,是本课程的主要内容。
3.遗传信息的贮存、传递和表达,研究遗传信息的贮存、传递及表达、基因工程等,是当代生命科学发展的主流,是现代生化研究的重点。
三、生物化学的发展史四、生物化学与健康的关系生化是医学的基础,并在医、药、卫生各学科中都有广泛的应用。
本课程不仅是基础医学如生理学、药理学、微生物学、免疫学及组织学等的必要基础课,而且也是医学检验、护理等各医学专业的必修课程。
五、学好生物化学的几点建议1.加强复习有关的基础学科课程,前、后期课程有机结合,融会贯通、熟练应用。
2.仔细阅读、理解本课程的“绪论”,了解本课程重要性,激发起学习生物化学的兴趣和求知欲望。
3.每次学习时,首先必须了解教学大纲的具体要求,预读教材,带着问题进入学习。
4.学习后及时做好复习,整理好笔记。
5.学生应充分利用所提供的相关网站,从因特网上查找学习资料,提高课外学习和主动学习的能力。
6.实验实训课是完成本课程的重要环节。
亲自动手,认真、仔细完成每步操作过程,观察各步反应的现象,详细、科学、实事求是地记录并分析实验结果,独立完成实验报告。
第一章蛋白质的化学及氨基酸代谢知识目标:掌握:1.蛋白质的元素组成及特点,2.蛋白质的基本组成单位-氨基酸、肽链与肽、蛋白质各级结构的概念、特点及主要化学键,3.蛋白质的主要理化性质。
了解:蛋白质的主要功能、氨基酸的来源与去路及一碳单位的概念;技能目标:1.能举例说明蛋白质结构与功能的关系,解释分子病与构象并的发病机制。
氨基酸类代谢物
氨基酸类代谢物是指氨基酸在体内代谢过程中所产生的物质。
氨基酸脱氨基可以产生氨,这是人体内产氨的主要方式。
由于游离的氨对人体有伤害性,需要经肝的转变成尿素排出体外,也可以以谷氨酰胺的形式暂时储存。
少部分可以转变成其他含氮类物质。
氨基酸脱氨基的另一产物为α-酮酸,有3个不同的去路:
- 可以转变为乙酰辅酶A,彻底氧化生成二氧化碳和水,并释放能量以供机体生理活动需要;
- 可以通过转氨基功能产生人体非必需氨基酸;
- 也可转化成糖和脂类物质。
体内的一些营养非必需氨基酸可通过相应的α-酮酸经氨基化而生成。
例如,丙氨酸、草酰乙酸、α-酮戊二酸经氨基化后分别转变成丙氨酸、天冬氨酸和谷氨酸。
这些α-酮酸也可以是来自糖代谢和三羧酸循环的产物。
蛋白质降解和氨基酸的分解代谢蛋白质的降解细胞总是不断地从氨基酸合成蛋白质,又把蛋白质降解为氨基酸。
从表面上看,这样的变化过程看似是一种浪费,实际上它有二重功能,其一是排除那些不正常的蛋白质,它们一旦积聚,将对细胞有害;其二是通过排除积累过多的酶和调节蛋白使细胞代谢的井然有序得以进行。
蛋白质降解的特性蛋白质有选择地降解非正常蛋白质,例如血红蛋白与缬氨酸类似物结合,得到的产物在网织红细胞中的半存活期约10min,而正常血红蛋白可延续红细胞的存活期最终可达120天。
正常的胞内蛋白被排除的速度是由它们的个性决定的,绝大多数快速降解的酶都居于重要的“代谢控制”位置,而较稳定的酶在所有生理条件下有较稳定的催化活性。
降解速度还因它的营养及激素状态而有所不同。
在营养条件被剥夺的情况下,细胞提高它的蛋白质降解速度,以维持它的必需营养源使不可或缺的代谢过程得以进行。
蛋白质降解的反应机制真核细胞对于蛋白质降解有两种体系,一个是溶酶体的降解体质和一种ATP-依赖性的以细胞溶胶为基础的机制。
溶酶体溶酶体是具有单层被膜的细胞器,其中个含有50多种水解酶,包括不同种的蛋白酶,称之为组织蛋白酶。
溶酶体保持其内部PH在5左右,而它含有的酶的最适PH就是酸性。
如此可以抵制偶然的溶酶体渗漏从而保护了细胞,因此在细胞溶胶PH下,溶酶体的大部分酶都是无活性的。
溶酶体对细胞各组分的再利用是通过它融合细胞质的膜被点块即自(体吞)噬泡,并随即分解其内容物实现的。
溶酶体的阻断剂有抗虐药物——氯代奎宁(是一种弱碱,在不带电形式随意穿透溶酶体,在溶酶体内积累形成特电荷型,因此增高了溶酶体内部的pH,并阻碍了溶酶体的功能。
溶酶体降解蛋白质是无选择性的,而rong'mei't'抑制剂对于非正常蛋白或短寿命酶无快速的降解效应,但是它们可以防止饥饿状态下蛋白质的加速度崩溃。
许多正常的和病理活动都伴随溶酶体活性的升高。
ATP-依赖真核细胞蛋白质的降解主要是溶酶体的作用,但是缺少溶酶体的网织红细胞却可选择性的降解非正常蛋白质,这里有ATP-依赖的蛋白质水解体系存在ATP依赖蛋白质需要有泛肽存在。
氨基酸分解的共同代谢途径氨基酸是构成蛋白质的基本组成单元,它们在体内通过代谢途径被分解为能量、葡萄糖和其他代谢产物。
氨基酸的分解主要发生在肝脏和肌肉组织中。
以下是氨基酸分解的共同代谢途径:1. 转氨基酸代谢(Transamination):这是氨基酸分解的初始步骤之一,通过此过程,氨基酸的α-氨基基团被转移至α-酮酸上,形成新的氨基酸和酮酸。
转氨基酶是催化这一过程的酶。
最常见的转氨基酸是谷氨酸,它接受多种氨基酸的氨基基团。
2. 脱羧反应(Decarboxylation):氨基酸的α-酮酸部分接受氨基基团后,可能进一步发生脱羧反应。
这个过程涉及酶的催化,导致α-酮酸失去一个羧基,产生相应的酮。
这一步骤通常伴随着能量的产生。
3. 尿素循环(Urea Cycle):在氨基酸分解的过程中,产生的氨基基团会形成尿素,通过尿素循环排出体外。
尿素循环主要发生在肝脏中,其中包括多个酶催化的反应,将氨基基团与二氧化碳结合形成尿素。
4. 丙酮酸和乙酰辅酶A的产生:某些氨基酸经过转氨基酸代谢和脱羧反应后,形成丙酮酸和乙酰辅酶A。
这些代谢产物进一步进入三羧酸循环(TCA循环)产生能量,或者用于脂肪酸合成。
5. 胱氨酸代谢:胱氨酸是一种含有硫的氨基酸,它在体内参与许多重要的代谢途径。
在氨基酸分解中,胱氨酸可以被降解为丙酮酸和一种含有硫的代谢产物——丙硫醇。
6. 酮体生成:某些氨基酸在分解过程中产生的丙酮酸和乙酰辅酶A可以进一步生成酮体,如β-羟基丁酸、乙酰丙酮等。
酮体是一种可以用于供能的代谢产物,尤其在餐后或低碳水化合物饮食时,它们可以成为脑和其他组织的能量来源。
7. 葡萄糖生成:在氨基酸分解的过程中,一部分代谢产物如丙酮酸、乙酰辅酶A等可以通过葡萄糖新生途径转化为葡萄糖。
这对于在低血糖状态下提供能量至关重要。
这些代谢途径共同构成了氨基酸在体内的分解过程,为维持生命活动提供了重要的能量和代谢产物。
这些产物不仅能够满足细胞的能量需求,还可以参与脂质合成、糖新生等重要的生物学过程。