不可逆过程和环境的熵变计算举例
- 格式:doc
- 大小:80.50 KB
- 文档页数:8



熵产生原理与不可逆过程热力学简介一、熵产生原理(Principle of Entropy-Production )熵增加原理是热力学第二定律的熵表述。
而这个原理用于判断任一给定过程能否发生,仅限于此过程发生在孤立体系内。
而对于给定的封闭体系中,要判断任一给定的过程是否能够发生,除了要计算出体系内部的熵变,同时还要求出环境的熵变,然后求总体的熵变。
这个过程就相当于把环境当成一个巨大的热源,然后与封闭体系结合在一起当成孤立体系研究。
但是一般来说,绝对的孤立体系是不可能实现的。
就以地球而言,任何时刻,宇宙射线或高能粒子不断地射到地球上。
另外,敞开体系也不能忽视,就以生物体为例,需要不停地与环境进行物质交换,这样才能保证它们的生存。
1945年比利时人I. Prigogine 将热力学第二定律中的熵增加原理进行了推广,使之能够应用于任何体系(封闭的、敞开的和孤立的)。
任何一个热力学体系在平衡态时,描述系统混乱度的状态函数S 有唯一确定值,而这个状态函数可以写成两部分的和,分别称为外熵变和内熵变。
外熵变是由体系与环境通过界面进行热交换和物质交换时进入或流出体系的熵流所引起的。
熵流(entropy flux )的概念把熵当作一种流体,就像是历史上曾经把热当作流体一样。
内熵变则是由于体系内部发生的不可逆过程(例如,热传导、扩散、化学反应等)所引起的熵产生(entropy-production )。
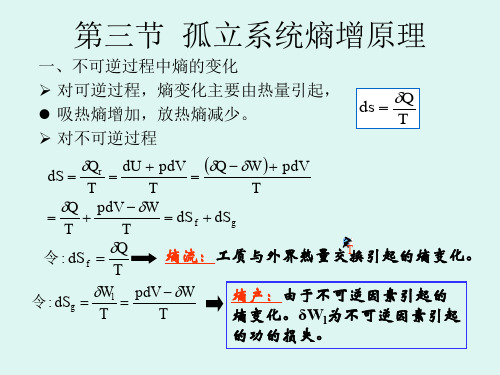
由上述的概念,可以得到在任意体系中发生的一个微小过程,有:S d S d dS i e sys +==S d T Qi +δ (1-1),式中S d e 代表外熵变,S d i 代表内熵变。
这样子就将熵增加原理推广到了熵产生原理。
而判断体系中反应的进行,与熵增加原理一致,即0≥S d i (> 不可逆过程;= 可逆过程) (1-2)而文字的表述就是:“体系的熵产生永不为负值,在可逆过程中为0,在不可逆过程中大于0”。


不可逆过程和环境的熵变计算举例以下是两个不可逆过程和环境的熵变计算的例子:1.一个热源和一个工作物体之间的热交换考虑一个热源和一个工作物体之间的热交换过程。
这里,热源的温度高于工作物体的温度,导致热量从热源流向了工作物体。
这个过程是不可逆的,因为温度差引起了热量的不可逆流动。
假设热源的温度为T1,工作物体的温度为T2,并且假设热交换过程中没有其他形式的能量转换。
根据热力学第二定律,系统与环境的熵变可以表示为:ΔS_system = -Q/T2ΔS_environment = Q/T1其中,ΔS_system表示系统的熵变,ΔS_environment表示环境的熵变,Q表示热量的传递。
由于热量的传递是从热源向工作物体的,所以Q为负值。
假设热源传递了Q单位的热量给工作物体,那么可以写出:ΔS_system = -(-Q)/T2 = Q/T2ΔS_environment = -Q/T1这两个表达式显示了系统和环境的熵在过程中是增加的。
由于系统和环境一起构成了一个孤立系统,总的熵变必须是正的。
2.气体在可膨胀容器中的膨胀考虑一个可膨胀容器中的气体膨胀过程。
在此过程中,气体从一个高压区域扩展到一个低压区域,使气体做功。
这个过程是不可逆的,因为气体在膨胀过程中无法完全进行无损失的功。
假设气体的初态和末态分别为状态1和状态2,初态的压力为P1,体积为V1,末态的压力为P2,体积为V2、再假设在膨胀过程中没有其他形式的能量转换。
根据热力学第二定律,系统与环境的熵变可以表示为:ΔS_system = nR * ln(V2/V1)ΔS_environment = -nR * ln(V2/V1)其中,n为气体的物质的量,R为气体常数。
这两个表达式分别表示了系统和环境的熵增加量。
由于这是一个膨胀过程,气体的体积增加,所以V2/V1大于1,从而使得ln(V2/V1)为正数。
由此可见,系统和环境的熵都增加了。
实际上,这个过程是不可逆的,但是熵的分布合适地遵循熵增加的原则。
关于不可逆过程熵变的计算规律的探讨
在多年的热力学统计物理的教学中,发现有关不可逆过程的熵变的计算始终是学生感觉比较难以接受的知识点,本人通过学习发现不可逆过程熵变的计算有一定的规律性,就把其进行了归纳,希望能被初学者借鉴。
对于孤立系统熵变的一般计算方法:按定义,只有沿着可逆过程的热温熵总和才等于体系的熵变。
当过程为不可逆时,则根据熵为一状态函数,体系熵变只取决于始态与终态而与过程所取途径无关;可设法绕道,找出一条或一组始终态与之一样的可逆过程,由它们的熵变间接地推算出来。
孤立系统的选择方法,如果非封闭系统,可以将环境和物体共同看成封闭系统。
不同的具体过程有不同的规律,大致分为: 1、绝热孤立系统物体间的热传递过程的熵变
⑴温度为0o C 的1kg 水与温度为100o C 的恒温热源接触后,水温达到
100o C 。
试分别求水和热源的熵变以与整个系统的总熵变。
欲使整个系统的熵保持不变,应如何使水温从0o C 升至100o C? 已知
水的比热容为
.18.41
1--⋅⋅K g J [答:S ∆水=16.1304-⋅K J ,S ∆热源=-1120.61-⋅K J ,S ∆总=.1841
-⋅K J ]
解:题中的热传导过程是不可逆过程,要计算水和热源的熵变,则必
须设想一个初态和终态分别与题中所设过程一样的可逆过程来进行计算。
要计算水从0o C 吸热升温至100o C 时的熵变,我们设想一个可逆
的等压过程:
⎰
-⋅=⨯⨯==∆373
273
1
6.1304312.018.41000273373
ln K J mC T
dT mC S 水水水=
对于热源的放热过程,可以设想一个可逆的等温过程:
1
6.120373)
273373(18.41000-⋅-=-⨯⨯-=-=∆K J T Q S 放
热源
1
184-⋅∆+∆∆K J S S S ==热源水总
在0o
C 和100o
C 之间取彼此温度差为无穷小的无限多个热源,令水依次与这些温度递增的无限多个热源接触,由0o C 吸热升温至100o C ,这是一个可逆过程,可以证明
0==,故=热源水总水热源S S S S S ∆+∆∆∆-∆
〔2〕 试计算热量 Q 自一高温热源 T 2 直接传递至另一低温热源 T 1 所引起的熵变。
〔解〕 从题意可以看出这是一不可逆热传递过程,应设想另一组始终态一样的可逆过程替代它,才能由它们的热温商计算体系的熵变。
为此,可以设想另一变温过程由无数元过程所组成,在每一元过程中体系分别与一温度相差极微的热源接触,热量是经由这一系列温度间隔极微的热源〔(T 2-dT ),(T 2-2dT ),(T 2-3dT ),……,(T 1+2dT ),(T 1+dT ),……〕传递到环境去。
这样的热传递过程当 dT 愈小时,则愈接近于可逆,则
可见若二热源直接接触并于外界隔离(绝热),则在此二热源间的热传导过程为一自发过程。
2、孤立的绝热物体自身的热传递过程的熵变
均匀杆的温度一端为T 1,另一端为T 2. 试计算达到均匀温度
)(21
21T T +后的熵增。
解:当热力学系统从一平衡态经历了一个不可逆过程到达另一平衡态 时,其熵的改变可引入一个适当的可逆过程而进行计算,这是因为熵 是态函数。
而本问题中,杆是从一非平衡态经历了热传导的不可逆过 程,而到达一个平衡态。
因此,设想下述可逆过程:把杆当作是无数 无限薄的小段组成,每一个小段的初温各不一样,但都将具有一样的 终温。
我们再设想所有的小段互相绝热,并保持同样的压力,然后使 每小段连续地跟一系列热源接触,这些热源地温度由各段的初温度至 共同的终温度。
这样就定出无数个可逆的等压过程,用来使该杆由初 始的非平衡态变化到平衡态的终态。
我们考虑长为L 的均匀杆,位于x 处的体积元的质量为
Adx dm ρ=
其中ρ与A 分别为杆的密度与截面积,该段的热容量为
Adx C dm C p p ρ=
最初的温度分布是线性分布的,而使x 处的初温为
x L T T T x T i 2
11)(--
=
若无热量损失,并且为了方便起见,假设各小段的热传导率、密度和热容量都保持不变,则终温
221T T T f +=
该体积元的熵增为
⎰
---=--==f i
T T f f p f p i
f p p x LT T
T T T Adx V x
L
T T T T Adx C T T Adx C T dT
Adx C )
ln(ln ln 211211ρρρρ沿整个杆积分,得熵的总变化等于
⎰
---=∆L f
L f p dx
x LT T T T T A C S 0
11)ln(ρ
利用积分公式
[]⎰-++=+1)ln()(1
)ln(bx a bx a b dx bx a
经积分并化简后,得到
).
1ln ln 2(ln )ln ln ln 1(2
12
2112112112212+---+=---++=∆T T T T T T T T mC T T T T T T T T T mC S P f p
3、绝热系统功热转化过程的熵变
10A 的电流通过一个25Ω的电阻器,历时1s. (i) 若电阻器保持为室温27o C ,试求电阻器的熵增。
(ii) 若电阻器被一绝热壳包
装起来,其初温为27o
C ,电阻器的质量为10g ,比热容c p 为
,84.01
-⋅⋅K g J 问电阻器的熵增为何?
解:(1) 若电阻器保持一定温度,则它的状态不变,而熵是状态的函 数,故知电阻器熵增为零,即0=∆S .我们也可以这样考虑,电功转变
为热,传人电阻器,同时此热量又由电阻器流入恒温器(比如是实验 室)。
因此,传入电阻器的净热量为零,故有0=∆S .
(2) 在这过程中,有电功转变为热,是不可逆过程。
因为熵是态 函数,我们设想一个是电阻器等压加热的过程来计算熵增。
电阻器终态的温度为T f ,有Q=mC p (T f -T i ), 与
)(6001251024.024.022cal Rt I Q =⨯⨯⨯== 得
)
(6003002.010600
K T f =+⨯=
⎰=⨯⨯===∆f
i
T T i
f p p K cal T T mC T
dT mC S )/(386.1300600
ln
2.010ln
4、不可逆过程和环境的熵变计算
如计算隔离体系的熵变,则需涉与环境,按原则,环境亦必须在可逆条件下吸热或放热,常设想环境由一系列温度不同的热源组成,或称理想化环境,当体系放热时,则环境吸热;而体系吸热时则环境放热,故有如下关系:
〔例1〕 试计算下列情况下,273.2K 、2 摩尔理想气体由 2X 压力降低至压力时的(a)体系熵变;(b)环境熵变;(c)隔离体系熵变--(1)可逆等温膨胀;(2)恒温恒外压膨胀,p e = ;(3)自由膨胀。
〔解〕: (1)
(2)
(3)
三例比较,体系始终态一样,ΔS体系为一恒值(11.53J·K-1)。
在可逆情况下,体系将热转变为功的效率达到最大;而当不可逆程度(不平衡情况)愈大时,热量的利用率愈低,转化为做功的能量愈少(也称有效能)。
能量继续以热的形式留于隔离体系中的愈多,相应地隔离体系的熵值增加得愈多。
(应该注意:本例属等温过程,在变温过程中熵值的变化应根据决定!)〔例2〕试计算在 101.325KPa 压力下,2 摩尔液态氨由233.2K 转变为 473.2K 的氨气时体系的熵变。
氨的正常沸点(101.325KPa 压力下的沸点)为 239.7K,在正常沸点下的摩尔汽化热ΔVap H m=23.26kJ·mol1;液态和气态氨的摩尔平均热容分别为C p,m(NH3,l)=74.9J·mol-1·K-1和
C p,m(NH3,g)=25.89+33.00x10-3T-3.05x10-6T2(J·mol-1·K-1) 。
〔解〕此过程为不可逆,计算体系熵变时必须由一组始终态一样的可逆过程替代之:
而体系熵变:。