高一化学氯、溴、碘及其化合物
- 格式:pdf
- 大小:1.32 MB
- 文档页数:9
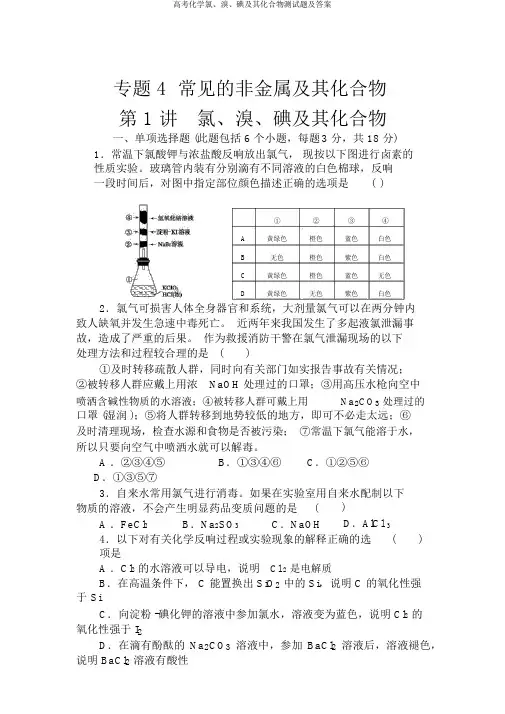
专题 4 常见的非金属及其化合物第 1 讲氯、溴、碘及其化合物一、单项选择题 (此题包括 6 个小题,每题3 分,共 18 分)1.常温下氯酸钾与浓盐酸反响放出氯气,现按以下图进行卤素的性质实验。
玻璃管内装有分别滴有不同溶液的白色棉球,反响一段时间后,对图中指定部位颜色描述正确的选项是()①②③④A黄绿色橙色蓝色白色B无色橙色紫色白色C黄绿色橙色蓝色无色D黄绿色无色紫色白色2.氯气可损害人体全身器官和系统,大剂量氯气可以在两分钟内致人缺氧并发生急速中毒死亡。
近两年来我国发生了多起液氯泄漏事故,造成了严重的后果。
作为救援消防干警在氯气泄漏现场的以下处理方法和过程较合理的是()①及时转移疏散人群,同时向有关部门如实报告事故有关情况;②被转移人群应戴上用浓NaOH 处理过的口罩;③用高压水枪向空中喷洒含碱性物质的水溶液;④被转移人群可戴上用Na2CO3处理过的口罩 (湿润 );⑤将人群转移到地势较低的地方,即可不必走太远;⑥及时清理现场,检查水源和食物是否被污染;⑦常温下氯气能溶于水,所以只要向空气中喷洒水就可以解毒。
A .②③④⑤B.①③④⑥C.①②⑤⑥D.①③⑤⑦3.自来水常用氯气进行消毒。
如果在实验室用自来水配制以下物质的溶液,不会产生明显药品变质问题的是(A .FeCl2B.Na2SO3C.NaOH ) D.AlCl34.以下对有关化学反响过程或实验现象的解释正确的选项是A .Cl2的水溶液可以导电,说明Cl 2是电解质()B.在高温条件下, C 能置换出 SiO2中的 Si,说明 C 的氧化性强于SiC.向淀粉 -碘化钾的溶液中参加氯水,溶液变为蓝色,说明 Cl2的氧化性强于 I2D.在滴有酚酞的Na2CO3溶液中,参加BaCl2溶液后,溶液褪色,说明 BaCl2溶液有酸性5.将2缓缓通入含2SO3和 0.02molHBr 的混合溶液中,在此过程溶液的c(H+)与 Cl2用量的关系示意图是 (溶液的体积视为不变 )()6.ClO2是一种广谱型的消毒剂,根据世界环保联盟的要求,ClO2将逐渐取代 Cl 2成为生产自来水的消毒剂。


专题三非金属及其化合物考纲导学1 / 27第一单元氯、溴、碘及其化合物考点一氯气及其化合物的性质与应用1.判断正误,正确的画“√”,错误的画“✕”。
(1)氯气可以使湿润的有色布条褪色,但是实际起漂白作用的物质是次氯酸,而不是氯气( )(2)Cl2具有很强的氧化性,在化学反应中只能作氧化剂( )(3)Cl2与水反应的离子方程式:Cl2+H2O 2H++Cl-+ClO-( )(4)Cl2通入NaOH溶液中反应的离子方程式为Cl2+2OH- Cl-+ClO-+H2O ( )(5)标准状况下,11.2 L Cl2与水充分反应转移电子数为0.5N A ( )(6)“84”消毒液的消毒原理与H2O2的相同,都是利用强氧化性( )2 / 27(7)漂白粉溶于水后形成的溶液在空气中失效的离子方程式:ClO-+CO2+H2O HClO+HC O3-( )答案(1)√(2)✕(3)✕(4)√(5)✕(6)√(7)✕2.应用氯水中存在的平衡解释下列问题。
(1)氯水为什么要现用现配?实验室中怎样保存氯水?。
(2)为什么要用饱和食盐水除去Cl2中的HCl气体?。
(3)怎样利用氯水制备较浓的次氯酸溶液?为什么?。
答案(1)次氯酸不稳定,见光分解,2HClO 2HCl+O2↑,久置氯水最终变成稀盐酸。
氯水保存在棕色试剂瓶中并放置在阴暗处(2)在氯水中存在:Cl2+H2O H++Cl-+HClO,在饱和食盐水中Cl-的浓度较大,平衡逆向移动,减少氯气的消耗(3)往氯水中加入CaCO3;加入CaCO3,CaCO3与盐酸反应,促进Cl2+H2O H++Cl-+HClO平衡正向移动,同时酸性H2CO3>HClO,HClO与CaCO3不反应,可以制备较浓的次氯酸溶液1.氯气的性质(1)物理性质3 / 27提醒:闻氯气气味的方法是用手在瓶口轻轻扇动,使极少量的Cl2飘进鼻孔。
(2)化学性质A.与金属反应:与变价金属反应生成高价金属氯化物。



氯溴碘及其化合物知识点整理一、氯(Cl)1.物理性质:-氯是一种黄绿色气体,在常温常压下存在于二元分子(Cl2)的形式。
-它具有刺激性气味,是一种强氧化剂和消毒剂。
2.化学性质:-氯是一种非金属元素,能够与金属形成离子化合物,如氯化物(Cl-)。
-氯对大多数有机物具有强氧化性,可以与有机物发生取代反应。
-氯可以和氢反应生成氯化氢气体(HCl),这是一种强酸。
-氯和氧反应能够形成一系列的氧化物,如氯气分子可以与水反应形成亚氯酸(HClO)。
3.应用:-氯的化合物广泛应用于消毒、漂白、污水处理等领域。
- 氯和氟的混合物(氯氟烃)被用作制冷剂(如氯氟化甲烷,也称为Freon)。
二、溴(Br)1.物理性质:-溴是一种红棕色液体,在常温下存在于单质溴的形式。
-溴的蒸气具有刺激性气味。
2.化学性质:-溴同样是一种非金属元素,能够与金属形成离子化合物。
-溴的化学性质与氯相似,但比氯的活泼性较低。
-溴和氢反应生成溴化氢气体(HBr),也是一种酸性物质。
3.应用:-溴的化合物有广泛的应用,如溴化银被用于消化道造影剂,溴化钾用作阻火剂。
三、碘(I)1.物理性质:-碘是一种紫黑色固体,在常温下以单质碘的形式存在。
-碘可以升华为紫蓝色气体。
2.化学性质:-碘是一种卤素,化学性质与氯和溴类似,但比溴更不活泼。
-碘可以与金属反应形成离子化合物。
-碘和氢反应生成碘化氢气体(HI),是一种强酸。
3.应用:-碘的化合物广泛应用于药物、消毒剂、防火剂等领域。
碘酒和碘酊是常见的外用消毒剂。
四、氯、溴、碘化合物1.氯化物:-氯化物是氯与其他元素形成的化合物,如氯化钠(NaCl)是一种常见的食盐。
-氯化物在化学工业中广泛应用,如氯化铝(AlCl3)用于催化剂。
2.溴化物:-溴化物是溴与其他元素形成的化合物,如溴化钠(NaBr)被用作疗法中的抗癫痫药物。
-溴化钾(KBr)也被用作照相纸中的显影剂。
3.碘化物:-碘化物是碘与其他元素形成的化合物,如碘化钾(KI)是一种常用的抗甲状腺药物。


氯、溴、碘及其化合物知识点总结一、氯气的性质1、实验室制法(1)反应原理:MnO 2+4HCl (浓)上=MnCl 2+C121+2H 2O(2)除杂气体:制得的氯气中有氯化氢杂质,常用饱和食盐水洗气。
有时要制得干燥的氯气,可以用浓硫酸洗气来除去水蒸气。
(3)收集方法:氯气可以用向上排空气法或排饱和食盐水法收集。
(4)尾气吸收:氯气有毒,有毒气体必须加以吸收,防止污染空气。
一般用氢氧化钠溶液吸收多余的氯气:Cl 2+2NaOH^=NaCl +NaClO +H 2O2、氯气的性质1. 物理性质通常情况下氯气是呈黄绿色的气体,密度比空气大,有刺激性气味,有毒,易液化, 能溶于水(在常温下1体积水约溶解2体积的氯气)。
注意:在实验室里闻氯气气味时,必须十分小心,采用正确的闻气味方法,即用手在瓶口轻轻扇动,仅使极少量的氯气飘进鼻孔。
在实验室中闻其他气体的气味时,也应采用这种方法。
2. 化学性质氯气是一种化学性质很活泼的非金属单质,能与多种金属和非金属直接化合,还能跟许多化合物发生反应,潮湿的氯气还具有漂白性。
<1>与金肩的反应:2NafCI 2==2NaCIf 产生召畑』2Fe+3CI 2=^2FeCI 3f 产生棕養邑畑丿洼鑫:JF<FeCl z 匀表侏备厲庆念*对生成,舍每砖CUH -CI 2==CUCI 2r 产主释黄色畑/C2)与非金屈的反应:HCIde.于水呑捋列誥咳。
工狂上普用此方鎂*1陋盘验刁、结t 氣气廷一科化孝也簌彳艮逶汝的非全属单烦>能与多齐全属升井全属直按化^令召说明:①纯净的H 2在Cl 2中可以安静地燃烧,发出苍白色火焰,在瓶口处有白雾生成。
② H 2和Cl 2混合后光照或点燃都可能爆炸。
③ 工业上制取HC1就是利用H 2在Cl 2中燃烧来制取的。
(3)氯气与水反应①氯气溶于水后可得到氯水02+日20=^HC1+HC1OH 2ICI 2=^2HCI新制的氯水中存在:Cl2(氯水呈黄绿色)、H2O、HClO(氯水有漂白性)、CIO-、H+、Cl-久置氯水中存在:HCl说明:I.氯水显酸性,放置一段时间后酸性增强,其原因是Cl2+H2o^=HC1+HC102HC1O光照2HC1+O2使氯气转化为盐酸,氢离子浓度增大。

2019-2020年高中化学必修1氯、溴、碘及其化合物【知识要点】二、溴、碘的提取(一)卤素单质的相互置换1.卤族元素:氯(Cl)、溴(Br)、碘(I)等元素在原子结构和元素性质方面具有一定的相似性,他们在元素周期表中排在同一纵行(族)里,这三种元素都属于卤族元素(简称卤素)。
2.卤族元素的单质结论:卤素单质在水中的溶解度不大,在有机溶剂中的溶解度较大。
(2)化学性质的比较Cl2能置换出Br2:Cl2 + 2Br- == 2Cl- + Br2Cl2能置换出I2:Cl2 + 2I- ==2Cl- + I2Br2能置换出I2:Br2 +2I- == 2Br- + I2结论:单质的氧化性顺序为:Cl2 > Br2 > I23.溴的用途(1)工业上:制造燃料的抗爆剂,溴化银(见光易分解)用作感光材料;(2)农业上:制含溴的杀虫剂;(3)医药上:红药水(含溴和汞的有机化合物),镇静剂(溴化钠和溴化钾)。
(二)氧化还原反应1.元素化合价在化学反应中的变化(1)氧化还原反应:凡有元素化合价升降的化学反应就是氧化还原反应。
氧化反应:在氧化还原反应中,反应物所含元素化合价升高的反应称为氧化反应;还原反应:在氧化还原反应中,反应物所含元素化合价降低的反应称为还原反应。
非氧化还原反应:凡没有元素化合价升降的化学反应,就是非氧化还原反应。
(2)氧化还原反应特征(判别方法):化合价发生变化。
2.氧化还原反应的实质(1)元素化合价升降的实质:化合价升高,该元素原子在反应中失去电子;化合价降低,该元素原子在反应中得到电子。
(2)氧化还原反应的本质:反应过程中有电子得失(或偏移)。
3.氧化剂和还原剂(1)从化合价角度定义:在氧化还原反应中,所含元素的化合价降低的反应物,称为氧化剂;在氧化还原反应中,所含元素的化合价升高的反应物,称为还原剂。
(2)从电子转移角度定义:在氧化还原反应中,得到电子(或电子偏近)的反应物,称为氧化剂;在氧化还原反应中,失去电子(或电子偏离)的反应物,称为还原剂。

第一单元氯、溴、碘及其化合物课时1氯气的生产原理、氯气的性质教学设计内容分析:氯元素是一种典型的化学性质活波的主族元素,也是生活中一种很常见的、化工生产中很重要的元素,了解氯元素的性质有助于学生进一步探讨卤族元素的性质,从而与其他系列元素性质比较来归纳元素周期律。
关于氯气的性质本节教材的内容包括三部分:1、氯气的物理性质,2、化学性质。
3、氯气的制取。
本节课主要从生活和生产实际出发,重点讨论了氯气与水的反应以,同时重点探究氯气与水反应的产物以及次氯酸的漂白作用。
教学目标设计1.知识与技能通过本节推测、实验探究、归纳出氯气的物理性质,氯气与水、碱液反应的化学方程式,知道次氯酸有漂白性,在光照条件下发生分解。
2.过程与方法通过科学推测、引导发现、实验探究、体验科学探究的方法,3.情感与态度在层层递进问题的引导下,通过实验探究,归纳结论,学生体会科学探究艰辛和喜悦的过程中,树立不畏艰难的科学探究精神,并同时加强环保意识教学重点:氯气的制取和化学性质教学难点:氯气的强氧化性教学过程:【导课】投影海洋图片,阅读课本P40海洋中的化学资源。
【学生活动】阅读课本【总结】教材整理1海水中的化学物质1.元素种类:80多种。
2.氯化物:主要为氯化钠,其次为氯化镁、氯化钙、氯化钾等。
3.溴元素:被称为“海洋元素”,原因是:99%以上的溴蕴藏在海水中,总储量达1×1014 t 。
4.碘元素:含量丰富,达8×1010 t 。
【教师过渡】氯气是如何制取的?请同学们阅读课本40页【 课件展示 】电解饱和食盐水装置图,分析两极产生的气体【学生活动】书写电解方程式2NaCl +2H 2O=====通电2NaOH +H 2↑+Cl 2↑【教师】实验室又是如何制取的呢?请同学们观看视频,然后阅读化学史话【视频展示】氯气的实验室制法、原理、装置图【学生活动】阅读教材P41上的科学史话【讲解】1774年舍勒 发现氯气,他将这种元素命名为Chlorine,这个名称来自希腊文,有“绿色”的意思。
第11讲 氯、溴、碘及其化合物考纲要求 1.了解氯元素单质及其重要化合物的制备方法。
掌握其主要性质及应用。
2.了解氯元素单质及其重要化合物对环境质量的影响。
3.卤族元素的性质递变规律及与化工生产相结合的资源综合利用。
考点一 氯及其化合物的性质和应用1.氯气的物理性质在通常情况下为黄绿色,有刺激性气味的气体,密度比空气大,易液化,能溶于水(1∶2),氯气的水溶液称为氯水,氯水常代替氯气实验。
2.化学性质(写出化学方程式) (1)Cl 2与金属反应Fe :2Fe +3Cl 2=====点燃2FeCl 3,棕红色烟 Cu :Cu +Cl 2=====点燃CuCl 2,棕黄色烟 (2)Cl 2与非金属反应H 2:H 2+Cl 2=====点燃2HCl ,苍白色火焰 H 2和Cl 2的混合气体光照时会发生爆炸。
(3)Cl 2与H 2O 反应 化学方程式:Cl 2+H 2O HCl +HClO , 离子方程式:Cl 2+H 2O H ++Cl -+HClO 。
(4)Cl 2与碱反应①与烧碱反应:Cl 2+2NaOH===NaCl +NaClO +H 2O 。
②制取漂白粉:2Cl 2+2Ca(OH)2===CaCl 2+Ca(ClO)2+2H 2O 。
漂白粉的主要成分是Ca(ClO)2、CaCl2,有效成分是Ca(ClO)2。
(5)与还原性无机化合物反应:①与碘化钾溶液反应:Cl2+2KI===2KCl+I2。
②与SO2水溶液反应:Cl2+SO2+2H2O===H2SO4+2HCl。
③与FeCl2溶液反应:Cl2+2FeCl2===2FeCl3。
3.从平衡的角度理解氯水的成分和性质(1)氯水中存在三个平衡关系:①Cl2+H2O HCl+HClO②HClO H++ClO-③H2O H++OH-(2)氯水性质的多重性新制氯水的多种成分决定了它具有多重性质,在不同的化学反应中,氯水中参与反应的微粒不同。
(3)Cl2+H2O HCl+HClO平衡移动的应用向氯水中加入的物质浓度变化平衡移动的方向应用可溶性氯化物c(Cl-)增大左移①用饱和食盐水除Cl2中的HCl②用排饱和食盐水法收集Cl2盐酸c(H+)和c(Cl-)增大左移次氯酸盐与浓盐酸反应制Cl2NaOH c(H+)减小右移用NaOH溶液吸收多余Cl2Ca(OH)2 c (H +)减小 右移 制漂白粉CaCO 3 c (H +)减小 右移 制高浓度的HClO 溶液 光照c (HClO)减小右移氯水避光保存或现用现配4.次氯酸和次氯酸盐的性质 (1)次氯酸次氯酸见光分解的化学方程式: 2HClO=====光照2HCl +O 2↑。
专题2 从海水中获得的化学物质第1单元 氯、溴、碘及其化合物第1课时 氯及其化合物课标解读知识整理1.氯气的物理性质2.氯气的化学性质〈1〉与金属的反应〈2〉与非金属的反应〈3〉与水或碱的反应(1) CI 2和H 2O :(2) CI 2和稀NaOH 溶液:(3) CI 2+KOH (浓):H 2HCI PCI 3PCI 5(条件 现象; ) (现象 ) CuCuCl 2 Fe FeCl 3 (条件 现象; ) (条件 ;液氯保存在 )〈4>与低价化合物的反应完成下列反应的有关方程式并说明有关现象;(1)CI2与淀粉碘化钾溶液:(2)CI2通入FeCI2溶液中:(3)CI2通入SO2的水溶液中:(4)CI2和NH3混合:(5)CI2和CH4混合(光照):3氯气的制法<1>工业制法:(1) 电解饱和食盐水法:(写出反应的化学方程式和离子方程式);(2)电解熔融的氯化钠:化学方程式<2> 实验室制法1.药品:浓盐酸+氧化剂如:(KMnO4,K2MnO4,MnO2,KCIO3等)写出用MnO2和浓盐酸制取CI2的化学方程式和离子方程;2.装置:固+液主要玻璃仪器有:3.净化:除杂试剂;所用装置4.收集方法:5.验满方法:6.尾气处理:典题例题:例1.今有甲乙丙三瓶等体积的新制氯水,浓度均为0.1mol/l ,如果在甲瓶中加入少量的NaHCO3晶体,在乙瓶中加入少量的NaHSO3晶体,丙瓶不变,片刻后甲乙丙三瓶溶液中HCIO 的物质的量浓度大小关系是〈溶液体积变化忽略不计〉A 甲=乙﹥丙B 甲﹥丙﹥乙C 丙﹥甲=乙D 乙﹥丙﹥甲变式训练;为了增大氯水中HCIO的浓度应采取的措施是( )A 加入NaOH固体B 加入食盐固体C 加入CaCO3D 加入Na2SO3固体例2.用滴管将新制的饱和氯水慢慢滴入含酚酞的NaOH稀溶液中,当滴到最后一滴时红色突然褪去,试回答下列问题;(1)实验室保存饱和氯水的方法是:(2)产生上述现象的原因可能有两种(简要文字说明):①是②是(3)简述怎样用实验证明红色褪去原因是①或②:变式训练:〈1〉为了提高生活用水的卫生标准,自来水厂常用CI2和FeSO4,同时使用进行消毒和净化,以改善水质,其原理是:为了延长液氯杀菌时间,某些自来水厂在用液氯进行消毒处理时还加入液氨,其反应的化学方程式为;NH3+HCIO=====H2O+NH2CI 已知NH2CI比HCIO稳定,试分析加液氨能延长液氯杀菌时间的原因是:第1单元氯、溴、碘及其化合物第2课时溴、碘及其化合物课标解读知识要点1.卤族元素的相似性:<1>.卤素原子结构的相似性:卤素原子最外层上都有个电子,易得个电子形成稳定结构,常见化合价为价,常见正化合价有<2>.卤素单质性质的相似性:卤素单质均为原子分子,性质相似,都是活泼的,具有性,化学性质与CI2的性质相似,如:X2+H2=X2+H2O=X2+NaOH=2.卤族元素的递变性:<1>.结构的递变性:卤族元素随原子序数的递增,原子的电子层数逐渐,原子半径逐渐,元素的非金属性逐渐<2>.卤素性质的递变性:卤素单质的氧化性逐渐;与水反应的程度;与H2化合由;气态氢化合物的稳定性;阴离子的还原性。
课题 氯、溴、碘及其化合物教学过程一、基础知识1、最简单的有机物是 甲烷 (写名称),其分子式为 CH 4 ,电子式为 ,结构式为 ,空间结构为 正四面体 ,物理性质无色、无味气体,难溶于水,密度比空气小 ,存在于 沼气、天然气等甲烷的取代反应:取代反应方程式:HCl Cl CH Cl CH +−−→−+324光照,HCl Cl CH Cl Cl CH +−−→−+2223光照HCl CHCl Cl Cl CH +−−→−+3222光照,HCl CCl Cl CHCl +−−→−+423光照2、可以从石油获得的基本化工原料且可以做水果的催熟剂的是 乙烯(写名称),其分子式为 C 2H 4 ,结构简式为 CH 2=CH 2 ,空间结构为 平面型 。
物理性质 无色、稍有气味的气体,微溶于水,密度比空气小化学性质(1)、氧化反应:能使 酸性高锰酸钾溶液 褪色。
(2)、加成反应:①与Br 2反应(使 溴水 褪色) CH 2=CH 2+Br 2→CH 2Br-CH 2Br②与HCl 反应,生成氯乙烷 CH 2=CH 2+HClCH 3CH 2Cl ③与水反应,生成 乙醇 CH 2=CH 2+H 2O CH 3CH 2OH3、石油 是一种 黑 色或 褐 色的 粘稠 的油状液体,不溶于水,有 特殊 气味,密度 比水小 ,没有一定的 熔点 和 沸点 。
(1)、组成元素:除 C 、H 元素外,还含有少量的 O 、N 、S 等元素(2)、组成化合物:主要是由各种 烷烃 、 环烷烃 和 芳香烃 所组成的 混合物(3)、状态:大部分是 液态 烃,同时溶有少量的 气态 烃、 固态 烃。
没有固定的沸点.(4).指出下图各部分的装置名称①温度计的水银球插在什么位置?液面上蒸馏烧瓶支管口附近②蒸馏烧瓶中除了加入石油外还要加入什么?为什么?碎瓷片(或沸石)。
作用:防止暴沸。
③冷凝水的流动方向如何?为什么?下口进水,上口出水。
使热交换更充分。