溶液中的四大平衡
- 格式:doc
- 大小:300.00 KB
- 文档页数:2

溶液中的四大平衡一、弱电解质的电离平衡1.HClO是比H2C03更弱的酸,反应:Cl2+H20 HCl+HCl0达到平衡后,要使HClO浓度增加,可以加入( )A.NaOH B.HCl C.CaCO3(固) D.H2O2.体积相同,c(H+)相同的盐酸和醋酸跟足量的Na2C03反应后,产生CO2气体的量( )A.盐酸的比醋酸的多B.盐酸的比醋酸的少 C.二者相等 D.无法比较3.现有H+离子浓度相同的醋酸和盐酸,分别用蒸馏水稀释至原体积的m倍和n倍,稀释后两溶液的H+离子浓度仍旧相等,则m和n的关系是( )A.m>n B.m = n C.m<n D.无法确定4.下列事实中一定不能证明CH3COOH是弱电解质的是( )①常温下某CH3COONa溶液的pH=8 ②用CH3COOH溶液做导电实验,灯泡很暗③等pH等体积的盐酸、CH3COOH溶液和足量锌反应,CH3COOH放出的氢气较多④0.1mol·L1-CH3COOH溶液的pH=2.1 ⑤CH3COONa和H3PO4反应,生成CH3COOH⑥0.1mol·L1-的CH3COOH溶液稀释至100倍,pH<3A、②B、②⑤C、①③⑤D、③④⑤⑥5下列关于电解质的叙述正确的是( )A.氯化钠溶液在电流作用下电离成钠离子和氯离子B.溶于水后能电离出氢离子的化合物都是酸C.硫酸钡难溶于水,但硫酸钡属强电解质D.CO2溶于水能部分电离,故CO2属于弱电解质6.一定量的盐酸跟过量的铁粉反应时,为了减缓反应速率,且不影响生成氢气的总量,可向盐酸中加入适量的( )A.NaOH固体B.H2O C.NH4Cl D.CH3COONa7.分别在pH=1的酸和pH=13的NaOH溶液中加入足量的铝,放出H2的量前者多,其原因可能是( )①两溶液的体积相同,酸是多元强酸②两溶液的体积相同,酸是一元弱酸③酸溶液的体积大于NaOH 溶液的体积④酸是强酸,浓度比NaOH溶液大A、①②B、②C、②③D、④二、水的电离平衡8、室温下,在pH=12的某溶液中,由水电离的c(OH-)为( )A.1.0×10-7 mol·L-1B.1.0×10-6 mol·L-1C.1.0×10-2 mol·L-1D.1.0×10-12 mol·L-19、若溶液中由水电离产生的c(OH-)=1×10-14mol·L-1,满足此条件的溶液中一定可以大量共存的离子组是( )A Al3+Na+NO3-Cl-B K+Na+Cl-NO3-C K+Na+Cl-AlO2-D K+NH+4SO42-NO3-10.在25℃时,pH都等于10的KOH溶液与CH3COOK溶液中水的电离度比较( )A. 相等B. 前者比后者大C. 后者比前者大D. 两者都比纯水电离度小11.下列溶液:①pH=0的盐酸;②0.5mol·L1-的盐酸;③0.1mol·L1-的NH4Cl溶液;④0.1mol的NaOH 溶液。


化学中的四大平衡在化学中,平衡是一个重要的概念。
平衡是指在一定条件下,化学反应中反应物和生成物的浓度或者物质的状态保持稳定的状态。
化学中有四种主要的平衡,即动态平衡、酸碱平衡、氧化还原平衡和离子平衡。
一、动态平衡动态平衡是指在一个封闭系统中,反应物和生成物之间的反应速率相等,虽然反应仍在进行,但是总体上看起来没有变化。
这是因为在反应物转化为生成物的同时,生成物又会转化为反应物,反应物和生成物的浓度保持不变。
这种平衡是一种动态的平衡,反应仍在进行,但是总体上看起来没有变化。
动态平衡的一个典型例子是水的自离解反应。
水分子可以自发地分解成氢离子和氢氧根离子,也可以反应生成水分子。
在一定条件下,这个反应会达到一个平衡状态,水分子的分解和生成速率相等,水的pH值保持在中性。
二、酸碱平衡酸碱平衡是指在溶液中酸和碱之间的反应达到平衡的状态。
酸和碱是一对互为共轭的物质,具有相互转化的能力。
在酸碱平衡中,酸和碱之间会发生中和反应,生成盐和水。
酸碱平衡的一个重要应用是在生理体液中的维持。
人体的血液和细胞液都必须保持一定的酸碱平衡,即pH值在一定范围内。
这是因为酸碱平衡影响着生物体内许多生理过程的进行,如酶的催化作用、细胞膜的通透性等。
三、氧化还原平衡氧化还原平衡是指在化学反应中,物质发生氧化和还原反应,同时电子的转移保持平衡。
氧化是指物质失去电子,还原是指物质获得电子。
氧化还原反应是一种常见的化学反应类型,常见的有金属与非金属氧化物反应、金属与酸反应等。
氧化还原平衡在生物体内也起着重要的作用。
例如,呼吸过程中,氧气被还原为水,同时葡萄糖被氧化释放能量。
这是一个复杂的氧化还原反应链,其中涉及多种酶的催化作用。
四、离子平衡离子平衡是指在溶液中,正离子和负离子的浓度保持稳定的状态。
在溶液中,离子会相互吸引形成盐晶体,同时也会发生离解反应,使离子浓度保持平衡。
离子平衡在生物体内起着重要的作用。
例如,细胞内外的离子平衡是维持细胞正常功能的重要因素。
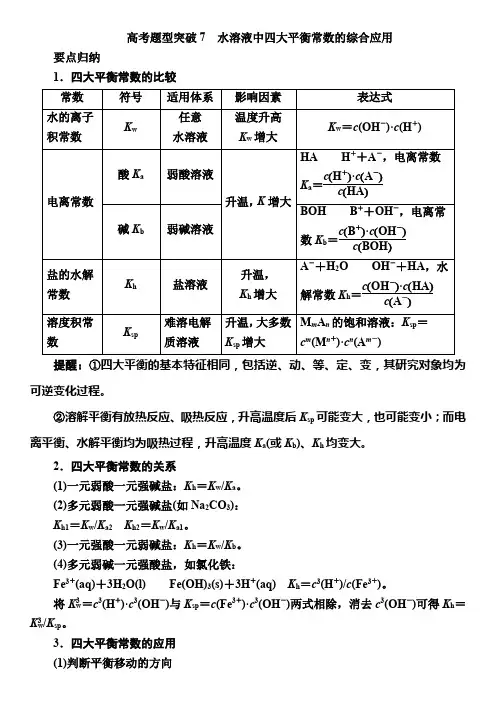
高考题型突破7水溶液中四大平衡常数的综合应用要点归纳1.四大平衡常数的比较常数符号适用体系影响因素表达式水的离子积常数K w任意水溶液温度升高K w增大K w=c(OH-)·c(H+)电离常数酸K a弱酸溶液升温,K增大HA H++A-,电离常数K a=c(H+)·c(A-)c(HA)碱K b弱碱溶液BOH B++OH-,电离常数K b=c(B+)·c(OH-)c(BOH)盐的水解常数K h盐溶液升温,K h增大A-+H2O OH-+HA,水解常数K h=c(OH-)·c(HA)c(A-)溶度积常数K sp难溶电解质溶液升温,大多数K sp增大M m A n的饱和溶液:K sp=c m(M n+)·c n(A m-)提醒:①四大平衡的基本特征相同,包括逆、动、等、定、变,其研究对象均为可逆变化过程。
②溶解平衡有放热反应、吸热反应,升高温度后K sp可能变大,也可能变小;而电离平衡、水解平衡均为吸热过程,升高温度K a(或K b)、K h均变大。
2.四大平衡常数的关系(1)一元弱酸一元强碱盐:K h=K w/K a。
(2)多元弱酸一元强碱盐(如Na2CO3):K h1=K w/K a2K h2=K w/K a1。
(3)一元强酸一元弱碱盐:K h=K w/K b。
(4)多元弱碱一元强酸盐,如氯化铁:Fe3+(aq)+3H2O(l)Fe(OH)3(s)+3H+(aq)K h=c3(H+)/c(Fe3+)。
将K3w=c3(H+)·c3(OH-)与K sp=c(Fe3+)·c3(OH-)两式相除,消去c3(OH-)可得K h=K3w/K sp。
3.四大平衡常数的应用(1)判断平衡移动的方向(2)如将NH3·H2O溶液加水稀释,c(OH-)减小,由于电离平衡常数为c(NH+4)·c(OH-) c(NH3·H2O),此值不变,故c(NH+4)c(NH3·H2O)的值增大。


{高考高参}快速突破溶液中的“四大平衡”●安徽安庆望江县第二中学 江已舒 安徽省滁州二中高中部 王叶梅(一)四大平衡相同点1.都有可逆性。
所有的平衡都建立在“可逆反应”的基础上,这四种平衡分别对应着一种可逆变化。
2.都可以用勒夏特列原理来解释。
当只改变体系中的一个条件时,平衡向能够减弱这种改变的方向移动。
(二)四大平衡不同点(三)对比表格,正确理解平衡之别1.以AgCl (s+(aq )+Cl -(aq ) ΔH>0为例,2.四大平衡常数的比较(一)弱电解质的电离平衡考向1:溶液的酸碱性及pH 的计算【典例1】将pH =1的盐酸平均分成两份,一份加入适量水,另一份加入与该盐酸物质的量浓度相同的适量NaOH 溶液,pH 都升高了1,则加入的水与NaOH 溶液的体积比为( )A.9B.10C.11D.12【答案】C【解析】将pH =1的盐酸加适量水,pH 升高了1,说明所加的水的体积是原溶液体积的9倍;另1份加入与该盐酸物质的量浓度相同的适量NaOH 溶液后,pH 升高了1,则有10-1×1-10-1·x =10-2·(1+x ),解得x =9—11,则加入的9—=11∶1。
广义的化学平衡包括电离平衡、水解平衡、沉淀溶解平衡以及狭义的化学平衡。
这四种平衡被称为四大化学平衡。
四大化学平衡是中学化学知识结构的核心内容之一,而有关这些平衡的试题在近几年的高考中出现的频率较高,逐渐成为高考的热点,考生在复习时需要给予足够的重视。
本文将对水溶液中的四大平衡进行类比分析和解读。
一、分析平衡,理清关系 二、把握命题考向,掌握解题金钥匙 {高考高参}考向2:电离平衡常数的计算和应用【典例2】下列关于一定温度、一定浓度的氨水的说法正确的是( )A. NH 3·H 2O 的电离达到平衡的标志是溶液呈电中性B.c (NH 4+)————————c (H +)·c (NH 3·H 2O)是个常数C.氨水促进了水的电离D.c (NH 4+) + c (H +)=c (NH 3·H 2O) + c (OH -)【答案】B【解析】溶液在任何情况下均呈电中性,A 项错误;设NH 3·H 2O 的电离常数为K b ,则K b =c (NH 4+)·c (OH -)———————c (NH 3·H 2O),而K W =c (H +)·c (OH -),两式相比得K b⸺K W =c (NH 4+)————————c (H +)·c (NH 3·H 2O),因为K b 、K W 为常数,故c (NH 4+)————————c (H +)·c (NH 3·H 2O)为常数,B 项正确;NH 3·H 2O 电离出OH -,抑制了水的电离,C 项错误;根据溶液中的电4+) + c (H +)=c (OH -),D项错误。

快速突破溶液中的“四大平衡”●安徽安庆望江县第二中学 江已舒 安徽省滁州二中高中部 王叶梅(一)四大平衡相同点1.都有可逆性。
所有的平衡都建立在“可逆反应”的基础上,这四种平衡分别对应着一种可逆变化。
2.都可以用勒夏特列原理来解释。
当只改变体系中的一个条件时,平衡向能够减弱这种改变的方向移动。
(二)四大平衡不同点(三)对比表格,正确理解平衡之别1.以AgCl (s+(aq )+Cl -(aq ) ΔH>0为例,2.四大平衡常数的比较(一)弱电解质的电离平衡考向1:溶液的酸碱性及pH 的计算【典例1】将pH =1的盐酸平均分成两份,一份加入适量水,另一份加入与该盐酸物质的量浓度相同的适量NaOH 溶液,pH 都升高了1,则加入的水与NaOH 溶液的体积比为( )A.9B.10C.11D.12【答案】C【解析】将pH =1的盐酸加适量水,pH 升高了1,说明所加的水的体积是原溶液体积的9倍;另1份加入与该盐酸物质的量浓度相同的适量NaOH 溶液后,pH 升高了1,则有10-1×1-10-1·x =10-2·(1+x ),解得x =9—11,则加入的9—=11∶1。
广义的化学平衡包括电离平衡、水解平衡、沉淀溶解平衡以及狭义的化学平衡。
这四种平衡被称为四大化学平衡。
四大化学平衡是中学化学知识结构的核心内容之一,而有关这些平衡的试题在近几年的高考中出现的频率较高,逐渐成为高考的热点,考生在复习时需要给予足够的重视。
本文将对水溶液中的四大平衡进行类比分析和解读。
二、把握命题考向,掌握解题金钥匙 考向2:电离平衡常数的计算和应用【典例2】下列关于一定温度、一定浓度的氨水的说法正确的是( )A. NH 3·H 2O 的电离达到平衡的标志是溶液呈电中性B.c (NH 4+)————————c (H +)·c (NH 3·H 2O)是个常数C.氨水促进了水的电离D.c (NH 4+) + c (H +)=c (NH 3·H 2O) + c (OH -)【答案】B【解析】溶液在任何情况下均呈电中性,A 项错误;设NH 3·H 2O 的电离常数为K b ,则K b =c (NH 4+)·c (OH -)———————c (NH 3·H 2O),而K W =c (H +)·c (OH -),两式相比得K b⸺K W =c (NH 4+)————————c (H +)·c (NH 3·H 2O),因为K b 、K W 为常数,故c (NH 4+)————————c (H +)·c (NH 3·H 2O)为常数,B 项正确;NH 3·H 2O 电离出OH -,抑制了水的电离,C 项错误;根据溶液中的电4+) + c (H +)=c (OH -),D项错误。


水溶液中的四大平衡知识网络:水溶液中的三大守恒规律:物料守恒、电荷守恒、质子守恒(氢离子的得失守恒)。
例1.(2016海南)向含有MgCO3固体的溶液中滴加少许浓盐酸(忽略溶液体积变化),下列数值变小的是(A)A.c(CO32−)B.c(Mg2+)C.c(H+)D. MgCO3的沉淀溶解平衡常数例2.常温下,将一定浓度的盐酸和醋酸加水稀释,溶液的导电能力随溶液体积变化的曲线如图所示。
下列说法正确的是()A.两溶液稀释前的浓度相同B.a、b、c三点溶液的pH由大到小顺序为a>b>cC.a点的K w值比b点的K w值大D.a点水电离的n(H+)大于c点水电离的n(H+)例3.已知温度为T 时,水的离子积常数为K w ,该温度下,将浓度为a mol·L -1的一元酸HA 与b mol·L -1的一元碱BOH 等体积混合,可判定该溶液呈中性的依据是( )A.a =bB.混合溶液的pH =7C.混合溶液中,c (H +)=K w mol·L -1D.混合溶液中,c (H +)+c (B +)=c (OH -)+c (A -)例4.化学在日常生活和生产中有着重要的应用,下列说法不正确的是(B )A.明矾水解形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化B.某雨水样品采集后放置一段时间,pH 由4.68变为4.28,是因为溶液中的SO 2-3水解C.将饱和FeCl 3溶液滴入沸水中可制备Fe(OH)3胶体,利用的是盐类水解原理D.纯碱溶液呈碱性的原因是CO 2-3+H 2OHCO -3+OH -变式训练:1.(2016上海)能证明乙酸是弱酸的实验事实是(B )A.CH 3COOH 溶液与Zn 反应放出H 2B.0.1mol/L CH 3COONa 溶液的pH 大于7C.CH 3COOH 溶液与NaCO 3反应生成CO 2D.0.1 mol/L CH 3COOH 溶液可使紫色石蕊变红2.(2016全国)下列有关电解质溶液的说法正确的是( D ) A.向0.1mol CH 3COOH 溶液中加入少量水,溶液中减小 B.将CH 3COONa 溶液从20℃升温至30℃,溶液中增大 C.向盐酸中加入氨水至中性,溶液中 D.向AgCl 、AgBr 的饱和溶液中加入少量AgNO 3,溶液中不变3.已知pH =2的两种一元酸x 和y ,体积均为100 mL ,稀释过程中pH 与溶液体积的关系如图所示。

高二化学四大平衡知识点在高二化学学习中,四大平衡知识点是必不可少的。
这四大平衡知识点分别是:酸碱平衡、氧化还原反应、物质的溶解度与离子产生、气体的溶解度。
首先,酸碱平衡是化学中的一项重要知识点。
酸碱平衡是指当酸和碱混合时,生成盐和水的化学反应过程。
酸和碱在水溶液中可以通过离子的形式存在,酸可以释放出氢离子(H+),碱可以释放出氢氧根离子(OH-)。
当酸和碱反应时,氢离子和氢氧根离子结合生成水,同时生成盐。
酸碱反应过程中,溶液中的pH值会发生变化,pH值越低表示酸性强,越高表示碱性强。
其次,氧化还原反应也是化学中的重要平衡知识点。
氧化还原反应是指物质在化学反应中失去或获得电子的过程。
在氧化还原反应中,有一种物质会被氧化,失去电子,称为氧化剂;另一种物质会被还原,获得电子,称为还原剂。
在这个过程中,氧化和还原是相互关联、相互作用的,成为了一个平衡反应。
第三,物质的溶解度与离子产生也是化学中的重要平衡知识点。
溶解度是指在一定温度下,单位溶剂中能溶解的最大溶质质量。
不同物质的溶解度是有差异的,这与物质的结构和性质有关。
在一些情况下,溶解度会受到温度、压强和溶质溶剂之间的相互作用影响。
另外,当物质在水中溶解时,会生成离子,这种现象被称为离子产生。
离子产生与物质溶解度紧密相关,我们可以通过了解离子产生来推测物质的溶解度。
最后,气体的溶解度也是高二化学中的重要平衡知识点。
气体的溶解度是指气体在液体或固体溶剂中溶解的程度。
溶解度与温度、压强、溶剂特性和气体性质等因素有关。
根据亨利定律,气体溶解度与气体压强成正比。
另外,气体的溶解度通常随着温度的升高而下降,这也是大家常见的原理。
综上所述,高二化学中的四大平衡知识点包括酸碱平衡、氧化还原反应、物质的溶解度与离子产生以及气体的溶解度。
理解这些知识点对于深入学习化学以及解决实际问题具有重要意义。
希望同学们在学习化学的过程中能够注重理论知识的积累,并通过实践与实验加深对这些平衡知识点的理解与应用。
溶液中的四大平衡一、弱电解质的电离平衡
1.HClO是比H
2C0
3
更弱的酸,反应:Cl
2
+H
2
0 HCl+HCl0达到平衡后,要使HClO浓度增加,可以加入
( )
A.NaOH B.HCl C.CaCO
3(固) D.H
2
O
2.体积相同,c(H+)相同的盐酸和醋酸跟足量的Na
2C0
3
反应后,产生CO
2
气体的量( )
A.盐酸的比醋酸的多B.盐酸的比醋酸的少 C.二者相等 D.无法比较
3.现有H+离子浓度相同的醋酸和盐酸,分别用蒸馏水稀释至原体积的m倍和n倍,稀释后两溶液的H+离子浓度仍旧相等,则m和n的关系是( )A.m>n B.m = n C.m<n D.无法确定
4.下列事实中一定不能证明CH3COOH是弱电解质的是( )
①常温下某CH3COONa溶液的pH=8 ②用CH3COOH溶液做导电实验,灯泡很暗
③等pH等体积的盐酸、CH3COOH溶液和足量锌反应,CH3COOH放出的氢气较多
④0.1mol·L1-CH3COOH溶液的pH=2.1 ⑤CH3COONa和H3PO4反应,生成CH3COOH
⑥0.1mol·L1-的CH3COOH溶液稀释至100倍,pH<3
A、②
B、②⑤
C、①③⑤
D、③④⑤⑥
5下列关于电解质的叙述正确的是( )
A.氯化钠溶液在电流作用下电离成钠离子和氯离子B.溶于水后能电离出氢离子的化合物都是酸C.硫酸钡难溶于水,但硫酸钡属强电解质D.CO2溶于水能部分电离,故CO2属于弱电解质6.一定量的盐酸跟过量的铁粉反应时,为了减缓反应速率,且不影响生成氢气的总量,可向盐酸中加入适量的( )A.NaOH固体B.H2O C.NH4Cl D.CH3COONa
7.分别在pH=1的酸和pH=13的NaOH溶液中加入足量的铝,放出H2的量前者多,其原因可能是( )
①两溶液的体积相同,酸是多元强酸②两溶液的体积相同,酸是一元弱酸③酸溶液的体积大于NaOH 溶液的体积④酸是强酸,浓度比NaOH溶液大
A、①②
B、②
C、②③
D、④
二、水的电离平衡
8、室温下,在pH=12的某溶液中,由水电离的c(OH-)为( )
A.1.0×10-7 mol·L-1B.1.0×10-6 mol·L-1C.1.0×10-2 mol·L-1D.1.0×10-12 mol·L-1
9、若溶液中由水电离产生的c(OH-)=1×10-14mol·L-1,满足此条件的溶液中一定可以大量共存的离子组是( )
A Al3+Na+NO3-Cl-
B K+Na+Cl-NO3-
C K+Na+Cl-AlO2-
D K+NH+4SO42-NO3-10.在25℃时,pH都等于10的KOH溶液与CH3COOK溶液中水的电离度比较( )
A. 相等
B. 前者比后者大
C. 后者比前者大
D. 两者都比纯水电离度小
11.下列溶液:①pH=0的盐酸;②0.5mol·L1-的盐酸;③0.1mol·L1-的NH4Cl溶液;④0.1mol的NaOH 溶液。
由水电离的C(H+)由大到小的顺序是( )A、①②③④B、③④②①C、①②③④D③④①②
三、盐类的水解平衡
12.等体积等浓度的MOH强碱溶液和HA弱酸溶液混合后,混合溶液中有关离子浓度关系是( )
A、C(M+)>C(OH-)>C(A-)>C(H+)
B、C(M+)> C(A-) >C(OH-)>C(H+)
C、C(M+)> C(A-)> C(H+)>C(OH-)
D、C(M+)+C(H+) =C(A-)+C(OH-)
13..在相同温度下等体积、等物质的量浓度的四种溶液:①Na2SO4②H2SO3③NaHSO3④Na2S所含带电粒子数由多到少的顺序是( )
A、①=④>③=②
B、④=①>③>②
C、①>④>③>②
D、④>①>③>②
14.用物质的量都是0.1mol HCN和NaCN混合后配成1L溶液,已知溶液中的C(CN-)<C(Na+)下列关系式正确的是( )
A.C(H+)>C(OH-)
B.C(HCN)<C(CN-)
C.C(CN-)+C(OH-)=0.1mol/L
D. C(HCN)+C(CN-)=0.2mol/L
15.某酸式盐NaHY的水溶液显碱性,下列叙述正确的是()
A.H2Y的电离方程式H2Y2H++Y2-
B.HY-离子的水解方程式 HY-+H2O H3O++Y2-
C.该酸式盐溶液中离子浓度关系 C(Na+)>C(HY-)>C(OH-)>C(H+)
D.该酸式盐溶液中离子浓度关系 C(Na+)>C(Y2-)>C(HY-)>C(OH-)>C(H+)
16.使0.1mol·L1-的Na2CO3溶液中C(H+)、C(CO32-)、C(HCO3-)都减小,其方法是
A、加入CO2气体
B、加入NaOH固体
C、通入HCl气体
D、加入饱和石灰水
17.已知在0.1mol的NaHSO3溶液中有关粒子浓度由大到小的顺序为:
①则该溶液中C(H+) C(OH-)(填“>”“=”“<”),简要说明理由(用简要文字和离子方程式表示)。
②现向NH4HSO3溶液中,逐滴加入少量含有酚酞的NaOH溶液,可观察到的现象。
写出该反应的方程式。
18 (1)的盐酸与的氨水混合后,所得溶液中各离子浓度由大到小的顺序是_______________。
(2)的溶液与的溶液混合后,所得溶液中各离子浓度由大到小的顺序是_______________。
四、沉淀溶解平衡
19、将AgNO3溶液依次加入氯化钠溶液、溴化钠溶液、碘化钾溶液中都会出现不同颜色的沉淀,沉淀的颜色变化是_ ____ →_ _ ___ →____ _。
出现这种颜色变化的原因是:_
20、将足量BaCO3分别加入:①30mL 水②10mL 0.2mol/LNa2CO3溶液③50mL 0.01mol/L 氯化钡溶液④100mL 0.01mol/L盐酸中溶解至溶液饱和。
请确定各溶液中Ba2+的浓度由大到小的顺序为:_____。