酸碱中和滴定实验操作及误差分析
- 格式:ppt
- 大小:448.00 KB
- 文档页数:14

酸碱中和滴定实验报告一、实验目的1、掌握酸碱中和滴定的原理和操作方法。
2、学会使用酸式滴定管和碱式滴定管。
3、练习使用指示剂判断滴定终点。
4、探究酸碱中和反应过程中溶液 pH 的变化规律。
二、实验原理酸碱中和滴定是利用酸碱之间的定量反应来测定未知溶液浓度的一种方法。
通常,酸(HX)和碱(MOH)发生中和反应的化学方程式为:HX + MOH = MX + H₂O在滴定过程中,当加入的标准溶液(已知浓度的酸或碱)与待测溶液中的溶质恰好完全反应时,称为滴定终点。
此时,根据所消耗的标准溶液的体积和浓度,可以计算出待测溶液中溶质的浓度。
在酸碱中和滴定中,常用的指示剂有酚酞和甲基橙。
酚酞在碱性溶液中呈红色,在酸性和中性溶液中无色;甲基橙在酸性溶液中呈红色,在碱性溶液中呈黄色,在 pH 为 31 44 时呈橙色。
三、实验仪器和药品1、仪器酸式滴定管、碱式滴定管、锥形瓶、铁架台、滴定管夹、烧杯。
2、药品01mol/L 盐酸标准溶液、未知浓度的氢氧化钠溶液、酚酞指示剂。
四、实验步骤1、检漏分别检查酸式滴定管和碱式滴定管是否漏水。
将滴定管装满水,静置一段时间后,观察液面是否下降。
如果液面下降,说明滴定管漏水,需要更换或修理。
2、洗涤用蒸馏水洗涤滴定管 2 3 次,然后分别用待装溶液(盐酸和氢氧化钠溶液)润洗 2 3 次。
3、装液将盐酸标准溶液装入酸式滴定管,将氢氧化钠溶液装入碱式滴定管。
调整液面至 0 刻度或 0 刻度以下。
4、取液用移液管或量筒准确量取一定体积的氢氧化钠待测溶液于锥形瓶中,加入 2 3 滴酚酞指示剂。
5、滴定左手控制酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视锥形瓶内溶液颜色的变化。
开始时,滴定速度可以稍快,当接近滴定终点时,应减慢滴定速度,一滴一滴地加入盐酸溶液,直到溶液的颜色恰好由红色变为无色,且半分钟内不恢复红色,即为滴定终点。
记录此时酸式滴定管的读数。
6、重复实验按照上述步骤,重复滴定 2 3 次,计算每次滴定所消耗的盐酸溶液的体积,取平均值。




酸碱中和滴定实验报告一、实验目的1、掌握酸碱中和滴定的原理和操作方法。
2、学会使用酸式滴定管和碱式滴定管,并能准确读数。
3、理解指示剂的选择和使用,能够根据实验数据计算待测溶液的浓度。
二、实验原理酸碱中和反应的实质是:H⁺+ OH⁻= H₂O。
在酸碱中和滴定中,通常用已知浓度的标准溶液(称为滴定剂)来测定未知浓度的待测溶液。
当滴定剂与待测溶液中的酸碱恰好完全反应时,根据滴定剂的用量和浓度,可以计算出待测溶液的浓度。
在酸碱中和滴定中,常用的指示剂有酚酞、甲基橙等。
酚酞在碱性溶液中呈红色,在酸性和中性溶液中无色;甲基橙在酸性溶液中呈红色,在碱性溶液中呈黄色,在中性溶液中呈橙色。
选择指示剂时,应使指示剂的变色范围在滴定的化学计量点附近,以减小滴定误差。
三、实验仪器和试剂1、仪器酸式滴定管(50 mL)碱式滴定管(50 mL)锥形瓶(250 mL)移液管(25 mL)容量瓶(250 mL)烧杯(500 mL、100 mL)玻璃棒胶头滴管铁架台(带滴定管夹)托盘天平2、试剂标准盐酸溶液(01000 mol/L)未知浓度的氢氧化钠溶液酚酞指示剂蒸馏水四、实验步骤1、配制标准盐酸溶液用洁净的小烧杯在托盘天平上称取约 05 g 基准无水碳酸钠(Na₂CO₃),倒入 100 mL 烧杯中,加入约 20 mL 蒸馏水溶解。
向溶液中滴加 1 2 滴甲基橙指示剂,用待标定的盐酸溶液滴定至溶液由黄色变为橙色,即为终点。
平行滴定 3 次,计算盐酸溶液的准确浓度。
2、配制未知浓度的氢氧化钠溶液用托盘天平称取 20 g 氢氧化钠固体,放入 500 mL 烧杯中,加入约200 mL 蒸馏水溶解。
将溶液冷却至室温后,转移至 250 mL 容量瓶中,用蒸馏水洗涤烧杯和玻璃棒 2 3 次,将洗涤液也转移至容量瓶中。
向容量瓶中加入蒸馏水至刻度线,摇匀。
3、酸碱中和滴定用移液管准确量取 2500 mL 未知浓度的氢氧化钠溶液,注入 250 mL 锥形瓶中,加入 2 3 滴酚酞指示剂。




![酸碱中和滴定实验报告[1]](https://uimg.taocdn.com/aa4d48cd6429647d27284b73f242336c1eb930df.webp)
NaOH滴定HAc的实验报告
一、实验目的:测量未知溶液的浓度
二、实验原理
三、实验仪器和药品
酸式滴定管、碱式滴定管、锥形瓶、铁架台、滴定管夹、NaOH溶液(标准液)、未知浓度的HAc
(待测液)、酚酞(变色范围8~10)
四、实验步骤
(一)滴定前的准备阶段
1、检漏:检查滴定管是否漏水
2、洗涤:先用蒸馏水洗涤滴定管,再用待装液润洗2~3次
3、量取:用酸式滴定管量出一定体积的未知浓度的HAc溶液,注入锥形瓶中,并往
锥形瓶中滴加几滴酚酞,现象为溶液不变色。
用碱式滴定管量取标准液NaOH,使液面恰好在0刻度或0刻度以下1
(二)滴定阶段
1、把锥形瓶放在碱式滴定管的下面,将滴定管中溶液逐滴滴入锥形瓶中,滴定时,右手不断旋摇锥形瓶,左手控制滴定管活塞,眼睛注视锥形瓶内溶液颜色的变化,直到滴入一滴氢氧化钠后溶液变为粉红色且半分钟内不恢复原色。
此时,醋酸恰好完全被氢氧化钠中和,达到滴定终点。
记录滴定后液面刻度V2。
2、把锥形瓶内的溶液倒入废液缸,用蒸馏水把锥形瓶洗干净,将上述操作重复3次。
(三)数据处理
注意:取三次测定数值的平均值,计算待测液的物质的量浓度
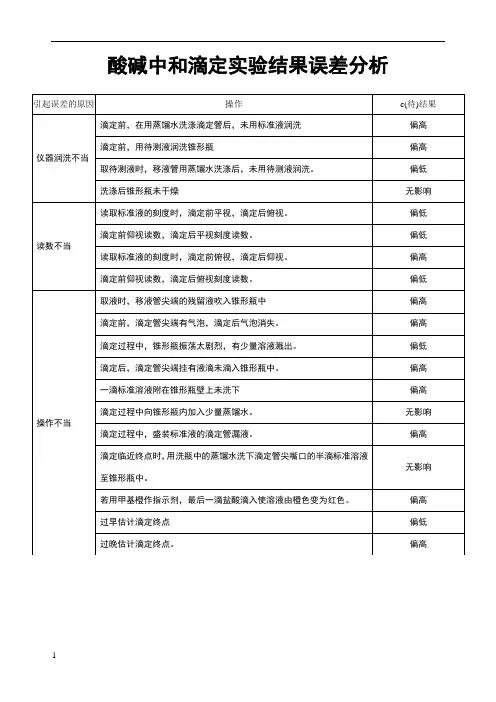
(四)误差分析
1、来自滴定管产生的误差:
①滴定管用蒸馏水洗后,未用标准液润洗②滴定管未用待测液润洗
③盛标准液的滴定管滴定前有气泡,滴定后无气泡
④盛标准液的滴定管滴定前无气泡,滴定后有气泡
⑤盛待测液的滴定管滴定前有气泡,滴定后无气泡
2、来自锥形瓶中产生的误差
锥形瓶用蒸馏水洗后又用待测液润洗
3、读数带来的误差
如:标准液读数时
①先俯视后仰视②先仰视后俯视。
1.盛标准液的滴定管用蒸馏水洗涤后未用标准液润洗。
分析:这时标准液的实际浓度变小了,所以会使其用量有所增加,导致待测液(物质的量浓度)的测定值偏大。
2.锥形瓶用蒸馏水洗涤后再用待测液润洗。
分析:这时待测液的实际总量变多了,使标准液的用量增加,导致待测液的测定值偏大。
3.盛待测液的滴定管或移液管用蒸馏水洗涤后未用待测液润洗。
分析:这时实际所取待测液的总物质的量变少了,所以会使标准液的用量减少,导致待测液的测定值偏少。
4.酸碱中和滴定。
为什么滴定前滴定管尖嘴有气泡。
结果会偏高
因为溶液会填掉气泡的体积,读数就比实际消耗的体积大。
按照读数计算的结果当然是偏高的
滴定前滴定管尖嘴有气泡滴定后尖嘴气泡消失会致使把气体也计算在体积内会使实验结果偏高
5.滴定结束滴定管尖端挂一滴液体还没滴下,为什么碱液的浓度偏大
因为我们读取酸的液体时包括滴定管尖端挂一滴液体还没滴下的这一滴,所以使得V(酸标)偏大, 所以C(碱待)偏大。
6. 酸碱中和滴定中震荡锥形瓶是部分液体溅出导致结果偏低
因为震荡时液体溅出,使得锥形瓶中的反应物减少,那么滴定所需的量就比实际的少,通过计算后结果就会偏低。