紫外-可见分光光度法测定某有色配合物的络合比及其稳定常数解析
- 格式:doc
- 大小:116.50 KB
- 文档页数:9



3.通过阅读教材及查阅相关资料,探讨如何采用紫外-可见分光光度法测定某有色配合物的络合比及其稳定常数?如何测定某染料的离解常数?请各举一例说明!解.1.配合物组分及其稳定性常数的测定分光光度法是测定配合物组成及稳定常数常用及有效的方法之一。
主要有摩尔比法、等摩尔连续变化法等.1. 摩尔比法(也称为饱和法)它是根据金属离子M与配位体R显色过程中被饱和的原则来测定配合物组成及稳定常数的方法。
设配合反应为:M + nR = MR n若M与R均不干扰MR n的吸收,且其分析浓度分别为C M,C R。
那么固定金属离子M的浓度,改变配位体R的浓度,可得到一系列C R/ C M 值不同的溶液。
在适宜波长下测定各溶液的吸光度,然后以吸光度A 对C R/C M作图(图1)。
当加入的配位体R还没有使M定量转化为MR n 时,曲线处于直线阶段;当加入的配位体R已使M定量转化为MR n并稍有了过量时,曲线便出现转折;加入的R继续过量,曲线便成水平直线。
转折点所对应的摩尔比数便是配合物的组成比。
若配合物较稳定,则转折点明显;反之则不明显,这时可用外推法求得两直线的交点。
图1 摩尔比法此法简便,适合于离解度小、组成比高的配合物组成的测定。
若形成的配合物稳定,可得到两条相交于转折点的直线,若稳定性较差,则得图1的曲线。
由于配合物的离解,使吸光度减小A'至A,A'减小的程度取决于配合物的稳定性。
稳定常数表示为:设配合物不离解时在转折点处的浓度为C,配合物的离解度为α,则达到平衡时则式中。
在转折点处可求得n,吸光度A由实验测得,A'由外推法求得,则2. 等摩尔连续变化法(又称Job法)设配合反应为:M + nR = MR n设C M与C R分别为溶液中M与R物质的量浓度(原始浓度),配置一系列溶液,保持C M+C R=C(C值恒定)。
改变C M与C R的相对比值,在MR n 的吸收波长下测定各溶液的吸光度A。
当A值达到最大时,即MR n浓度最大,该溶液中C M/C R比值即为配合物的组成比。


分光光度法测定络合物的稳定常数一、实验目的:1、掌握用分光光度法测定络合物组成及稳定常数的基本原理和方法;2、学会使用721(722)型分光光度计。
二、实验原理溶液中金属离子M 和配位体L 形成络合物MLn ,其反应式为:M + nL === MLn当达到络合平衡时,其络合稳定常数为: n LM MLn C C C K ⋅= (4-1) 式中:K 为稳定常数;C M 为络合平衡时金属离子的浓度; C L 为络合平衡时配位体浓度; C MLn 为络合平衡时络合物的浓度;n 为络合物的配位数。
在维持金属离子及配位体总摩尔数不变的条件下,改变金属离子和配位体摩尔分数的比值,并测定不同摩尔分数比值时的某一物理化学参量,在本实验中测定吸光度A ,作摩尔分数~吸光度曲线,如图4-1所示。
图4-1 摩尔分数与吸光度图 图4-2 吸光度与溶液组成图从曲线上吸光度的最大值所对应的摩尔分数值可求出n 值。
为了配制溶液的方便,通常取相同摩尔浓度的金属离子M 溶液和配位体L 溶液,维持总体积不变,按不同体积比配制一系列混合溶液,则它们的体积比亦为摩尔比,若X V 为A max 时所取L 溶液的体积分数,即:ML L V V V V X += (4-2) VV X X n -=1 (4-3) 络合物在可见光某个波长区域有强烈吸收,而金属离子和配位体几乎不被吸收,那么就可以用分光光度法测定其组成和稳定常数,本实验就是用的这种方法。
根据比耳定律,入射光I 0和透射光强I 之间有下列关系:)ex p(0kcd I I -= (4-4)即 kcd II =0ln 令 kcd II A ==0lg 式中:A 为吸光度;k 为吸收系数,对于一定溶剂、溶质及一定波长的入射光k 为常数;d 为溶液层厚度;c 为样品浓度;I 0/I 为透射比。
在维持总体积不变的条件下,配制一系列体积比不同的溶液,用V L /V M 为7/3的溶液测其最大吸收峰,找出络合物ML n 有最大吸收,而M 和L 几乎不吸收的波长数值。

紫外可见分光光度计参数解读——————————————光学系统————————————————一)检测器部分光学系统:通常是指光学系统的结构形式,目前,国际国内光度计行业常采用的机构为自准式和CT式两种结构,通常有单光束和双光束两种;二)光源系统:1. 仪器波长范围指光度计所能进行测试的波长最大值和最小值之差;2. 仪器波长准确度仪器显示波长与真实波长的接近程度,即仪器设定波长与实际波长的差值。
每台光度计都要在很多个波长点检查波长准确度;3. 仪器波长重复性波长重复性是仪器返回原波长的能力。
它体现了波长驱动机械和整个仪器的稳定性;4. 仪器光谱带宽(灵敏度,分辨力)指一个尖峰光谱带通过单色器出狭缝时,在检测器上所检测到的能量半宽度,用波长单位nm表示,从另一个角度理解这一概念会更通俗易懂:首先,单色器出狭缝不仅仅代表着狭缝的物理尺寸或几何尺寸,他还代表着光学意义,这就是光谱带宽,我们知道,来自单色器的光线不全是单一波长的光,而是一个狭窄的按波长大小顺序排列的光谱带,这一光谱带包含波长的多少,用光谱带宽来表示。
光谱带宽直接反应的是从单色器出来的光的单色性的好坏程度。
该指标与仪器的分辨力和灵敏度很相似,但又有所不同,他们从不同的侧面反应光度计性能的好坏。
分辨力是指仪器分辨两相邻波长大小的能力,假如,在相邻两波长处给仪器的输入端两个脉冲输入,在仪器的检测器上检测到的模拟信号,若信号的最小值低于最大值的80%,根据罗雷(Rayleigh)判据,就认为这两个波长是可分辨的。
实际测量时通常是用苯蒸气来测量和间峰谷)。
灵敏度是指在做低浓度测量时,当浓度改变一个单位时在检测器上所引起信号的变化量,它受校正曲线(标准曲线浓度为横轴,吸光度为纵轴)和仪器本身精密度的限制。
两种测量方法精密度相同时,校正曲线斜率越大越灵敏,而斜率相等时,精密度越高灵敏度越好。
需要指出的是,为了得到准确的测试结果,仪器的光谱带宽(Spectral Bandwith简称SBW)和分析样品的自然带宽(Natural Bandwidth 简称NBW)之比应小于, 这样可以得到% 以上的测量准确度。

分光光度法测定络合物的组成及稳定常数分光光度法测定络合物的组成及稳定常数(综合型)实验目的1、掌握分光光度法测定络合物组成及稳定常数的基本原理和方法。
2、计算络合反应的标准自由能变化。
3、学会使用分光光度计。
实验原理溶液中金属离子和配位体形成络合物。
其反应式为:,当达到平衡时,其络合稳定常数为:……… (1-1)式中:为络合物的稳定常数,、、分别为络合平衡时络合物、金属离子和配位体的浓度(严格的说(1-1)式中各浓度值应以活度来代替),为络合物的配位数。
显然,如果通过实验能测得(1-1)式中右边各项的浓度及值,则就能算得值。
本实验采用分光光度法来测定这些参数。
1.分光光度法的实验原理让可见光中各种波长的单色光分别地、依次透过溶液,其中某些波长的光即被吸收,使得透过的光形成了吸收谱带(或称吸收曲线),因而可以对不同的物质进行鉴定分析,这是定性分析的基础。
根据朗伯—比耳定律,入射光强与投射光强之间有如下关系: ……… (1-2) ……… (1-3) 式中:D 称为光密度(或吸光度);为吸光系数,对于一定溶质,溶剂及一定波长的入射光为常数;c 为溶液的浓度;为比色皿(液层)厚度;称透光率。
从(1-3)式看出,在固定液层厚度和入射光波长的条件下,光密度与溶液浓度成正比。
选择入射光波长,使它对被测物质即具有一定的灵敏度,又使溶液中其它物质的干扰为最小,做被测物质的标准工作曲线,然后测定被测溶液的光密度,根据光密度的大小即可在标准工作曲线上求得相应的浓度值,这是定量分析的基础。
2.络合物组成的测定本实验采用等摩尔连续变化法测定络合物的组成,其原理如下:在保持总摩尔数不变的情况下,依次改变体系中两组分摩尔分数的比值,配制一系列摩尔分数不同的溶液,测量这一系列溶液的光密度值。
做光密度-摩尔分数x 曲线如图5-2所示,从曲线上光密度的极大之所对应的摩尔分数值,即可求出值。
M L MLn MLn nL M =+nL M MLn K ]][[][=K ][MLn ][M ][L n n K 0I I klc e I I-=0D klc II ==0lnk k l 0I Il D C D -D D max D n为了配溶液时方便,通常取相同摩尔浓度的溶液和溶液,在维持总体积不变的条件下,按不同的体积比配成一系列混合物溶液。
分光光度法测定络合物的络合比一、实验目的:1、掌握分光光度法测定配合物配合比的原理及方法。
2、进一步熟练分光光度计的使用。
二、实验原理:在一定条件下,假设金属离子M和络合剂L发生显色反应:M+n L=M L n(略去离子电荷)可应用光度法测定络合比n,常用方法的方法有摩尔比法和等摩尔连续变化法。
本实验主要应用摩尔比法测定。
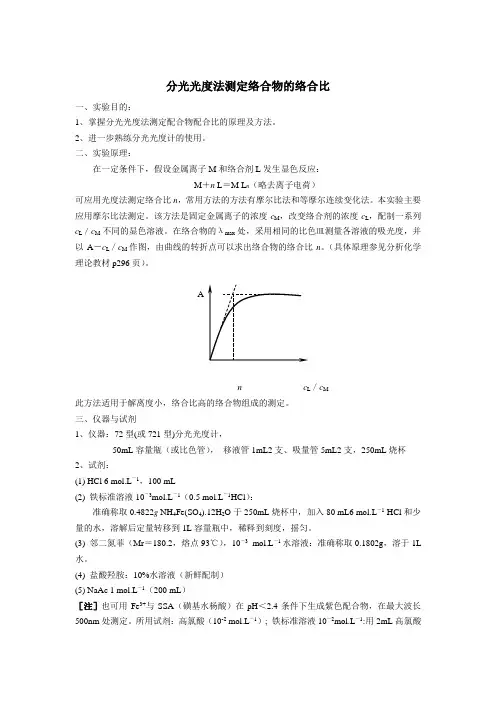
该方法是固定金属离子的浓度c M,改变络合剂的浓度c L,配制一系列c L/c M不同的显色溶液。
在络合物的λmax处,采用相同的比色皿测量各溶液的吸光度,并以A-c L/c M作图,由曲线的转折点可以求出络合物的络合比n。
(具体原理参见分析化学理论教材p296页)。
An c L/c M此方法适用于解离度小,络合比高的络合物组成的测定。
三、仪器与试剂1、仪器:72型(或721型)分光光度计,50mL容量瓶(或比色管),移液管1mL2支、吸量管5mL2支,250mL烧杯2、试剂:(1) HCl 6 mol.L-1,100 mL(2) 铁标准溶液10-3mol.L-1(0.5 mol.L-1HCl):准确称取0.4822g NH4Fe(SO4).12H2O于250mL烧杯中,加入80 mL6 mol.L-1 HCl和少量的水,溶解后定量转移到1L容量瓶中,稀释到刻度,摇匀。
(3) 邻二氮菲(Mr=180.2,熔点93℃),10-3mol.L-1水溶液:准确称取0.1802g,溶于1L 水。
(4) 盐酸羟胺:10%水溶液(新鲜配制)(5) NaAc 1 mol.L-1(200 mL)[注]也可用Fe3+与SSA(磺基水杨酸)在pH<2.4条件下生成紫色配合物,在最大波长500nm处测定。
所用试剂:高氯酸(10-2 mol.L-1); 铁标准溶液10-2mol.L-1:用2mL高氯酸溶解。
SSA:磺基水杨酸0.2542g于100mL水中定容。
四、实验步骤1、摩尔比法测定络合比的溶液配制按下表,由上至下加入试剂,在50mL容量瓶中(或比色管)配制显色溶液。


紫外光谱法测定配合物的稳定常数
定义配合物组成及其稳定常数的测定定量分析结构分析定性分析
应用范围定义紫外光谱是分子中某些价电子吸收了一定波长的电磁波,由低能级跃近到高能级而产生的一种光谱,也称之为电子光谱编辑本段原理
当分子中的电子吸收能量后会从基态跃迁到激发态,然后放出能量(辐射出特征谱线)。
回到基态而辐射出特征普线的波长在紫外区中就叫做紫外光谱目前使用的紫外光谱仪波长范围是200~800nm.其基本原理是用不同波长的近紫外光(200~400nm)依次照一定浓度的被测样品溶液时,就会发现部分波长的光被吸收。
如果以波长入为横坐标(单位nm),吸收度(absorbance)A 为纵坐标作图即得到紫外光谱(ultra violet spectra,简称UV)编辑本段应用范围
定性分析在有机化合物的定性分析中,紫外一可见光谱适用于不饱和有机化合物,尤其是共钜体系的鉴定,以此推断未知物的骨架结构。
此外,可配合红外光谱、核磁共振波谱法和质谱法进行定性鉴定和结构分析,因此它仍不失为是一种有用的辅助方法。
一般有两种定性分析方法,比较吸收光谱曲线和用经验规则计算最大吸收波长amax,然后与实测值进行比较。
1。

实验六 分光光度法测的配合物的稳定常数一、目的与要求1.掌握连续法测定配合物组成及稳定常数的方法; 2.掌握分光光度计的使用方法; 3.用分光光度法中的连续变化法测的Fe +3与钛铁试剂形成配合物的组成及稳定常数。
二、预习与思考1.了解连续法测的配合物组成及稳定常数的基本原理; 2.预习7200型分光光度计的构造原理和使用方法; 3.思考(1) 怎样求配位数n ?如何计算配合物稳定常数?(2) 测定λmax 的目的是什么?如何决定配合物最大吸收波长? (3) 使用分光光度计时应注意什么?比色皿大小如何选择? 三、实验原理溶液中金属离子M 和配位体L 形成配合物,其反应式为:n ML nL M −→←+当达到络合平衡时:n ML n M LC K C C=(6.1)式中:K 为配合物稳定常数;C M 为络合平衡时金属离子的浓度(严格应为活度);C L 为络合平衡时的配位体浓度;C MLn 为络合平衡时的配合物浓度;n 为配合物的配位数。
配合物稳定常数不仅反映了它在溶液中的热力学稳定性,而且对配合物的实际应用,特别是在分析化学方法中具有重要的参考价值。
显然,如能通过实验测得公式(6.1)中右边各项浓度及n 值,则就能算得K 值。
本实验采用分光光度来测定上列这些参数。
1. 分光光度法的实验原理:让可见光中各种波长单色光分别、依次透过有机物或无机物的溶液,其中某些波长的光即被吸收,使得透过的光形成吸收谱带。
如图П-6-1所示,这种吸收谱带对于结构不同的物质具有不同的特性,因而就可以对不同产物进行鉴定分析。
根据比尔定律,一定波长的入射光强I 0 与透射光强I 之间的关系:kcd e I I -=0 (6.2)式中:K 为吸收系数,对于一定溶质、溶剂及一定波长的入射光K 为常数,C 为溶液浓度,d 为盛样溶液的液槽的透光厚度。
由(6.2)式可得:kcd II =0ln(6.3) cd k A I I A I I 303.2,lg ,00==则得:令称透射比。
分光光度法测定络合物的稳定常数Ⅰ. 目的要求一、掌握用分光光度法测定络合物组成及稳定常数的基本原理和方法;二、学会使用72型分光光度计。
Ⅱ. 基本原理溶液中金属离子M和配位体L形成络合物ML n,其反应式为M + L ML n。
当达到络合平衡时,该络合物的稳定常数为:(1)式中:K为络合物稳定常数;C M 为络合平衡时金属离子的浓度(严格应为活度);C L为络合平衡时的配位体浓度;C MLn为络合平衡时的络合物浓度;n为络合物的配位数。
络合物稳定常数不仅反映了它在溶液中的热力学稳定性,而且对络合物的实际应用,特别是在分析化学方法中具有重要的参考价值。
显然,如能通过实验测得公式(1)中右边各项浓度及n值,则就能算得K 值。
本实验采用分光光度来测定上列这些参数。
1. 分光光度法的实验原理:让可见光中各种波长单色光分别、依次透过有机物或无机物的溶液,其中某些波长的光即被吸收,使得透过的光形成吸收谱带。
如图1所示,这种吸收谱带对于结构不同的物质具有不同的特性,因而就可以对不同产物进行鉴定分析。
根据比尔定律,一定波长的入射光I0与透射光强I之间的关系:I= I0e-kcd(2)式中:k为吸收系数,对于一定溶质、溶剂及一定波长的入射光k为常数,c为溶液浓度,d为盛样溶液的液槽的透光厚度。
由(2)式可得:(3)I0/I称为透射比,令D=2.303lg(I0/I),则得D=kcd (4)从公式可看出:在固定液槽厚度d和入射光波长的条件下,光密度D与溶液浓度c成正比,选择入射光的波长,使它对物质既有一定的灵敏度,又使溶液中其它物质的吸收干扰为最小。
作光密度D对被测物质c的关系曲线,测定未知浓度物质的吸光度,即能从D~c关系上求得相应的浓度值,这是光度法的定量分析的基础。
图1 吸收谱带2. 等摩尔数连续递变法测定络合物的组成通常在络合反应中常伴有颜色的明显变化,根据这一特点可用分光光度法测,例如Fe3+与钛铁试剂[C6H2(OH)2(SO3Na)2]在不同pH的溶液中定其组成及K稳形成不同配位数的络合物,测定该络合物的组成可用浓比递变法,这种方法的要点是先配置一系列总摩尔数不变,但体系中两个组分的摩尔分数比值依次改变的溶液,为了方便常用相同浓度的金属离子M溶液与配位体L溶液,在保持总体积不变的条件下,按不同体积比配置一系列溶液,因而这些混合溶液中Fe3+与钛铁试剂总浓度不变,当混合溶液中二者的分子比(即体积比)相当于络合物组成时,溶液中络合物浓度最高,溶液的颜色也最深,因此用分光光度计测出各份溶液的吸光度D ,利用D 对各溶液的体积比作图,则从曲线的最高点所对应的体积比即可求出络合物的组成。
紫外吸收光度法测定络合物的化学式和稳定常数数据处理紫外吸收光度法是一种常用的化学分析方法,可用于测定络合物的化学式和稳定常数。
该方法基于溶液中络合物与金属离子或配体间的相互作用导致的吸收光谱变化。
通过对吸收光谱进行测定和数据处理,可以获得所需的化学信息。
测定络合物的化学式和稳定常数的第一步是选择适当的络合试剂和金属离子。
络合试剂应该具有良好的络合能力,能与金属离子形成稳定的络合物。
金属离子应该是可溶于溶剂中的,且在溶液条件下具有可观察的吸收光谱。
在进行测定之前,我们需要制备含有不同浓度的络合物溶液。
这可以通过逐渐加入适量的络合试剂到含有金属离子的溶液中来实现。
每次添加药剂后,我们应该等待反应达到平衡,然后进行紫外吸收光谱测定。
紫外吸收光度法是一种间接测量方法。
在络合物溶液中,金属离子的吸收峰位置和强度都会发生变化。
通过测定吸收峰的强度变化,可以推测出络合物的存在及其浓度。
这是因为络合物与金属离子或配体之间的相互作用会改变吸收峰位置和强度,从而形成特征的光谱。
数据处理的主要部分是绘制吸光度曲线,并从中获取所需的信息。
吸光度曲线是通过绘制样品的吸光度与波长之间的关系得到的。
在测量过程中,我们应该选择适当的波长范围,以保证有足够的吸收信号,并避免其他干扰峰的影响。
在绘制吸光度曲线之后,我们可以使用Lambert-Beer定律来计算络合物的浓度。
根据该定律,吸光度与溶液浓度呈线性关系,即A =εlc,其中A是吸光度,ε是摩尔吸光系数,l是光程长度,c是溶液浓度。
通过比较不同浓度下的吸光度值,我们可以计算出络合物的浓度并绘制标准曲线。
此外,我们还可以从标准曲线中计算出吸光度与浓度之间的线性关系,以评估络合物的稳定性。
根据标准曲线上的数据,我们可以提取出络合物的化学式和稳定常数。
化学式可以通过反推得到,即根据金属离子和配体的摩尔比例来计算。
稳定常数可以通过求解复杂的化学方程式来推算。
稳定常数越大,络合物越稳定。
3.通过阅读教材及查阅相关资料,探讨如何采用紫外-可见分光光度法测定某有色配合物的络合比及其稳定常数?如何测定某染料的离解常数?请各举一例说明!
解.1.配合物组分及其稳定性常数的测定
分光光度法是测定配合物组成及稳定常数常用及有效的方法之一。
主要有摩尔比法、等摩尔连续变化法等.
1. 摩尔比法(也称为饱和法)
它是根据金属离子M与配位体R显色过程中被饱和的原则来测定配合物组成及稳定常数的方法。
设配合反应为:
M + nR = MR n
若M与R均不干扰MR n的吸收,且其分析浓度分别为C M,C R。
那么固定金属离子M的浓度,改变配位体R的浓度,可得到一系列C R/ C M 值不同的溶液。
在适宜波长下测定各溶液的吸光度,然后以吸光度A 对C R/C M作图(图1)。
当加入的配位体R还没有使M定量转化为MR n 时,曲线处于直线阶段;当加入的配位体R已使M定量转化为MR n并稍有了过量时,曲线便出现转折;加入的R继续过量,曲线便成水平直线。
转折点所对应的摩尔比数便是配合物的组成比。
若配合物较稳定,则转折点明显;反之则不明显,这时可用外推法求得两直线的交点。
图1 摩尔比法
此法简便,适合于离解度小、组成比高的配合物组成的测定。
若形成的配合物稳定,可得到两条相交于转折点的直线,若稳定性较差,则得图1的曲线。
由于配合物的离解,使吸光度减小A'至A,A'减小的程度取决于配合物的稳定性。
稳定常数表示为:
设配合物不离解时在转折点处的浓度为C,配合物的离解度为α,则达到平衡时
则
式中。
在转折点处可求得n,吸光度A由实验测得,A'由外推法求得,则
2. 等摩尔连续变化法(又称Job法)
设配合反应为:
M + nR = MR n
设C M与C R分别为溶液中M与R物质的量浓度(原始浓度),配置一系列溶液,保持C M+C R=C(C值恒定)。
改变C M与C R的相对比值,在MR n 的吸收波长下测定各溶液的吸光度A。
当A值达到最大时,即MR n浓度最大,该溶液中C M/C R比值即为配合物的组成比。
如以吸光度A为纵坐标,C M/C比值为横坐标作图,即绘出连续变化法曲线(图2)。
由
两曲线外推的交点所对应的C M/C值即可计算配合物的组成M与R之比(n值)。
图2. 连续变化法
该法适用于溶液中只形成一种离解度小的、配合比低的配合物组成的测定。
若以[M]、[R]和[MR n]分别表示金属离子、配位体和配合物平衡时的浓度,f为金属离子在总浓度中所占的分数,f=C M/C,则
实例:邻菲啰啉分光光度法测定微量铁和配合物的稳定常数
邻菲啰啉(又称邻二氮杂菲)是测定微量铁的一种较好的试剂。
Fe 与邻菲啰啉生成稳定的橙红色配合物,在pH值在2~9的条件下,2
反应式如下:
该配合物的lg 21.3K =稳,摩尔吸收系数51011000ε=,离解度小,组成比较高,可用摩尔比法。
在显色前,首先用盐酸羟胺把3Fe +还原成2Fe +
,其反应式如下:
.32+2224Fe 2NH OH==4Fe H O+4H N O +++++ 显色时溶液的酸度过高(pH<2),反应进行较慢;酸度太低,则2Fe +
离子水解,影响显色。
故要控制PH 在2-9,可用醋酸-醋酸钠缓冲溶液(pH=4.6)来调节。
取一定体积的铁标准溶液,加入缓冲溶液,再加入不同体积的邻菲啰啉,定容后测其吸光度,做A ~R M /c c 曲线,用外推法求得两直线的交点,即可知道配合物的络合比。
在A ~R M /c c 曲线的直线部分,取几点计算,相应的配合物稳定常数i K 和它们的平均值K 。
2.酸碱离解常数的测定
光度法是测定分析化学中应用的指示剂或显色剂离解常数的常用方法,因为它们大多数是有机弱酸或弱碱。
以一元弱酸HL 为例,在溶液中有下列的离解平衡
其离解常数
可见只要在某一确定的pH值下,知道的比值,就可算出K a。
HL 与L-是共轭酸碱对,它们的平衡浓度之和等于弱酸HL的分析浓度C,即[HL]+[L]=C。
只要两者对光的吸收都遵循吸收定律,就可以通过测
定溶液的吸光值(两者吸光度之和)求得比值。
作法是:配置n个浓度均相同为C而pH值不同的HL溶液,其中一个高酸度,一个高碱度,在某一确定的波长下(一般选择酸型或碱型的最大吸收波长),用1.0cm的吸收池测量各溶液的吸光度A,并用酸度计测量各溶液的pH值。
各溶液的吸光度为
在高酸度介质中,可认为,其吸光度为定值,记为A HL,。
在高碱度介质中,可认为,其吸光度为定值,记为A L,。
将上面的关系式联合、整理后,得到
对于一系列(如n个)C相同而pH值不同的HL溶液,测出A HL,及其余的各个A后,就可以算出各个K a值,然后求平均值。
也可以用作图法求K a值,把上式变为
算出各pH所对应的值,作~pH图,得一直线,直线在pH轴上的截距即为p K a。
实例:甲基红离解平衡常数的测定
甲基红(对一二甲氨基一邻一胺基偶氯苯),是一种弱酸型的染料指示剂,具有酸(HMR)和碱(MR)两种形式。
其分子式为:
它在溶液中部分电离,在碱性浴液中呈黄色,酸性溶液中呈红色。
它在酸性溶液中它以两种离子形式存在:
对一化学反应平衡体系,
A 总
520 = K ’HMR 520[HMR] + K ’MR-520[MR -]
A 总
430 = K ’HMR 430[HMR] + K ’MR-430[MR -]
整理后化简得:
[MR -] / [HMR] = (A 总
430K ’HMR 520- A 总
520 K ’HMR 430 )/( A 总
520 K ’MR-430 - A 总
430 K ’MR-520)
甲基红在水中电离平衡,其离解平衡常数:
由于HMR 和MR 两者在可见光谱范围内具有强的吸收峰,溶液离子强度的变化对它的酸离解平衡常数没有显著的影响,而且在简单CH3COOH —CH3COONa 缓冲体系中就很容易使颜色在pH =4~6范围内改变,因此比值[MR]/[HMR ]可用分光光度法测定而求得。
对一化学反应平衡体系,分光光度计测得的光密度包括各物质的贡献,因为式D=lgI 0/I =acl 中,当c 单位为mol /L,l 的单位为cm 时,a 为摩尔吸光系数。
由此可推知甲基红溶液中总的光密度为:
D A =a A,HMR [HMR]l +a A,MR -[MR -]l
D B =a B,HMR [HMR]l +a B,MR -[MR -]l
D A 、D B 分别为在HMR 和MR -的最大吸收波长处所测得的总的光密度。
a A,HMR 、a A,MR -和a B,HMR 、a B,MR -分别为在波长λA 和λB 下的摩尔吸光系数。
各物质的摩尔吸光系数值可由作图法求得。
例如,首先配制pH ≈2的具有各种浓度的甲基红酸性溶液,将在波长λA 分别测定各溶液的光密度对浓度作图,得到一条通过原点的直线。
由直线斜率][][lg HMR MR pH pK --=][]][[HMR MR H k -+=
可求得a A,HMR值,其余摩尔吸光系数求法类同,从而求出[MR-]与[HMR]的相对量。
再测得溶液pH值,最后按pK=pH-lg[MR-]/[HMR]即可求出pK值。