氨基酸的分类和重要的理化性质2
- 格式:ppt
- 大小:1.02 MB
- 文档页数:15






氨基酸的分类特点和理化性质氨基酸是构成蛋白质的基本单位,具有多种功能和作用。
根据它们的理化性质和分类特点,氨基酸可以分为非极性氨基酸、极性氨基酸和特殊氨基酸。
1.非极性氨基酸:非极性氨基酸的中心原子由一个氨基基团(NH2)、一个羧基(COOH)、一个氢原子(H)和一个碳原子(C)组成。
这类氨基酸的侧链由多种有机基团组成,不带任何阳离子或阴离子功能性团。
它们通常不溶于水,但溶于有机溶剂。
在生物体内,非极性氨基酸主要负责蛋白质的折叠和稳定。
在非极性氨基酸中,最简单的是甘氨酸、丙氨酸和异亮氨酸等。
这些氨基酸的侧链中带有碳和氢原子,由于不带电荷,属于非极性,因此有亲水性较强。
2.极性氨基酸:这类氨基酸的侧链通常包含含氧或氮等具有强电负性的原子,可以形成氢键、离子键等。
大多数极性氨基酸具有亲水性,能与水进行相互作用,因此溶解度较高。
极性氨基酸可以进一步分为酸性和碱性氨基酸。
-酸性氨基酸:这类氨基酸的侧链含有羟基和羧基,具有负电荷。
代表性的酸性氨基酸有天冬氨酸和谷氨酸等。
这些氨基酸在水溶液中具有酸性,能够释放出负电荷的氢离子,与基性氨基酸发生中和反应。
-碱性氨基酸:这类氨基酸的侧链含有氨基和胺基等功能性团,在水溶液中带正电荷。
代表性的碱性氨基酸有赖氨酸和精氨酸等。
这些氨基酸能够接受负电荷的氢离子,与酸性氨基酸发生中和反应。
3.特殊氨基酸:这是一类在生物体中含量较少,具有特殊功能和结构的氨基酸。
代表性的特殊氨基酸有脯氨酸、半胱氨酸、甲硫氨酸等。
这些氨基酸的结构中具有额外的官能团,能够参与特殊的生化反应和代谢途径。
总的来说,氨基酸的分类特点主要根据其理化性质和功能特点来区分。
非极性氨基酸主要由碳和氢原子组成,溶解度较低,主要负责蛋白质的结构稳定;极性氨基酸具有亲水性,溶解度较高,包括酸性和碱性两种,具有酸碱中和的作用;特殊氨基酸则具有特殊的结构和功能,用于特定的生化反应和代谢途径。
这些特征使得氨基酸能够在生物体内进行多种功能的发挥,并形成复杂的蛋白质结构。



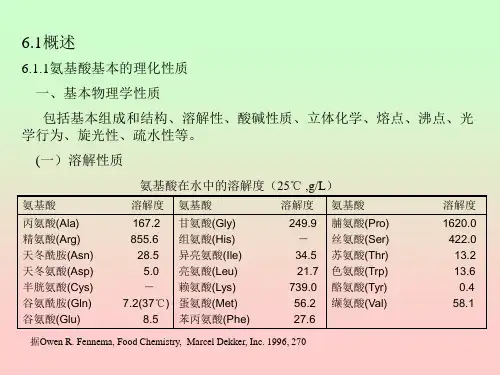
食品中的氨基酸、1概述1.1氨基酸基本的理化性质一、基本物理学性质包括基本组成和结构、溶解性、酸碱性质、立体化学、熔点、沸点、光学行为、旋光性、疏水性等。
(一)溶解性质根据氨基酸侧链与水相互作用的程度可将氨基酸分作几类。
含有脂肪族和芳香族侧链的氨基酸,如Ala、Ile、Leu、Met、Pro、Val及Phe、Tyr,由于侧链的疏水性,这些氨基酸在水中的溶解度均较小;侧链带有电荷或极性集团的氨基酸,如Arg、Asp、Glu、His、Lys和Ser、Thr、Asn在水中均有比较大的溶解度;但根据电荷及极性分析也有一些例外,如脯氨酸属于带疏水基团的氨基酸,但在水中却有异常高的溶解度。
(二)氨基酸的疏水性氨基酸的疏水性,是影响氨基酸溶解行为的重要因素,也是影响蛋白质和肽的物理化学性质(如结构、溶解度、结合脂肪的能力等)的重要因素。
按照物理化学的原理,疏水性可被定义为:在相同的条件下,一种溶于水中的溶质的自由能与溶于有机溶剂的相同溶质的自由能相比所超过的数值。
估计氨基酸侧链的相对疏水性的最直接、最简单的方法就是实验测定氨基酸溶于水和溶于一种有机溶剂的自由能变化。
一般用水和乙醇之间自由能变化表示氨基酸侧链的疏水性,将此变化值标作△G′。
(三)氨基酸的光学性质氨基酸中的苯丙氨酸、酪氨酸、色氨酸分子中由于有共轭体系,因此可以吸收近紫外光。
它们的最大吸收波长(λmax)分别为260nm、275nm、278nm;在吸收最大波长光线的时候还会发出荧光。
二、基本化学性质关于氨基酸基本的化学性质,在生物化学中已经进行了介绍。
下面再根据Owen R. Fennema, Food Chemistry, 作简要系统介绍;其主要的线索还是氨基酸分子中所带的官能团。
三、重要的分析鉴定反应(一)与茚三酮的反应(略)(二)与邻苯二甲醛的反应:在2-巯基乙醇的存在下,氨基酸与邻苯二甲醛反应生成高荧光的衍生物,在380nm激发时,在450nm 具有最高荧光发射,用来定量分析氨基酸、肽和蛋白质。
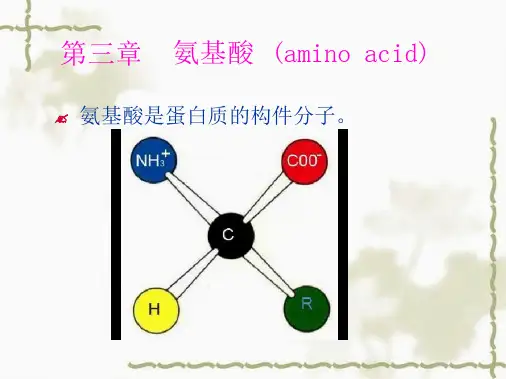
第一章氨基酸(amino acid)的结构与性质第一节氨基酸的结构与分类一、氨基酸的结构组成蛋白质的基本单位是氨基酸。
如将天然的蛋白质完全水解,最后都可得到约二十种不同的氨基酸。
从氨基酸的结构通式可以看出:构成蛋白质的氨基酸均为L—α—氨基酸。
除R 为H(甘氨酸)外,其余氨基酸均具有旋光性。
*在空间各原子有两种排列方式:L—构型与D—构型,它们的关系就像左右手的关系,互为镜像关系,下图以丙氨酸为例:二、氨基酸的分类:1.按氨基酸分子中羧基与氨基的数目分:酸性氨基酸:一氨基二羧基氨基酸,有天冬氨酸、谷氨酸;碱性氨基酸:二氨基一羧基氨基酸,有赖氨酸、精氨酸、组氨酸;中性氨基酸:一氨基一羧基氨基酸,有甘氨酸、丙氨酸、缬氨酸、亮氨酸、异亮氨酸、甲硫氨酸、半胱氨酸、苯丙氨酸、色氨酸、酪氨酸、脯氨酸、天冬酰胺、谷氨酰胺、丝氨酸、苏氨酸。
2.按侧基R 基的结构特点分:脂肪族氨基酸芳香族氨基酸:苯丙氨酸、色氨酸、酪氨酸杂环氨基酸:脯氨酸、组氨酸3.按侧基R 基与水的关系分:非极性氨基酸:有甘氨酸、丙氨酸、缬氨酸、亮氨酸、异亮氨酸、甲硫氨酸、半胱氨酸、苯丙氨酸、色氨酸、酪氨酸、脯氨酸;极性不带电氨基酸:天冬酰胺、谷氨酰胺、丝氨酸、苏氨酸;极性带电氨基酸:天冬氨酸、谷氨酸、赖氨酸、精氨酸、组氨酸。
4. 按氨基酸是否能在人体内合成分:必需氨基酸:指人体内不能合成的氨基酸,必须从食物中摄取,有八种:赖氨酸、色氨酸、甲硫氨酸、笨丙氨酸、缬氨酸、亮氨酸、异亮氨酸、苏氨酸。
非必需氨基酸:指人体内可以合成的氨基酸。
有十种。
半必需氨基酸:指人体内可以合成但合成量不能满足人体需要(特别是婴幼儿时期)的氨基酸,有两种:组氨酸、精氨酸。
三、稀有氨基酸:参加天然蛋白质分子组成的氨基酸,除了上述20 种有遗传密码的基本氨基酸之外,在少数蛋白质分子中还有一些不常见的氨基酸,称为稀有氨基酸。
它们都是在蛋白质分子合成之后,由相应的常见氨基酸分子经酶促化学修饰而成的衍生物。
氨基酸(amino acids):含有氨基和羧基的一类有机化合物的通称。
生物功能大分子蛋白质的基本组成单位,是构成动物营养所需蛋白质的基本物质。
是含有一个碱性氨基和一个酸性羧基的有机化合物,氨基一般连在α-碳上。
氨基酸的结构通式:构成蛋白质的氨基酸都是一类含有羧基并在与羧基相连的碳原子下连有氨基的有机化合物,目前自然界中尚未发现蛋白质中有氨基和羧基不连在同一个碳原子上的氨基酸。
编辑本段氨基酸分类天然的氨基酸现已经发现的有300多种,其中人体所需的氨基酸约有22种,分非必需氨基酸和必需氨基酸(人体无法自身合成)。
另有酸性、碱性、中性、杂环分类,是根据其化学性质分类的。
1、必需氨基酸(essential amino acid):指人体(或其它脊椎动物)不能合成或合成速度远不适应机体的需要,必需由食物蛋白供给,这些氨基酸称为必需氨基酸。
共有8种其作用分别是:①赖氨酸(Lysine ):促进大脑发育,是肝及胆的组成成分,能促进脂肪代谢,调节松果腺、乳腺、黄体及卵巢,防止细胞退化;②色氨酸(Tryptophane):促进胃液及胰液的产生;③苯丙氨酸(Phenylalanine):参与消除肾及膀胱功能的损耗;④蛋氨酸(又叫甲硫氨酸)(Methionine);参与组成血红蛋白、组织与血清,有促进脾脏、胰脏及淋巴的功能;⑤苏氨酸(Threonine):有转变某些氨基酸达到平衡的功能;⑥异亮氨酸(Isoleucine ):参与胸腺、脾脏及脑下腺的调节以及代谢;脑下腺属总司令部作用于甲状腺、性腺;⑦亮氨酸(Leucine ):作用平衡异亮氨酸;⑧缬氨酸(Viline):作用于黄体、乳腺及卵巢。
其理化特性大致有:1)都是无色结晶。
熔点约在230°C以上,大多没有确切的熔点,熔融时分解并放出CO2;都能溶于强酸和强碱溶液中,除胱氨酸、酪氨酸、二碘甲状腺素外,均溶于水;除脯氨酸和羟脯氨酸外,均难溶于乙醇和乙醚。
2019-2020年高中生物《氨基酸、蛋白质的结构理化性质与分类》复习资料新人教版选修3蛋白质是细胞和生物体的重要组成成分,通常占细胞干重的一半以上。
蛋白质主要由C、H、0、N四种元素组成,其中氮的含量在各种蛋白质中比较接近,平均为16%,因此用凯氏(KJelahl)法定氮测定蛋白质含量时,受检物质中含蛋白质量为氮含量的6.25倍。
蛋白质是高分子化合物,其基本组成单位是氨基酸。
(一)氨基酸1.氨基酸的结构2.氨基酸的分类根据R基团极性不同,氨基酸可分为:非极性氨基酸(9种);极性不带电荷氨基酸(6种);极性带负电荷氨基酸(2种);极性带正电荷氨基酸(3种)。
如表1-1-1所示。
根据成年人的营养需求,20种氨基酸又可分为必需氨基酸和非必需氨基酸。
必需氨基酸足指成年人体内不能合成而必须山食物提供的一类氨基酸,包括亮氨酸、异亮氨酸、缬氨酸、另;氨酸、蛋氨酸、色氨酸、赖氨酸、苯丙氨酸等8种。
精氨酸和组氨酸,在幼儿时期体内合成量满足不了生长需要,需食物补充,称为半必需氨基酸。
3.氨基酸的主要理化性质(2)两性解离和等电点α-氨基酸在中性水溶液中或固体状态下主要是以两性离子的形式存在,即在同一个氨基酸分子上带有能放出质子的-NH3+正离子和能接受质子的@一C00-负离子。
因此,氨基酸是两性电解质。
当两性离子氨基酸溶解于水时,其正负离子都能解离,但解离度与溶液的pH值有关。
向氨基酸溶液加酸时,其两性离子的-COO-负离子接受质子,自身成为正离子,在电场中向阴极移动加入碱时,其两性离子的一NH3+正离子解离放出质子(与一OH-合成水),其自身成为负离子,在电场中向阳极移动。
当凋节氨基酸溶液的pH值,使氨基酸分子上的一NH3+和一C00-的解离度完全相等时,即氨基酸所带净电荷为零,在电场中既不向阳极移动也不向阴极移动,此时氨基酸所处溶液的pH值称为该氨基酸的等电点,以符号pI表示。
在等电点时,氨基酸的溶解度最小,容易沉淀,利用这一性质可以分离制备各种氨基酸。