氨基酸的分类和重要的理化性质
- 格式:pptx
- 大小:1.05 MB
- 文档页数:31



氨基酸和蛋白质结构和功能一、组成蛋白质的20种氨基酸的分类1、非极性氨基酸包括:甘氨酸、丙氨酸、缬氨酸、亮氨酸、异亮氨酸、苯丙氨酸、脯氨酸2、极性氨基酸极性中性氨基酸:色氨酸、酪氨酸、丝氨酸、半胱氨酸、蛋氨酸、天冬酰胺、谷氨酰胺、苏氨酸酸性氨基酸:天冬氨酸、谷氨酸碱性氨基酸:赖氨酸、精氨酸、组氨酸其中:属于芳香族氨基酸的是:色氨酸、酪氨酸、苯丙氨酸属于亚氨基酸的是:脯氨酸含硫氨基酸包括:半胱氨酸、蛋氨酸注意:在识记时可以只记第一个字,如碱性氨基酸包括:赖精组二、氨基酸的理化性质1、两性解离及等电点氨基酸分子中有游离的氨基和游离的羧基,能与酸或碱类物质结合成盐,故它是一种两性电解质。
在某一PH的溶液中,氨基酸解离成阳离子和阴离子的趋势及程度相等,成为兼性离子,呈电中性,此时溶液的PH称为该氨基酸的等电点。
2、氨基酸的紫外吸收性质芳香族氨基酸在280nm波长附近有最大的紫外吸收峰,由于大多数蛋白质含有这些氨基酸残基,氨基酸残基数与蛋白质含量成正比,故通过对280nm波长的紫外吸光度的测量可对蛋白质溶液进行定量分析。
3、茚三酮反应氨基酸的氨基与茚三酮水合物反应可生成蓝紫色化合物,此化合物最大吸收峰在570nm波长处。
由于此吸收峰值的大小与氨基酸释放出的氨量成正比,因此可作为氨基酸定量分析方法。
(注意与实验一结合)三、肽两分子氨基酸可借一分子所含的氨基与另一分子所带的羧基脱去1分子水缩合成最简单的二肽。
二肽中游离的氨基和羧基继续借脱水作用缩合连成多肽。
10个以内氨基酸连接而成多肽称为寡肽;39个氨基酸残基组成的促肾上腺皮质激素称为多肽;51个氨基酸残基组成的胰岛素归为蛋白质。
多肽连中的自由氨基末端称为N端,自由羧基末端称为C端,命名从N端指向C端。
人体内存在许多具有生物活性的肽,重要的有:谷胱甘肽(GSH):是由谷、半胱和甘氨酸组成的三肽。
半胱氨酸的巯基是该化合物的主要功能基团。
GSH的巯基具有还原性,可作为体内重要的还原剂保护体内蛋白质或酶分子中巯基免被氧化,使蛋白质或酶处于活性状态。

氨基酸的分类特点和理化性质氨基酸是构成蛋白质的基本单位,具有多种功能和作用。
根据它们的理化性质和分类特点,氨基酸可以分为非极性氨基酸、极性氨基酸和特殊氨基酸。
1.非极性氨基酸:非极性氨基酸的中心原子由一个氨基基团(NH2)、一个羧基(COOH)、一个氢原子(H)和一个碳原子(C)组成。
这类氨基酸的侧链由多种有机基团组成,不带任何阳离子或阴离子功能性团。
它们通常不溶于水,但溶于有机溶剂。
在生物体内,非极性氨基酸主要负责蛋白质的折叠和稳定。
在非极性氨基酸中,最简单的是甘氨酸、丙氨酸和异亮氨酸等。
这些氨基酸的侧链中带有碳和氢原子,由于不带电荷,属于非极性,因此有亲水性较强。
2.极性氨基酸:这类氨基酸的侧链通常包含含氧或氮等具有强电负性的原子,可以形成氢键、离子键等。
大多数极性氨基酸具有亲水性,能与水进行相互作用,因此溶解度较高。
极性氨基酸可以进一步分为酸性和碱性氨基酸。
-酸性氨基酸:这类氨基酸的侧链含有羟基和羧基,具有负电荷。
代表性的酸性氨基酸有天冬氨酸和谷氨酸等。
这些氨基酸在水溶液中具有酸性,能够释放出负电荷的氢离子,与基性氨基酸发生中和反应。
-碱性氨基酸:这类氨基酸的侧链含有氨基和胺基等功能性团,在水溶液中带正电荷。
代表性的碱性氨基酸有赖氨酸和精氨酸等。
这些氨基酸能够接受负电荷的氢离子,与酸性氨基酸发生中和反应。
3.特殊氨基酸:这是一类在生物体中含量较少,具有特殊功能和结构的氨基酸。
代表性的特殊氨基酸有脯氨酸、半胱氨酸、甲硫氨酸等。
这些氨基酸的结构中具有额外的官能团,能够参与特殊的生化反应和代谢途径。
总的来说,氨基酸的分类特点主要根据其理化性质和功能特点来区分。
非极性氨基酸主要由碳和氢原子组成,溶解度较低,主要负责蛋白质的结构稳定;极性氨基酸具有亲水性,溶解度较高,包括酸性和碱性两种,具有酸碱中和的作用;特殊氨基酸则具有特殊的结构和功能,用于特定的生化反应和代谢途径。
这些特征使得氨基酸能够在生物体内进行多种功能的发挥,并形成复杂的蛋白质结构。

各种氨基酸的作用2天然的氨基酸现已经发现的有300多种,其中人体所需的氨基酸约有22种,分非必需氨基酸和必需氨基酸(人体无法自身合成)。
另有酸性、碱性、中性、杂环分类,是根据其化学性质分类的。
1、必需氨基酸(essential amino acid): 指人体(或其它脊椎动物)不能合成或合成速度远不适应机体的需要,必需由食物蛋白供给,这些氨基酸称为必需氨基酸。
共有8种其作用分别是:赖氨酸(Lysine ):促进大脑发育,是肝及胆的组成成分,能促进脂肪代谢,调节松果腺、乳腺、黄体及卵巢,防止细胞退化;色氨酸(Tryptophan):促进胃液及胰液的产生;苯丙氨酸(Phenylalanine):参与消除肾及膀胱功能的损耗;蛋氨酸(又叫甲硫氨酸)(Methionine);参与组成血红蛋白、组织与血清,有促进脾脏、胰脏及淋巴的功能;苏氨酸(Threonine):有转变某些氨基酸达到平衡的功能;异亮氨酸(Isoleucine ):参与胸腺、脾脏及脑下腺的调节以及代谢;脑下腺属总司令部作用于甲状腺、性腺;亮氨酸(Leucine ):作用平衡异亮氨酸;缬氨酸(Valine):作用于黄体、乳腺及卵巢。
8种人体必需氨基酸的记忆口诀"借一两本蛋色书来"谐音: 借(缬氨酸), 一(异亮氨酸),两(亮氨酸),本(苯丙氨酸),蛋(蛋氨酸),色(色氨酸),书(苏氨酸),来(赖氨酸)."笨蛋来宿舍,晾一晾鞋"笨(苯丙氨酸)蛋(蛋氨酸)来(赖氨酸)宿(苏氨酸)舍(色氨酸),晾(亮氨酸)一晾(异亮氨酸)鞋(缬氨酸)”携带一两本甲硫色书来”携(缬氨酸)带一(异亮氨酸)两(亮氨酸)本(苯丙氨酸)甲硫(甲硫氨酸)色(色氨酸)书(苏氨酸)来(赖氨酸)其理化特性大致有:1)都是无色结晶。
熔点约在230?C以上,大多没有确切的熔点,熔融时分解并放出CO2;都能溶于强酸和强碱溶液中,除胱氨酸、酪氨酸、二碘甲状腺素外,均溶于水;除脯氨酸和羟脯氨酸外,均难溶于乙醇和乙醚。


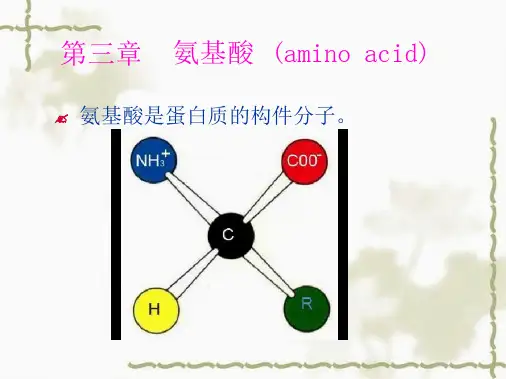
第⼆章氨基酸第⼆章氨基酸蛋⽩质是⽣物分⼦中⽣物功能的载体,要了解⽣命的基本活动规律,必须了解蛋⽩质。
⽽氨基酸是蛋⽩质的基本构件。
⼀、蛋⽩质⽔解特性蛋⽩质的⽔解⽅法主要有三种:1.酸⽔解,优点:⽔解彻底,不引起消旋作⽤;缺点:引起部分氨基酸被破坏:⾊氨酸完全破坏丝氨酸和苏氨酸(羟基氨基酸)部分破坏天冬氨酸和⾕氨酰氨(酰氨氨基酸)酰氨基被⽔解2.碱⽔解,优点:可使蛋⽩质完全⽔解,⾊氨酸稳定缺点:产⽣消旋,部分氨基酸破坏:精氨酸被脱氨⽣成鸟氨酸。
酸⽔解和碱⽔解可以互补3.酶⽔解:优点:不产⽣消旋,也不破坏氨基酸缺点:只⽤⼀种酶时⽔解不完全,需要⼏种酶协同作⽤才能彻底⽔解。
⼆、氨基酸是蛋⽩质的基本组成材料氨基酸的名称与符号丙氨酸Ala A精氨酸Arg R天冬酰氨Asn Asx N天冬氨酸Asp Asx D半胱氨酸Cys C⾕氨酰胺Gln Glx Q⾕氨酸Glu Glx E⽢氨酸Gly G组氨酸His H异亮氨酸Ile I亮氨酸Leu L赖氨酸Lys K甲硫氨酸Met M苯丙氨酸Phe F脯氨酸Pro P丝氨酸Ser S苏氨酸Thr T⾊氨酸Trp W酪氨酸Tyr Y缬氨酸Val V三、L-氨基酸的基本结构残基:在肽链中每个氨基酸都脱去⼀个⽔分⼦,脱⽔后的残余部分叫残基(residue), 因此蛋⽩质肽链中的氨基酸统统是残基形式。
判断法(看CAR的⾛向)将H原⼦靠近⾃⼰,观察CAR的⾛向,逆时针(左转)为L型,顺时针(右转)为D型。
四、氨基酸的分(合成蛋⽩质)氨基酸分类:1. 20种常见(合成蛋⽩质)氨基酸分类:根据R链的结构分3类(见教科书124-127)脂肪簇氨基酸15种(包含:中性氨基酸5种;羟基氨基酸2种;含硫氨基酸2种;酰氨氨基酸2种,酸性氨基酸2种,碱性氨基酸2种)芳⾹族氨基酸2种杂环族氨基酸3种根据带电和极性⼜分4类:⾮极性;不带电的极性; 带正电荷;带负电荷2. 不常见(蛋⽩质中被修饰)的氨基酸:如:4-羟脯氨酸;4-羟赖氨酸;6-N-甲基赖氨酸;锁链素等。

第一章氨基酸(amino acid)的结构与性质第一节氨基酸的结构与分类一、氨基酸的结构组成蛋白质的基本单位是氨基酸。
如将天然的蛋白质完全水解,最后都可得到约二十种不同的氨基酸。
从氨基酸的结构通式可以看出:构成蛋白质的氨基酸均为L—α—氨基酸。
除R 为H(甘氨酸)外,其余氨基酸均具有旋光性。
*在空间各原子有两种排列方式:L—构型与D—构型,它们的关系就像左右手的关系,互为镜像关系,下图以丙氨酸为例:二、氨基酸的分类:1.按氨基酸分子中羧基与氨基的数目分:酸性氨基酸:一氨基二羧基氨基酸,有天冬氨酸、谷氨酸;碱性氨基酸:二氨基一羧基氨基酸,有赖氨酸、精氨酸、组氨酸;中性氨基酸:一氨基一羧基氨基酸,有甘氨酸、丙氨酸、缬氨酸、亮氨酸、异亮氨酸、甲硫氨酸、半胱氨酸、苯丙氨酸、色氨酸、酪氨酸、脯氨酸、天冬酰胺、谷氨酰胺、丝氨酸、苏氨酸。
2.按侧基R 基的结构特点分:脂肪族氨基酸芳香族氨基酸:苯丙氨酸、色氨酸、酪氨酸杂环氨基酸:脯氨酸、组氨酸3.按侧基R 基与水的关系分:非极性氨基酸:有甘氨酸、丙氨酸、缬氨酸、亮氨酸、异亮氨酸、甲硫氨酸、半胱氨酸、苯丙氨酸、色氨酸、酪氨酸、脯氨酸;极性不带电氨基酸:天冬酰胺、谷氨酰胺、丝氨酸、苏氨酸;极性带电氨基酸:天冬氨酸、谷氨酸、赖氨酸、精氨酸、组氨酸。
4. 按氨基酸是否能在人体内合成分:必需氨基酸:指人体内不能合成的氨基酸,必须从食物中摄取,有八种:赖氨酸、色氨酸、甲硫氨酸、笨丙氨酸、缬氨酸、亮氨酸、异亮氨酸、苏氨酸。
非必需氨基酸:指人体内可以合成的氨基酸。
有十种。
半必需氨基酸:指人体内可以合成但合成量不能满足人体需要(特别是婴幼儿时期)的氨基酸,有两种:组氨酸、精氨酸。
三、稀有氨基酸:参加天然蛋白质分子组成的氨基酸,除了上述20 种有遗传密码的基本氨基酸之外,在少数蛋白质分子中还有一些不常见的氨基酸,称为稀有氨基酸。
它们都是在蛋白质分子合成之后,由相应的常见氨基酸分子经酶促化学修饰而成的衍生物。
2019-2020年高中生物《氨基酸、蛋白质的结构理化性质与分类》复习资料新人教版选修3蛋白质是细胞和生物体的重要组成成分,通常占细胞干重的一半以上。
蛋白质主要由C、H、0、N四种元素组成,其中氮的含量在各种蛋白质中比较接近,平均为16%,因此用凯氏(KJelahl)法定氮测定蛋白质含量时,受检物质中含蛋白质量为氮含量的6.25倍。
蛋白质是高分子化合物,其基本组成单位是氨基酸。
(一)氨基酸1.氨基酸的结构2.氨基酸的分类根据R基团极性不同,氨基酸可分为:非极性氨基酸(9种);极性不带电荷氨基酸(6种);极性带负电荷氨基酸(2种);极性带正电荷氨基酸(3种)。
如表1-1-1所示。
根据成年人的营养需求,20种氨基酸又可分为必需氨基酸和非必需氨基酸。
必需氨基酸足指成年人体内不能合成而必须山食物提供的一类氨基酸,包括亮氨酸、异亮氨酸、缬氨酸、另;氨酸、蛋氨酸、色氨酸、赖氨酸、苯丙氨酸等8种。
精氨酸和组氨酸,在幼儿时期体内合成量满足不了生长需要,需食物补充,称为半必需氨基酸。
3.氨基酸的主要理化性质(2)两性解离和等电点α-氨基酸在中性水溶液中或固体状态下主要是以两性离子的形式存在,即在同一个氨基酸分子上带有能放出质子的-NH3+正离子和能接受质子的@一C00-负离子。
因此,氨基酸是两性电解质。
当两性离子氨基酸溶解于水时,其正负离子都能解离,但解离度与溶液的pH值有关。
向氨基酸溶液加酸时,其两性离子的-COO-负离子接受质子,自身成为正离子,在电场中向阴极移动加入碱时,其两性离子的一NH3+正离子解离放出质子(与一OH-合成水),其自身成为负离子,在电场中向阳极移动。
当凋节氨基酸溶液的pH值,使氨基酸分子上的一NH3+和一C00-的解离度完全相等时,即氨基酸所带净电荷为零,在电场中既不向阳极移动也不向阴极移动,此时氨基酸所处溶液的pH值称为该氨基酸的等电点,以符号pI表示。
在等电点时,氨基酸的溶解度最小,容易沉淀,利用这一性质可以分离制备各种氨基酸。
编辑词条氨基酸百科名片氨基酸(amino acid):含有氨基和羧基的一类有机化合物的通称。
生物功能大分子蛋白质的基本组成单位,是构成动物营养所需蛋白质的基本物质。
是含有一个碱性氨基和一个酸性羧基的有机化合物。
氨基连在α-碳上的为α-氨基酸。
天然氨基酸均为α-氨基酸。
目录[隐藏]氨基酸的结构通式氨基酸的分类氨基酸的检测氨基酸的功能氨基酸合成氨基酸所对应的密码子表氨基酸胶囊氨基酸的结构通式氨基酸的分类氨基酸的检测氨基酸的功能氨基酸合成氨基酸所对应的密码子表氨基酸胶囊amino acid (abbr.aa)[编辑本段]氨基酸的结构通式α-氨基酸的结构通式:(R是可变基团)构成蛋白质的氨基酸都是一类含有羧基并在与羧基相连的碳原子下连有氨基的有机化合物,目前自然界中尚未发现蛋白质中有氨基和羧基不连在同一个碳原子上的氨基酸。
[编辑本段]氨基酸的分类天然的氨基酸现已经发现的有300多种,其中人体所需的氨基酸约有22种,分非必需氨基酸和必需氨基酸(人体无法自身合成)。
另有酸性、碱性、中性、杂环分类,是根据其化学性质分类的。
1、必需氨基酸(essential amino acid):指人体(或其它脊椎动物)不能合成或合成速度远不适应机体的需要,必需由食物蛋白供给,这些氨基酸称为必需氨基酸。
共有10种其作用分别是:①赖氨酸(Lysine ):促进大脑发育,是肝及胆的组成成分,能促进脂肪代谢,调节松果腺、乳腺、黄体及卵巢,防止细胞退化;②色氨酸(Tryptophan):促进胃液及胰液的产生;③苯丙氨酸(Phenylalanine):参与消除肾及膀胱功能的损耗;④蛋氨酸(又叫甲硫氨酸)(Methionine);参与组成血红蛋白、组织与血清,有促进脾脏、胰脏及淋巴的功能;⑤苏氨酸(Threonine):有转变某些氨基酸达到平衡的功能;⑥异亮氨酸(Isoleucine ):参与胸腺、脾脏及脑下腺的调节以及代谢;脑下腺属总司令部作用于甲状腺、性腺;⑦亮氨酸(Leucine ):作用平衡异亮氨酸;⑧缬氨酸(Valine):作用于黄体、乳腺及卵巢。