质粒载体的构建
- 格式:pdf
- 大小:86.33 KB
- 文档页数:2

质粒构建实验步骤实验一1.将合成的引物溶解(10uM),分别扩增P1P2,P3P4,2.PCR扩增条件如下:95 ℃ 10 min95 ℃ 30 s50℃ 30 s 10cycle72℃ 30 s72℃ 5min3.反应体系为:20 ul (p1p2和p3p4各两管)dNTP 2 ul10xBuffer 2ulTaq 0.4 ulPrimer P1 (P3) 1.0 ulPrimer P2 (P4) 1.0 ulH2O 13.6 ul4.将产物电泳,检测是否为目标片断(分别为A1B、A2B),证实为目的片断以后,进行后续扩增5.将扩增出的AB和CD片断等摩尔加入作为模板进行第二次PCR,并且在第二次PCR 时加入引物扩增25个循环,PCR扩增条件如下:95 ℃ 15 min95 ℃ 30 s60 ℃ 30 s 25cycle72℃ 40 s72℃ 5min6.反应体系为:100uldNTP 10 ul10xBuffer 10 ulTaq 1ulProduct P1P2 2 ulProduct P3P4 2 ulPrimer F 1 ulPrimer R 1 ulH2O 73ul实验二连接载体DNA外源DNA片段10×T4 DNA ligase bufferT4 DNA ligase 0.5μl16℃保温8-24小时。
做二组对照反应,其中对照组一只有质粒载体无外源DNA;对照组二只有外源DNA片段没有质粒载体。
实验三10.转化①取100ul感受态细胞置于冰上融化,将50ul感受态细胞加入至10ul连接产物中,冰上30min。
②42℃放置45~60s,冰上放置2~3min。
③加入37℃预温好的200ul LB液体培养基(不含Amp)④37℃振荡培养1h(160~220 rpm)11.铺板铺板之前要先将AMP抗性的LB固体培养基先预温到常温,然后取100 ul菌液涂板,37℃培养过夜(16~24h)12.不带有质粒DNA的细胞,由于无Amp抗性,不能在含有Amp的筛选培养基上成活。


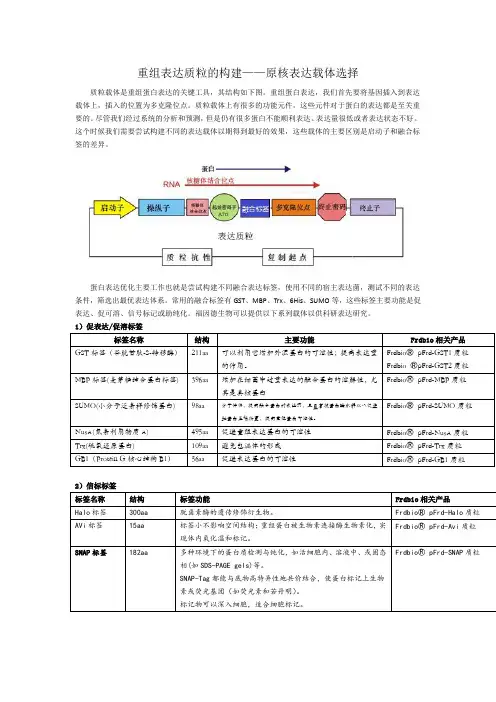
重组表达质粒的构建——原核表达载体选择质粒载体是重组蛋白表达的关键工具,其结构如下图。
重组蛋白表达,我们首先要将基因插入到表达载体上,插入的位置为多克隆位点。
质粒载体上有很多的功能元件,这些元件对于蛋白的表达都是至关重要的。
尽管我们经过系统的分析和预测,但是仍有很多蛋白不能顺利表达、表达量很低或者表达状态不好。
这个时候我们需要尝试构建不同的表达载体以期得到最好的效果,这些载体的主要区别是启动子和融合标签的差异。
蛋白表达优化主要工作也就是尝试构建不同融合表达标签,使用不同的宿主表达菌,测试不同的表达条件,筛选出最优表达体系。
常用的融合标签有GST、MBP、Trx、6His、SUMO等,这些标签主要功能是促表达、促可溶、信号标记或助纯化。
福因德生物可以提供以下系列载体以供科研表达研究。
1)促表达/促溶标签2)信标标签3)纯化标签我们选择表达载体的时候不但要考虑蛋白怎么表达成功,更要考虑蛋白怎么纯化出来,纯化的问题主要是考虑纯化标签和酶切位点的选择,下表我们列举了常见的纯化标签和酶切位点。
4)酶切位点以上为原核表达常用的标签和酶切位点,其性质也都作了简要的介绍,各专业网站或专业书籍已对此做详尽解释,科研工作者可根据具体实验设计方案,组合设计以上标签和酶切位点的使用。
特别值得注意的是,选用和设计蛋白酶切位点的时候首要考虑的是序列内部有没有蛋白酶位点,同时要考虑酶切的效率和蛋白酶试剂成本。
一般商业化载体,在标签蛋白与载体多克隆位点之间都设计有酶切位点。
标签可设计在N-端也可在C-端,设计在N-端的优势是,可通过标签高效翻译起始位点带动插入蛋白的表达,可溶性标签的高效表达更可促进蛋白的可溶性表达;同时,大部分的蛋白内切酶的切割位点在C-端,所以标签设计在N-端可将标签切割完全。
在设计标签序列与酶切位点的时候还要考虑N-端稳定性原则,也就是所谓宿主细胞的N-端规则(N-end rule),这个要避免;同时,还应该检查是否引入了可与别的蛋白相互作用的序列或者蛋白酶切位点。


PCR(多聚酶链式反应)一、实验原理PCR用于扩增位于两端已知序列之间的DNA区段,即通过引物延伸而进行的重复双向DNA合成。
基本原理及过程如下:PCR循环过程中有三种不同的事件发生:(1)模板变性;(2)引物退火;(3)热稳定DNA聚合酶进行DNA合成。
1、变性:加热使模板DNA在高温下(94-95℃)变性,双链间的氢键断裂而形成两条单链,即变性阶段。
2、退火:在体系温度降至37-65℃,模板DNA与引物按碱基配对原则互补结合,使引物与模板链3’端结合,形成部分双链DNA,即退火阶段。
3、延伸:体系反应温度升至中温72℃,耐热DNA聚合酶以单链DNA为模板,在引物的引导下,利用反应混合物中的4种脱氧核苷三磷酸(dNTP),按5’到3’方向复制出互补DNA,即引物的延伸阶段。
上述3步为一个循环,即高温变性、低温退火、中温延伸3个阶段。
从理论上讲,每经过一个循环,样本中的DNA量应该增加一倍,新形成的链又可成为新一轮循环的模板,经过25~30个循环后DNA可扩增106~109倍。
典型的PCR反应体系由如下组分组成:DNA模板、反应缓冲液、dNTP、MgCl2、两条合成的DNA引物、耐热DNA Taq聚合酶。
二、按下列组份配制PCR 反应液TaKaRa LA Taq(5 U/μl)0.5 μl10×LA PCR Buffer II(Mg2+ Plus) 5 μldNTP Mixture(各2.5 mM)8 μl模板DNA(λDNA)* 2.5 ng引物1(10 μM) 2 μl引物2(10 μM) 2 μl灭菌蒸馏水up to 50 μl*【50 μl PCR反应体系中模板DNA 推荐使用量】人基因组DNA 0.1 μg~1 μg大肠杆菌基因组DNA 10 ng~100 ngλDNA 0.5 ng~5 ng质粒DNA 0.1 ng~10 ng三、PCR 反应条件。
以λDNA 为模板,扩增 1 kbp、35 kbp 的DNA片段的PCR 反应条件如下:【1 kbp】95℃ 5 min.95℃30 sec.55℃30 sec. 35 Cycles72℃ 1 min.72℃10 min.【35 kbp】94℃ 5 min.98℃10 sec.68℃15 min. 35 Cycles72℃10 min.常用循环:95℃ 5 min.95℃45 sec.55℃45 sec. 35 Cycles72℃ 2 min.72℃10 min.四、可能出现的问题与解决方案:1、假阴性,不出现扩增条带PCR反应的关键环节有①模板核酸的制备,②引物的质量与特异性,③酶的质量,④PCR循环条件。

质粒载体的构建及其在基因工程中的应用研究随着基因工程技术的不断发展,质粒载体成为了实现基因转化的重要手段之一。
质粒载体构建是基因工程研究的重要环节,其成功与否直接关系到后续研究的开展和成果的取得。
本文将介绍质粒载体的构建原理、构建方法以及其在基因工程中的应用研究。
一、质粒载体的构建原理质粒载体是人工合成的单链圆形DNA分子,作为存储DNA序列的一种手段,其基本结构特征主要包括起始端、终止端、多个酶切位点、标记位点等。
考虑到质粒载体在基因工程研究中的应用,构建原理主要包括以下几点:1. 合成目的基因的DNA序列,包括启动子、编码区、终止子等。
2. 找到合适的质粒载体,通过酶切识别并将目的基因DNA序列与质粒载体进行连接。
3. 对连接后的质粒载体进行转化,将其转移到细胞中,获得外显表达的蛋白。
质粒载体的构建原理相对简单,但质粒载体在实际应用中的构建过程则需要复杂的技术手段和严密的实验操作。
二、质粒载体构建方法1. 基于PCR扩增法PCR扩增法是目前基因工程研究中最常用的方法之一。
选择需要进行扩增的目的基因DNA序列,使用酶切产生目的碎片,通过PCR扩增后,利用限制性内切酶等酶切方法进行连接。
2. 基于化学合成法在基于化学合成法中,研究者可以通过化学合成方式来合成目的基因DNA序列,在此基础上通过PCR扩增和限制性内切酶等酶切方法进行连接。
3. 基于网站选择法基于网站选择法是现在比较流行的方法之一,具有操作简单、成本低等优点。
研究者可以在网站上选择目的基因序列,并结合实验室已有的质粒载体库,在网站上进行设计、合成、定制和质粒表达等步骤。
三、质粒载体在基因工程中的应用研究质粒载体在基因工程中的应用研究十分广泛,可以用于植物基因转化、动物基因转化、疫苗研发、DNA疫苗的制备、表达蛋白的研究等方面。
1. 植物基因转化通过基因转化技术向植物中加入外源基因,可以使植物表现出新的性状或特征。
在实践中,研究者会将需要转入的序列合成后,利用限制性内切酶或其他酶切方法将其插入到质粒载体中,再利用农杆菌等工具将质粒载体导入植物细胞中,从而实现植物基因转化。


质粒的构建一、质粒构建的基本原理1.1 质粒结构质粒是一种环状DNA分子,通常大小在1-200 kb之间,其中包含了一个或多个基因编码序列,以及与复制、表达等相关的功能序列。
质粒通常由多个功能区域组成,包括基因插入位点、选择标记、复制起点、多克隆位点等。
1.2 质粒构建方法质粒构建一般分为以下几个步骤:基因克隆、质粒挑选、连接反应、转化、筛选,这些步骤通常需要借助于PCR、限制性内切酶、DNA连接酶、转化试剂等。
1.3 质粒的应用质粒构建技术广泛应用于基因工程、蛋白质表达、基因敲除、基因组编辑等领域。
通过构建特定功能的质粒,可以实现对基因的操控和调控,对生物学功能进行研究。
二、质粒构建的方法与步骤2.1 基因克隆质粒构建的第一步通常是通过PCR扩增目的基因,得到目的基因片段。
基因片段的选择根据实验需要,可以是全长基因、部分序列、突变体等。
2.2 质粒挑选选择合适的质粒载体是质粒构建的关键一步。
通常质粒载体的选择考虑到基因插入位点、复制起点、选择标记等功能。
常用的质粒载体有pUC19、pBR322、pET等。
2.3 连接反应将基因片段与质粒载体进行连接反应,通常需要利用DNA连接酶将两者连接起来。
连接反应后,通过热激酶等方法将连接产物转化到大肠杆菌等宿主细胞中。
2.4 转化转化是将连接后的质粒DNA导入到宿主细胞中的过程,通常采用化学转化、电穿孔转化、热激等方法进行。
2.5 筛选通过选择标记或多克隆位点等方法对转化后的细胞进行筛选,筛选出含有目的质粒的阳性克隆。
通常可以利用抗生素抗性筛选、荧光报告基因筛选等方法。
三、质粒构建的应用3.1 基因工程质粒构建技术可以用于将外源基因导入到宿主细胞中,实现基因的操控和表达。
通过构建携带感兴趣基因的质粒,可以实现对基因编码蛋白质的表达和研究。
3.2 蛋白质表达利用质粒携带外源基因序列,在宿主细胞中进行蛋白质表达。
通过构建携带目的基因的质粒,可以实现对特定蛋白质的大量表达和纯化。

质粒构建流程一、引物设计1)取得目的基因序列,可选用数据库NCBI2)软件分析目的基因可用酶切位点。
使用primer5分析出序列不包含的酶切位点,即为可用没切位点。
3)选择载体。
根据转染细胞和实验室资源,选择合适载体。
如pcDNA3.1(+),4)选择酶切位点。
对照目的基因可用酶切位点和载体上的酶切位点,选择二者共有的作为备选。
载体上两个酶切位点的距离应有几十bp以上,选实验室常用酶切位点。
5)使用primer5设计目的基因引物,目的产物应包含从启动子到终止子全部碱基。
6)根据选择的酶切位点,查找对应的酶切位点保护碱基,将对应片段添加到设计的引物两端,注意酶切位点的前后顺序。
一般选择三个保护碱基。
7)引物设计完成,送公司合成。
二、目的片段获取1.RNA提取试剂盒:Bioteke高纯总RNA快速提取试剂盒离心柱型(裂解液RL 4°C、漂洗液RW -20°C保存)准备:冰盒、4°C预冷离心机、EP管2套、吸附柱RA 一套操作步骤:1)将1000^1裂解液RL加入细胞中,混合5min。
2)加200山氯仿混合,震荡15s,室温孵育3min。
3)4°C, 12000rpm 离心10min。
4)最上层水相转移至新EP管中(体积约550yl)5)加入1倍体积(550山)70%乙醇,混匀6)全部转移到套收集管的吸附柱RA中,4°C, 10000rpm离心45s7)弃废液,重套收集管,加500山去蛋白液RE,12000rpm离心45s8)弃废液,重套收集管,加700山去漂洗液RW,12000rpm离心60s9)弃废液,重套收集管,加500山去漂洗液RW,12000rpm离心60s10)弃废液,重套收集管,12000rpm空离2min11)吸附柱放入新EP管,加50卩l RNase free water于膜上,室温放置2min12)4C,12000rpm 离心60s13)点样:5yl RNA+ 1山10X buffer,1.5%琼脂糖凝胶电泳,100V, 3min,可见3条亮带。

载体构建质粒构建步骤有哪些?载体构建过程:1、引物设计2、⽬的⽚段选取:RNA提取、RNA反转录、PCR扩增、PCR产物纯化3、双酶切4、连接:T4 DNA ligase连接或者同源重组连接(新贝⽣物:#B101、#B102)5、转化6、菌落PCR7、测序:1)摇菌;2)送样; 3)⽐对;8、菌种保存:菌种⽐对成功,则可保存菌种备⽤。
9、质粒提取:菌种⽐对成功,冻存菌种后,菌液⽤于提取质粒。
⼀、载体构建基本原理分、切、连、转、筛1、分:分离出要克隆的⽬的基因及载体。
2、切:⽤限制性内切酶切割⽬的基因和载体,使其产⽣便于连接的末端。
限制性内切酶:是⼀类能识别双链DNA中特定碱基顺序的核酸⽔解酶。
限制性核酸内切酶根据识别切割特性,催化条件及是否具有修饰酶活性分为三⼤类。
其中Ⅱ型酶能识别双链DNA的特异顺序,并在这个顺序内切割,产⽣特异性DNA⽚段,是DNA 重组技术中常⽤的酶。
Ⅰ型酶:具有修饰和切割功能,⽆固定切割位点Ⅲ型酶与Ⅰ型类似,能识别特异位点,但切割位点在识别位点以外Ⅱ型酶特点:①识别顺序⼀般为4-6个碱基对②识别顺序具有180度的旋转对称性,呈完全的回⽂结构③Ⅱ型酶对双链DNA两条链同时切割,可产⽣两种不同末端:平末端,粘末端平末端:在识别顺序的对称轴上,对DNA同时切割形成平末端,如:SmaI5’-CCC GGG-3’ 5’-CCC GGG-3’3’-GGG CCC-5’ 3’-GGG CCC-5’5′突出粘末端:在识别序列的两侧末端切割DNA双链,于对称轴的5 ′末端切割产⽣5 ′端突出的粘性末端,如:Hind Ⅲ5’―AAGCTT―3’ 5’― A 5’-AGCTT―3’3’―TTCGAA―5’ 3’― TTCGA-5’ A―5’3′突出粘末端:与5′突出粘末端作⽤相反,产⽣3 ′端突出粘末端,如:PstI5’―CTGCAG―3’ 5’―CTGCA-3’ G―3’3’―GACGTC―5’ 3’―G 3’-ACGTC―5’3、连:将切割后的⽬的基因和载体⽤T4 DNA连接酶连接或者同源重组⽅法连接。
构建质粒的步骤构建质粒是一种重要的实验技术,用于在细菌或其他生物体中携带和复制外源DNA。
下面将介绍构建质粒的步骤。
1. 选择质粒载体:首先需要选择适合的质粒载体。
质粒载体是一种环状DNA分子,可以自主复制并在宿主细胞中表达外源基因。
常用的质粒载体有pUC18、pBR322等。
选择适合的质粒载体需要考虑载体大小、复制起点、抗生素抗性基因等因素。
2. 获得外源DNA片段:外源DNA片段可以是来自其他生物体的DNA序列,也可以是人工合成的。
获得外源DNA片段的方法有PCR扩增、限制性内切酶切割等。
3. 切割质粒和外源DNA:使用限制性内切酶将质粒和外源DNA切割成互补的黏性末端。
确保切割后的DNA末端与质粒载体互补,以便进行连接。
4. 连接质粒和外源DNA:通过DNA连接酶将切割后的质粒和外源DNA连接起来,形成重组质粒。
连接时需要考虑连接缓冲液的条件和酶的适宜温度。
5. 转化宿主细胞:将重组质粒导入宿主细胞中,使其能够复制和表达外源基因。
常用的转化方法有热激转化、电击转化等。
转化后,需要在含有抗生素的培养基上筛选出含有质粒的转化子。
6. 确认质粒的构建:通过PCR扩增、限制性内切酶切割或测序等方法,确认质粒是否成功构建,并验证外源基因是否正确插入。
7. 大规模培养质粒:如果质粒构建成功,可以进行大规模培养,以获得足够的质粒量。
培养条件需要根据质粒载体的特性进行调整。
8. 提取质粒:使用质粒提取试剂盒等方法,从大规模培养的细菌中提取质粒。
提取的质粒可以用于进一步的实验研究或应用。
通过以上步骤,就可以成功构建质粒。
构建质粒是分子生物学研究中常用的技术手段,可以用于基因克隆、基因表达、基因敲除等研究中。
同时,构建质粒也是基因工程和生物工程的重要基础。
PCR(多聚酶链式反应)一、实验原理PCR用于扩增位于两端已知序列之间的DNA区段,即通过引物延伸而进行的重复双向DNA合成。
基本原理及过程如下:PCR循环过程中有三种不同的事件发生:(1)模板变性;(2)引物退火;(3)热稳定DNA聚合酶进行DNA合成。
1、变性:加热使模板DNA在高温下(94-95℃)变性,双链间的氢键断裂而形成两条单链,即变性阶段。
2、退火:在体系温度降至37-65℃,模板DNA与引物按碱基配对原则互补结合,使引物与模板链3’端结合,形成部分双链DNA,即退火阶段。
3、延伸:体系反应温度升至中温72℃,耐热DNA聚合酶以单链DNA为模板,在引物的引导下,利用反应混合物中的4种脱氧核苷三磷酸(dNTP),按5’到3’方向复制出互补DNA,即引物的延伸阶段。
上述3步为一个循环,即高温变性、低温退火、中温延伸3个阶段。
从理论上讲,每经过一个循环,样本中的DNA量应该增加一倍,新形成的链又可成为新一轮循环的模板,经过25~30个循环后DNA可扩增106~109倍。
典型的PCR反应体系由如下组分组成:DNA模板、反应缓冲液、dNTP、MgCl2、两条合成的DNA引物、耐热DNA Taq聚合酶。
二、按下列组份配制PCR 反应液TaKaRa LA Taq(5 U/μl)0.5 μl10×LA PCR Buffer II(Mg2+ Plus) 5 μldNTP Mixture(各2.5 mM)8 μl模板DNA(λDNA)* 2.5 ng引物1(10 μM) 2 μl引物2(10 μM) 2 μl灭菌蒸馏水up to 50 μl*【50 μl PCR反应体系中模板DNA 推荐使用量】人基因组DNA 0.1 μg~1 μg大肠杆菌基因组DNA 10 ng~100 ngλDNA 0.5 ng~5 ng质粒DNA 0.1 ng~10 ng三、PCR 反应条件。
以λDNA 为模板,扩增 1 kbp、35 kbp 的DNA片段的PCR 反应条件如下:【1 kbp】95℃ 5 min.95℃30 sec.55℃30 sec. 35 Cycles72℃ 1 min.72℃10 min.【35 kbp】94℃ 5 min.98℃10 sec.68℃15 min. 35 Cycles72℃10 min.常用循环:95℃ 5 min.95℃45 sec.55℃45 sec. 35 Cycles72℃ 2 min.72℃10 min.四、可能出现的问题与解决方案:1、假阴性,不出现扩增条带PCR反应的关键环节有①模板核酸的制备,②引物的质量与特异性,③酶的质量,④PCR循环条件。
(一)细菌培养物的生长从琼脂平板上挑取一个单菌落,接种到培养物中(有含有行当抗生素的液体培养基中生长),然后从中纯化质粒,质粒的提纯几乎总是如此。
现在使用的许多质粒载体(如pUC系列)都能复制到很高的拷贝数,惟致只要将培养物放在标准LB 培养基中生长到对数晚期,就可以大量提纯质粒。
此时,不必造反性地扩增质粒DNA。
然而,较长一代的载体(如pBR322)由于不能如此自由地复制,所以需要在得到部分生长的细菌培养物中加入氯霉素继续培养若干小时,以便对质粒进行性扩增。
氯霉素可抑制宿主的蛋白质合成,结果阻止了细菌染色体的复制,然而,松弛型质粒仍可继续复制,在若干小时内,其拷贝数持续递增。
这样,像pBR322-类的质粒,从经氯霉素处理和未经处理的培养物中提取质粒的产量迥然不同,前者大为增高。
多年来,加入足以完全抑制蛋白质合成的氯霉素μg/ml)已成为标准的操作、用该方法提取的质粒DNA量,对于分子克隆中几乎所有想象到的工作任务。
(二)细菌的收获和裂解细菌的收获可通过离心来进行,而细菌的裂解则可以采用多种方法中的任意一种,这些方法包括用非离子型或离子型去污剂、有机溶剂或碱进行处理及用加热处理等。
选择哪一种方法取决于3个因素:质粒的大小、小肠杆菌菌株及裂解后用于纯化质粒DNA的技术。
尽管针对质粒和宿主的每一种组合分别提出精确的裂解条件不切实际,但仍可据下述一般准则来选择适当方法,以取得满意的结果。
1)大质粒(大于15kb)容易受损,故应采用漫和裂解法从细胞中释放出来。
将细菌悬于蔗糖等渗溶液中,然后用溶菌酶和EDTA进生处理,破坏细胞壁和细胞外膜,再加入SDS一类去污剂溶解球形体。
这种方法最大限度地减小了从具有正压的细菌内部把质粒释放出来所需要的作用力。
2)可用更剧烈的方法来分离小质粒。
在加入EDTA后,有时还在加入溶菌酶后让细菌暴露于去污剂,通过煮沸或碱处理使之裂解。
这些处理可破坏碱基配对,故可使宿主的线状染色体DNA变性,但闭环质粒DNA链由于处于拓扑缠绕状态而不能彼此分开。
质粒载体构建原理
质粒载体构建原理是通过将目标基因插入质粒中,然后将质粒转化到适当的宿主细胞中,使质粒在宿主细胞中复制和表达目标基因。
质粒载体通常由数千到数百万碱基对组成的双链DNA构成,具有自主复制和表达功能。
构建质粒载体的过程主要分为以下几个步骤:
1. 选择合适的质粒:根据实验需要选择合适的质粒,常用的质粒包括pUC18和pBR322等。
2. 提取质粒DNA:通过DNA提取方法从大肠杆菌等质粒存在的细菌中提取质粒DNA。
3. 制备目标基因DNA:从适当的源中提取目标基因的DNA
序列,常用的方法有PCR扩增、酶切和合成等。
4. 质粒和目标基因DNA连接:通过DNA连接酶将质粒DNA 和目标基因DNA连接起来,形成重组质粒。
5. 转化宿主细胞:将重组质粒转化到适当的宿主细胞中,如大肠杆菌等。
6. 筛选正常质粒:通过添加适当的抗生素等筛选条件,筛选出携带目标基因的正常质粒。
7. 质粒扩增:将筛选得到的正常重组质粒进行扩增,得到足够量的质粒。
8. 表达目标基因:将扩增得到的质粒转化到目标宿主细胞中,通过细胞内转录和翻译过程,使得目标基因得以表达。
通过以上步骤,可以成功构建质粒载体,将目标基因插入其中,并实现在宿主细胞中的表达。
这为基因工程研究和生物技术应用提供了重要的平台。