鲁教版初中化学探秘水世界知识点归纳
- 格式:doc
- 大小:61.50 KB
- 文档页数:6

第二单元探秘水世界一、爱护水资源1. 淡水资源有限,地球上水总储量约为1.39×1018 m3,地球表面约71%被水覆盖,淡水只约占全球水储量的2.53%。
2. 爱护水资源的措施爱护水资源有两方面,一方面要节约用水,另一方面要防治水体污染。
(1)节约用水①生活上:a.使用节水器具;b.一水多用,如用淘米水浇花(合理即可)。
②农业上:改大水漫灌为滴灌、喷灌。
③工业上:循环使用。
(1)水体污染及防治措施一、水的净化1. 水的净化方法天然水→加絮凝剂沉淀→过滤→加活性炭→消毒杀菌→自来水【特别提醒】①自然界的水为混合物;②净化程度由高到低的顺序为蒸馏→吸附→过滤→沉淀;③上述净水过程中,杀菌消毒属于化学变化,其他属于物理变化。
3.硬水和软水1. 实验原理:通过生成物的元素组成判断反应物的元素组成。
2. 反应原理:[水很难解离,导电能力弱,常加入强电解质(如烧碱或硫酸)增加其导电能力]3. 实验装置:4. 实验现象:(1)两个电极上均有气泡产生,和电源负极相连的试管内产生气泡速度较快。
(2)反应一段时间后,停止通电,和电源负极相连试管内产生气体体积大约是和电源正极相连试管内产生气体体积的2倍。
5. 气体的检验:(1)正极:用带火星的木条检验,带火星的木条复燃,说明是氧气。
(2)负极:点燃,气体燃烧,产生淡蓝色火焰,说明是氢气。
6. 实验结论:(1)水是由氢元素和氧元素组成的化合物。
(2)水分子是由氢原子和氧原子构成的。
7. 实验拓展(1)验证了化学变化中分子可分而原子不可再分。
(2)此实验证明化学反应的实质是分子分裂成原子,原子重新结合成新的分子。
(3)通过产生氢气和氧气的体积比2:1,我们可计算出产生氢气和氧气的质量比约为1:8。
四、化合价1. 化合价的表示方法:在元素符号的正上方位置标出化合价,用“+n”或“-n”表示。
当n为1时,不能省略如+1Na,-1Cl。
2. 化合价规律①单质中元素的化合价为零。


鲁教版九上化学第二单元探秘水世界第一节运动的水分子一、微粒观点1、物质都是由肉眼看不见的、极其微小的微粒构成的2、构成物质的微粒在不断的运动3、微粒之间有空隙【知识解读】1、构成物质的基本微粒是指分子、原子、离子,它们的体积质量都很小,肉眼看不见。
灰尘满天,就不能说微粒在不断运动,原因是灰尘肉眼看得见,是固体小颗粒,不是微粒。
2、分子间的间隔与温度与压强有关:温度越高分子间的间隔越大:如热胀冷缩;压强越大分子间的间隔越小,如:空气加压压缩,体积减小。
3、水的三态变化就是由于水分子的运动导致了水的状态变化。
水分子获得能量是,运动加快,分子间的间隔增大,水由液态变成了气态(或由固态变为了液态);失去能量时,运动减慢,分子间的间隔减小,水由气态又变回了液态(或由液态变为固态)二、纯净物和混合物纯净物:由单一物质组成的物质混合物:由由两种或两种以上的物质组成的物质【知识解读】1、从微观角度把握概念:纯净物里只有一种分子,混合物是由两种或两种以上的分子构成的2、混合物与纯净物的判断:①自然界中的物质、食品饮料、溶液、合金都是混合物;纯净物一般都是按化学名称命名,即根据名称可知道其组成。
②纯净的空气是混合物,冰水混合物是纯净物。
③自然界中的水是混合物,只有说“水”“纯净水”“蒸馏水”时才是纯净物。
三、水的净化方法(重点、难点)水的净化方法有:沉降(除去水中颗粒较大的不溶性杂质)、吸附(除去悬浮在水中颗粒较小的杂质)、过滤(除去水中不溶性固体杂质)、蒸馏(除去水中可溶性杂质,净化程度最高---得到的是蒸馏水)、消毒杀菌。
【知识解读】1、沉降包括静置沉降和吸附沉降。
净水过程中先静置自然沉降后,再加明矾进行化学沉降。
2、明矾:吸附水中的悬浮的杂质而沉降;活性炭:吸附水中细小的杂质。
氯气、漂白粉:消毒杀菌3、吸附、沉降、过滤只能除去不溶性固体杂质,使浑浊的水变清澈,但是不能除去溶于水的杂质;要除去水中可溶性杂质,要用蒸馏法。
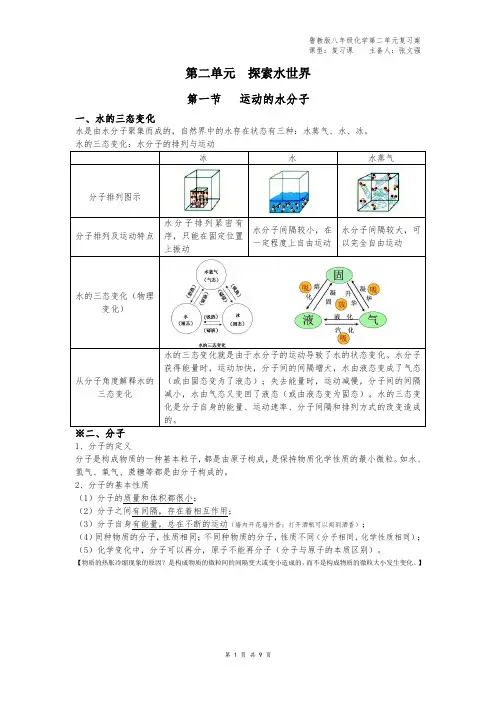
第二单元探索水世界第一节运动的水分子一、水的三态变化水是由水分子聚集而成的,自然界中的水存在状态有三种:水蒸气、水、冰。
冰水水蒸气分子排列图示分子排列及运动特点水分子排列紧密有序,只能在固定位置上振动水分子间隔较小,在一定程度上自由运动水分子间隔较大,可以完全自由运动水的三态变化(物理变化)从分子角度解释水的三态变化水的三态变化就是由于水分子的运动导致了水的状态变化。
水分子获得能量时,运动加快,分子间的间隔增大,水由液态变成了气态(或由固态变为了液态);失去能量时,运动减慢,分子间的间隔减小,水由气态又变回了液态(或由液态变为固态)。
水的三态变化是分子自身的能量、运动速率、分子间隔和排列方式的改变造成的。
1、分子的定义分子是构成物质的一种基本粒子,都是由原子构成,是保持物质化学性质的最小微粒。
如水、氢气、氧气、蔗糖等都是由分子构成的。
2、分子的基本性质(1)分子的质量和体积都很小;(2)分子之间有间隔,存在着相互作用;(3)分子自身有能量,总在不断的运动(墙内开花墙外香;打开酒瓶可以闻到酒香);(4)同种物质的分子,性质相同;不同种物质的分子,性质不同(分子相同,化学性质相同);(5)化学变化中,分子可以再分,原子不能再分子(分子与原子的本质区别)。
【物质的热胀冷缩现象的原因?是构成物质的微粒间的间隔变大或变小造成的,而不是构成物质的微粒大小发生变化。
】⎪⎪⎪⎩⎪⎪⎪⎨⎧⎪⎪⎩⎪⎪⎨⎧68%18.3%11.8%1.2%%5.2%5.97冰深层地下水浅层地下水河流湖泊等淡水海洋和咸水湖中的水天然水第二节 自然界中的水一、水的天然循环水的天然循环是通过水的三态变化实现的,是自动完成的循环过程。
太阳光为水分子提供能量,使其运动加快,达到一定程度后,些水分子便克服了分子之间的相互作用,变成水蒸气,扩散到空气中,在高空中遇冷凝结成云,再遇冷转变成雨或雪降落到地面。
大自然通过水分子的运动既实现了水的自身净化,又完成了水资源的重新分配。



第二单元《探秘水世界》单元总结二、专题综合讲解1.分子和原子分子 原子概念 保持物质化学性质的最小粒子 化学反应中的最小粒子构成 由原子构成 由质子、中子、核外电子构成 根本 区别在化学变化中可分 在化学反应中不可分相同处 ①都很小;②都在不断运动;③微粒之间都有间隔;④同种微粒性质相同,不同种微粒性质不同;⑤都能直接构成物质联系 化学反应中:分子可分成原子,原子可结合成分子地球上淡水资源并不充足,一些国家和地区淡水资源紧缺,因此要节约用水,同时对水净化,水的净化方法一般有吸附、过滤、杀菌、蒸馏等方法,不同的净化方法除去水中的杂质不同,综合运用几种净水方法,净化效果会更好。
3.溶液的配制与溶质质量分数的计算⑴已知溶质和溶剂的量,求溶质质量分数。
注意:“量”指质量,如果已知或所求的是其他量,如体积等,必须换算成质量。
⑵计算配制一定量的溶质质量分数一定的溶液,所需溶质和溶剂的量。
计算时注意:①溶液的质量=溶质的质量+溶剂的质量。
②质量、密度、体积之间的换算⑶溶液的稀释和浓缩的计算,注意抓住在稀释和浓缩过程中,溶质的质量在变化前后的关系。
⑷配制一定质量分数的溶液的操作步骤:①计算;②称量和量取;③溶解;④装瓶。
水 水分子的运动 水的组成 水的构成→水分子 构成→原子 基本性质:质量、体积小;不停运动;分子之间有间隔 定义 结构 水的三态变化 水的天然循环 质子 中子水的状态发生改变,是物理变化 原子核 核外电子 水的人工净化→沉淀、吸附、过滤、蒸馏、除菌 电解水 氢气燃烧 电解水实验:产生气体检验方法 结论:证明水的组成、化学变化的实质 反应的文字表达式:水−−→−通电氢气+氧气(分解反应) 物质在水中的溶解→溶液 (常伴随能量变化) 组成:溶质和溶剂 性质:均一、稳定 溶液组成的表示→溶质质量分数 一定溶质质量分数溶液的配制。

鲁教版初中化学探秘水世界知识点归纳第二单元探秘水世界第一节运动的水分子一、水的三态变化:1、三态变化的实质:水的三态变化就是由于水分子的运动导致了水的状态变化。
水分子获得能量时,运动加快,分子间的间隔增大,水由液态变成了气态(或由固态变为了液态);失去能量时,运动减慢,分子间的间隔减小,水由气态又变回了液态(或由液态变为固态)2、现象解释:能量—运动—间隔—状态二、分子:1、定义:保持物质化学性质的最小微粒。
2、性质:(1)分子的体积、质量小;(2)分子在不断的运动;(3)分子间存在间隔;(4)同种物质的分子,性质相同;不同种物质的分子,性质不同;(5)化学变化中,分子可以再分,原子不能再分子三、水的净化方法1、水的净化方法过程:①沉降(除去水中颗粒较大的不溶性杂质),(明矾:絮凝剂,促进悬浮物质的沉降);②过滤(除去水中不溶性固体杂质);③吸附(除去水中的有色或有气味的物质)、(活性炭:表面疏松多孔);④蒸馏(除去水中可溶性杂质,净化程度最高---得到的是蒸馏水);⑤消毒杀菌。
(氯气)2、分离物质的方法:①过滤:分离不溶性固体和液体;②蒸发:分离可溶性固体和液体;③蒸馏:分离沸点不同的液体四、硬水和软水:(1)硬水:含有可溶性钙、镁化合物较多的水软水:含有可溶性钙、镁化合物较少的水(2)判断方法:加入肥皂水搅拌,产生泡沫多的为软水,反之为硬水。
(3)转化方法:煮沸、蒸馏等(4)硬水的危害:用硬水洗涤衣物既浪费肥皂,又不易洗净,时间长还会使衣物变硬。
锅炉长期用硬水,易形成水垢,不仅浪费燃料,严重者可引起爆炸。
长期饮用硬水有害身体健康。
水分子氧原子氢原子氧分子氢分子分解结合三、纯净物和混合物纯净物:由单一物质组成的物质混合物:由由两种或两种以上的物质组成的物质第二节水分子的变化一、水的分解—电解水1、实验装置如图所示:2、实验现象:通电后,两电极上都有大量的气泡产生,一段时间后,正极所产生的气体与负极所产生的气体体积之比约为1:2。

新鲁教版初三上册化学第二单元探秘水世界知识点总结水(H₂O)是由氢、氧两种元素组成的无机物,在常温常压下为无色无味的透明液体,本单元为大家分享第二单元探秘水世界知识点,希望对大家学习第二单元有帮助!第一节运动的水分子1、水分子的运动导致了水的状态的变化。
水在发生三态变化时,水分子的数目和大小不会变化,变化的只是水分子之间的距离和排列方式。
属于物理变化。
2、当水分子获得能量,运动加快,分子间隔变大,水由液态变为气态。
所以这个过程吸收热量。
3、当水分子失去能量,运动减慢,分子间隔变小,水由液变为固态。
所以这个过程是释放热量。
点击了解详细知识点大于大于大于大于大于九年级新鲁教版化学上册运动的水分子知识点第二节水分子的变化1、实质:分子间间隙和排列方式改变,分子数目和大小不变2、间隙:固→液→气一般间隙由小到大(水例外)3、水分子运动与温度有关,温度越高,运动越快点击了解详细知识点大于大于大于大于大于新鲁教版九年级化学上册水分子的变化知识点第三节原子的构成1.构成原子的粒子有三种:质子、中子、电子。
但并不是所有的原子都是由这三种粒子构成的。
如有一种氢原子中只有质子和电子,没有中子。
2.在原子中,原子核所带的正电荷数(核电荷数)就是质子所带的电荷数(中子不带电),而每个质子带1 个单位正电荷,因此,核电荷数=质子数,由于原子核内质于数与核外电子数相等,所以在原子中核电荷数=质子数=核外电子数。
点击了解详细知识点大于大于大于大于大于九年级新鲁教版化学上册原子的构成知识点第四节元素1、明确元素符号定义:表示元素的拉丁文符号,是国际通用的。
2、了解元素符号表示的意义:元素符号表示一种元素,还表示这种元素的一个原子。
3、注意元素符号的书写:用元素的拉丁文名称的第一个大写字母表示元素,当几种元素的拉丁文名称的第一个字母相同时,就用附加元素拉丁文名称的另一个小写字母的方法来表示。
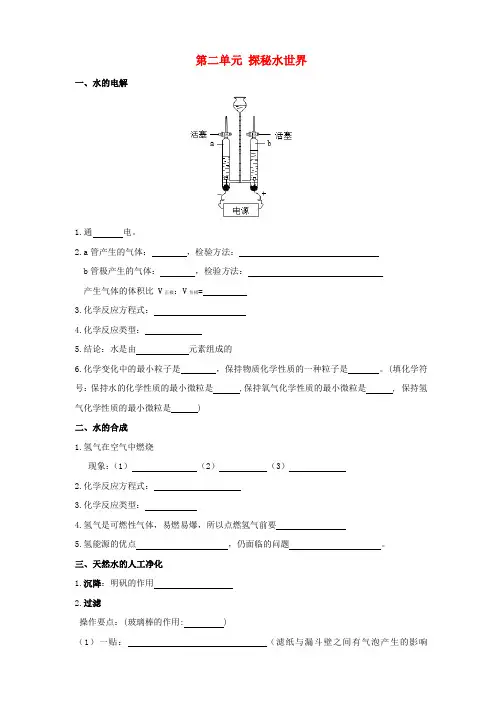
第二单元探秘水世界一、水的电解1.通电。
2.a管产生的气体:,检验方法:b管极产生的气体:,检验方法:产生气体的体积比 V正极:V负极=3.化学反应方程式:4.化学反应类型:5.结论:水是由元素组成的6.化学变化中的最小粒子是,保持物质化学性质的一种粒子是。
(填化学符号:保持水的化学性质的最小微粒是 ,保持氧气化学性质的最小微粒是 , 保持氢气化学性质的最小微粒是 )二、水的合成1.氢气在空气中燃烧现象:(1)(2)(3)2.化学反应方程式:3.化学反应类型:4.氢气是可燃性气体,易燃易爆,所以点燃氢气前要5.氢能源的优点,仍面临的问题。
三、天然水的人工净化1.沉降:明矾的作用2.过滤操作要点:(玻璃棒的作用: )(1)一贴:(滤纸与漏斗壁之间有气泡产生的影响是)(2)二低:①②(3)三靠:①②③过滤后滤液仍浑浊的原因:(1)(2)(3)3.:利用活性炭、木炭除去,属于变化。
4.蒸馏:利用的原理:不同,属于变化。
四、原子元素1.原子是由居于中心的带正电的和核外带负电的构成的,原子核由和构成,一个原子只有一个原子核,氢原子核只含质子在原子核中:核电荷数= =核外电子数; 相对原子质量= + (相对原子质量单位为1)原子质量主要集中在原子核上(电子质量很小,可以忽略不计)2.具有相同的原子称为一种元素.稀有气体元素最外层电子数一般为8(He为2)的电子结构,通常不容易得失电子,化学性质 ,也称惰性气体;金属元素最外层电子数目一般 ,在化学反应中最外层电子,形成离子;非金属元素最外层电子数目一般 ,在化学反应中电子,形成离子.3.地壳元素含量(质量分数)前五位4.元素符号及意义: H ①表示②表示一个2H 表示 (只有微观意义)5.物质由物质组成由物质组成单质:由元素组成的纯净物. 化合物:由元素组成的纯净物.6.化学性质:物质通过表现出来的性质.如:可燃性. 物理性质:物质不需要发生化学变化就表现出来的性质.如:颜色、状态、气味、密度等.五、巩固练习1.关于水的说法正确的是( )A.水蒸气遇冷凝结成水,说明水分子体积变小 B.生活中常用肥皂水将硬水转化成软水C.通过电解水实验说明水是由氢氧两种元素组成的D.天然水经过自来水厂净化后得到的是纯净物2.下列关于“酒精温度计遇热读数上升”的微观解释正确的是A.分子质量增大 B.分子体积扩大 C.分子间隔变大 D.分子个数增多3.常见的净水操作有①过滤②加明矾吸附③蒸馏④消毒杀菌,应选用的净化顺序为( ) A.①②③④ B.②④①③ C.②①④ D.①③④4.自然界的水都不是纯净水,下列有关水的净化的说法不正确的是( )A.过滤不能使硬水转化为软水 B.净水时活性炭起吸附作用C.蒸馏可将海水淡化 D.电解水是一种常用的净水方法5.如图是电解水的简易实验装置。
第一节运动的水分子一、水的三态变化问题与猜想:湿衣服能晾干是因为其中的液态水变成水蒸气到了空气中,请你猜想并想象,湿衣服上的水分子是怎样到了空气中?封闭在针筒内的少量水煮沸变成水蒸气,体积变大,猜想在这一过程中是什么原因导致水蒸气的体积变大?1、水的三态变化把在封闭的针管中少量的水煮沸,液态的水煮沸会变成水蒸气,体积明显变大,这是为什么呢?固态水分子:紧密有序排列、不能自由移动(不是不运动)液态水分子:间隔小、一定程度上自由运动气态水分子:间隔较大、完全自由运动2、三态变化伴随能量变化水分子的大小、数目不变;水分子的排列方式、间隔改变。
2、分子:构成物质的一种基本粒子,都是由原子构成的。
3、分子的性质①分子很小②分子在不停地运动③分子间有一定的间隔④同种物质的分子性质相同,不同种物质的分子性质不同二、水的天然循环1、我们的水资源2、三、天然水的人工净化水的净化方法有:沉降(除去水中颗粒较大的不溶性杂质)、吸附(除去悬浮在水中颗粒较小的杂质)、过滤(除去水中不溶性固体杂质)、蒸馏(除去水中可溶性杂质,净化程度最高---得到的是蒸馏水)、消毒杀菌。
1、沉降:大颗粒的难溶性杂质在重力的作用下下沉,沉到底部。
2、过滤:(1)过滤器的制作(2)过滤装置及注意事项(3)实验分析:过滤后的滤液仍然浑浊,可能的原因有哪些?液面高于滤纸边缘;滤纸破了;盛接滤液的烧杯不干净等。
3、吸附:活性炭吸附剂,可以吸附一些有颜色、有气味的杂质。
4、蒸馏:5、自来水厂净水6、硬水:含有较多可溶性钙,镁矿物质的天然水软水:不含或含较少钙,镁矿物质的水区分:在等量的硬水和软水中,分别滴加等量的相同肥皂出现较多泡沫的是软水,出现泡沫较少或没有泡沫转化:设法消除或减少硬水中的钙,镁矿物质,在生活中在实验室常用蒸馏法,工业上用离子交换法或药剂软化法。
危害:用硬水洗涤衣服,既浪费肥皂又洗不净衣服;锅炉长期用硬水,易形成水垢,不仅浪费燃料,严重的还可以引起锅炉爆炸(水垢可有稀盐酸除去:CaCO3+2HCl=CaCl2+H2O+CO2↑)。
第二单元探秘水世界单元知识体系架构第二单元探秘水世界第一节运动的水分子(第1课时)本节知识体系一、知识点解读与基础训练知识点一水的三态变化1.水分子的获得(失去)能量,影响分子运动快慢,分子间的间隔增大(减小),导致了水的三态变化。
2.气体分子之间的间隔最大,固体、液体分子间的间隔相对较小。
3.水分子的三态变化中,水分子本身没有变,变化的是分子间的距离和排列方式。
【易错易混点拨】1.分子在发生物理变化时,分子本身没有变(体积、质量),变化的是分子间的间隔距离和排列方式。
2.物质的三态变化时分子本身不变,属于物理变化。
【基础训练】1.酒精擦在手臂上,感觉十分凉爽,这是因为()A.酒精由汗毛孔进入了体内B.酒精吸收了体内的水分C.酒精与皮肤发生化学变化D.酒精吸收热量不断运动,由液态变成气态挥发到空气知识点二分子的基本性质1.分子是构成物质的一种基本粒子,它由原子构成。
2.通过分析水分子的变化,归纳分子的基本性质。
【易错易混点拨】1.通过一滴水就有约1021个水分子,体会水分子的小。
2.通过10毫升水和10毫升酒精混合后总体积小于20毫升,体会分子间有间隔。
3.物体的“热胀冷缩”是因为构成物质的分子间的间隔变大或变小,而不是分子的大小发生了改变。
【基础训练】2.“贵州茅台酒,开坛十里香”这句诗说明了()A.分子在不断地运动B.分子间有一定间隔C.分子有一定的质量D.分子是最小粒子3.生活中的下列现象,可用分子的知识加以解释,其中正确的是()A.热胀冷缩是因为分子大小随温度而改变B.蔗糖溶解是因为分子很小C.墙内开花墙外香是因为分子在不断运动D.气体易被压缩是因为气体分子间隔很小4.一定温度下,一定量的某种单质气体受压后体积缩小的原因是( )A.分子个数减少B.分子体积减小C.分子之间的间隔减小D.构成分子的原子个数减少知识点三水的天然循环1.水的循环过程。
2.水循环的四个环节:蒸发、水汽运输、凝结降水、径流。
第二单元探秘水世界
第一节运动的水分子
一、水的三态变化:
1、三态变化的实质:水的三态变化就是由于水分子的运动导致了水的状态变化。
水分子获得能量时,运动加快,分子间的间隔增大,水由液态变成了气态(或由固态变为了液态);失去能量时,运动减慢,分子间的间隔减小,水由气态又变回了液态(或由液态变为固态)
2、现象解释:能量—运动—间隔—状态
二、分子:
1、定义:保持物质化学性质的最小微粒。
2、性质:(1)分子的体积、质量小;(2)分子在不断的运动;(3)分子间存在间隔;(4)同种物质的分子,性质相同;不同种物质的分子,性质不同;(5)化学变化中,分子可以再分,原子不能再分子
三、水的净化方法
1、水的净化方法过程:
①沉降(除去水中颗粒较大的不溶性杂质),(明矾:絮凝剂,促进悬浮物质的沉降);
②过滤(除去水中不溶性固体杂质);③吸附(除去水中的有色或有气味的物质)、(活性炭:表面疏松多孔);④蒸馏(除去水中可溶性杂质,净化程度最高---得到的是蒸馏水);⑤消毒杀菌。
(氯气)
2、分离物质的方法:
①过滤:分离不溶性固体和液体;②蒸发:分离可溶性固体和液体;③蒸馏:分离沸点不同的液体
四、硬水和软水:
(1)硬水:含有可溶性钙、镁化合物较多的水软水:含有可溶性钙、镁化合物较少的水
(2)判断方法:加入肥皂水搅拌,产生泡沫多的为软水,反之为硬水。
(3)转化方法:煮沸、蒸馏等
(4)硬水的危害:用硬水洗涤衣物既浪费肥皂,又不易洗净,时间长还会使衣物变硬。
锅炉长期用硬水,易形成水垢,不仅浪费燃料,严重者可引起爆炸。
长期饮用硬水有害身体健康。
水分子 氧原子 氢原子
氧分子 氢分子 分解 结合
三、纯净物和混合物
纯净物:由单一物质组成的物质混合物:由由两种或两种以上的物质组成的物质
第二节水分子的变化
一、水的分解—电解水
1、实验装置如图所示:
2、实验现象:通电后,两电极上都有大量的气泡产生,一段时间后,正极所产生的气体与负极所产生的气体体积之比约为1:2。
3、气体检验:将带火星的木条伸入到正极产生的气体中,带火星的木条复燃,证明正极产生的气体是氧气;将燃着的木条靠近负极产生的气体,负极产生的气体能够燃烧,火焰呈淡蓝色,且罩在火焰上方的干而冷的烧杯内壁有水珠出现,证明负极生成的气体是氢气。
4、实验结论:
①水在通电的条件下分解成氢气和氧气。
化学反应为:2H 2O 通电2H 2↑+O 2↑
②水是由氢元素和氧元素组成的。
5、反应的微观过程: 由电解水微观过程可知:
①化学反应的实质是:分子分解成原子,原子又重新结合成新
的分子。
②分子与原子的关系:分子是由原子构成的,即分子可以分解成原子,原子可以结合成分子。
③在化学反应中,分子可以分解成原子,而原子不可再分。
④化学反应前后,发生改变的是分子的种类;化学反应前后,元素的种类,原子的种类、数目、质量都不变。
6、注意事项:
①、为了增强水的导电性,常在水中加入少量的氢氧化钠溶液或稀硫酸。
②、现象要点:“正氧负氢”—争养父亲;“氢二氧一”—V氢气:V氧气=2:1。
描述体积比时要注意比例顺序。
③、在实验中,氢气与氧气的体积比略大于2:1。
主要原因是:a.由于氢气与氧气在水中的溶解度不同,在相同条件下,氧气在水中的溶解度比氢气大;b.在电解水过程中会有副反应发生,消耗了氧气,使氧气的体积比理论值低。
二、水的合成—氢气燃烧
1、氢气燃烧的化学方程式:2H2+O点燃2H2O
2、现象:纯净的氢气在空气中燃烧,产生淡蓝色的火焰,释放出大量的热量。
在火焰上方罩一个干而冷的烧杯,烧杯内壁凝结有水雾。
【知识解读】
1、氢气的物理性质:通常状况下,氢气是无色、无味的气体,难溶于水,在标准状况下,氢气密度为O.0899g/L,其质量约是同体积的空气质量的2/29,是最轻的气体。
2、氢气的化学性质:
①可燃性:纯净的氢气能在空气中安静燃烧,但是氢气与空气混合点燃易发生
爆炸。
所以在点燃氢气之前要检验氢气的纯度
..............。
“验纯”的方法:如图所示,收集一试管氢气,
用拇指堵住试管口,使试管口稍向下倾斜,移近火焰,移开拇指点火。
若听
到轻微的“噗”声,说明氢气已纯净。
若听到尖锐的爆鸣声,则表明氢气不纯。
②、还原性:氢气夺取某些金属氧化物(如CuO、Fe2O3等)中的氧元素,把金属氧化物还原成金属单质。
3、氢气是二十一世纪最理想的能源:①氢气燃烧释放的热量多;②燃烧产物是水不会污染环境;
③可以用水为原料制取氢气,原料易得且可以循环利用。
三、化合反应和分解反应
化合反应分解反应
概念由两种或两种以上的
物质生成另一种物质由一种物质生成两种或两种以上其他物质的反
第三节原子的构成 一.离子 1、定义:离子:带电的
原子(或原子团) 2、分类阳离子:带正电核电荷数=质子数>电子数
离子
阴离子:带负电核电荷数=质子数<电子数
3、离子的形成如图
4.离子符号的意义
4、离子符号的书写:离子所带的电荷标在元素符号(原子团符号)的右上方,且电荷数在前,电性在后。
如果离子只带一个单位的电荷时,电荷数1省略不写。
如,阳离子:Na +、Mg 2+、Al 3+、NH 4+;阴离子:Cl -、SO 42-等。
5、原子团:在化学反应里,作为一个整体参加反应,好像一个原子一样,这样的原子集团叫做原子团。
常见的原子团:SO 42-、CO 32-、NO 3-、OH -、MnO 4-、MnO 42-、ClO 3-、PO 43-、HCO 3-、NH 4+
6、原子与离子可以相互转化:
7、分子、原子、离子联系:
四、 分子:液态、气态非金属单质,酸性氧化物(非金属氧化物),无氧酸,有机物
物质的构成: 原子:金属单质、固态非金属单质、稀有气体
离子:碱性氧化物(金属氧化物)、含氧酸、碱、盐
五、相对原子质量(符号:Ar ,单位:无、或为1)
1.
2.相对原子质量≈质子数+中子
的反应
应 特点 多变一 一变多
形式 A+B →AB
AB →A+B
第四节元素
一、元素与元素符号:
1、元素:具有相同质子数的同一类原子的总称。
目前发现的化学元素有一百余种。
2、地壳中元素排行:氧、硅、铝、铁、钙、钠、钾、镁、氢
3、元素符号的书写:第一个字母大写,第二个字母小写
4、分类:金属元素:“钅”字旁,汞除外
固态非金属元素:“石”字旁
元素非金属元素:液态非金属元素:“氵”字旁
气态非金属元素:“气”字头
稀有气体元素:氦、氖、氩、氪、氙、氡
5、元素符号的意义:
(1)宏观意义:①表示一种元素:H—表示氢元素,Fe—表示铁元素
②如果该元素的单质是由原子构成的,则元素符号还可以表示由该元素组成的单质:
Fe—表示单质铁,但是H就不能表示氢气,因为氢气不是由原子构成而是由分子构成的。
(2)微观意义:表示该元素的原子:2H—表示两个氢原子,Fe—表示一个铁原子6、元素是个宏观概念,只讲种类不讲个数,只能组
成物质,而不能构成分子、原子,在化学变化中,元
素的种类和质量都不变;分子、原子是微观概念,既
有种类也有个数。
二、元素周期表简介
1.元素周期律是由俄国化学家门捷列夫发现的,并发明了元素周期表。
2.元素周期表的结构:共有7个横行,18个纵行。
每
一个横行叫一个周期(最外层电子数由1-8);每一个纵行叫一个族(最外层电子数目相等)
3.在原子中:原子序数=核电荷数=质子数=核外电子数
4.在元素周期表中,一种元素占一格,其内容如图所示:
三、单质与化合物
1.单质:由一种元素组成的纯净物。
2.化合物:由两种或两种以上的元素组成的纯净物。
单质、化合物都是纯净物,定义中不能少“纯净物”。
例如:“由一种元素组成的物质是单质”这种说法就是错误的。
3、物质的分类。