同位素丰度表
- 格式:doc
- 大小:219.50 KB
- 文档页数:7



同位素测定报告#12732.05“PMU”型铜粉批号#3/05-07由TAG GIREDMET抽样。
原子分率的测定使用了火花源质谱分析法。
应用了日本电子公司(日本)制造的JMS-01-BM2双聚焦质谱分析仪。
高分辨率质谱是在Ilford-Q板上摄取的。
Joyce Loebl(英国)的MDM6测微密度计和NOVA 4(美国)在线微型计算机被用于识别质谱线。
产生量估算由原版的MS&GC实验室软件计算得出。
同位素丰度测量的相对标准偏差为0.01-0.05。
稀有气体和超铀元素没有制进表格中,因为它们的浓度低于百万分之0.001的检测极限。
结果用原子百分比表示“PMU”型铜粉的化学成分证书批号#3/05-07净重 199,785kg装于14个箱子中的1392个玻璃安瓿实验室MS&GC Lab任何对于此样本的参考均要引用以上的名称和号码。
铜粉中杂质(镁、铝、钛、铁、镍、钼、钶、锑)的总含量不超过重量的0.002%。
铜粉的纯度级别为99.998%。
此数据由100%铜粉和杂质总量的差额计算得出。
杂质列表与TU 1793-001-56993504-2004相一致。
铜粉在放射性方面是安全的。
铜粉的总放射性不超过1.10-11 Ci/g。
样品由TAG Giredmet抽样。
抽样程序报告始于2005年5月16日。
箱子由TAG Giredmet “GAC-68”铅垂探测。
铜粉中杂质含量与检测技术列于报告#12732.05中(请翻页)。
杂质检测报告#12732.05球状铜粉批号#3/05-07样品由TAG GIREDMET抽样。
总杂质分析采用火花源质谱分析法。
应用了日本电子公司(日本)制造的JMS-01-BM2双聚焦质谱分析仪。
高分辨率质谱是在Ilford-Q板上摄取的。
Joyce Loebl(英国)的MDM6测微密度计和NOVA 4(美国)在线微型计算机被用于识别质谱线。
产生量估算由原版的MS&GC 实验室软件计算得出。

同位素科技名词定义中文名称:同位素英文名称:isotope定义1:具有相同原子序数(即质子数相同,因而在元素周期表中的位置相同),但质量数不同,亦即中子数不同的一组核素。
所属学科:电力(一级学科) ;核电(二级学科)定义2:中子数不同的同一种元素的一种原子形式,包括稳定同位素和放射性同位素。
所属学科:生态学(一级学科) ;全球生态学(二级学科)本内容由全国科学技术名词审定委员会审定公布百科名片氕与氘互为同位素具有相同质子数,不同中子数(或不同质量数)同一元素的不同核素互为同位素(Isotopes)。
目录[隐藏]定义概述同位素列表同位素和其他核技术的开发应用[编辑本段]定义以上定义中的原子是广义的概念,指微观粒子。
例如氢有三种同位素,H氕、D氘(又叫重氢)、T氚(又叫超重氢);碳有多种同位素,例如12C(12为上标,下同)、14C等。
在19世纪末先发现了放射性同位素,随后又发现了天然存在的稳定同位素,并测定了同位素的丰度。
大多数天然元素都存在几种稳定的同位素。
同种元素的各种同位素质量不同,但化学性质几乎相同。
许多同位素有重要的用途,例如12C是作为确定原子量标准的原子;两种H 原子是制造氢弹的材料;235U是制造原子弹的材料和核反应堆的原料。
同位素示踪法广泛应用于科学研究、工农业生产和医疗技术方面,例如用O标记化合物确证了酯化反应的历程,I 用于甲状腺吸碘机能的实验等。
[编辑本段]概述同位素是具有相同原子序数的同一化学元素的两种或多种原子之一,在元素周期表上占有同一位置,化学行为几乎相同,但原子质量或质量数不同,从而其质谱行为、放射性转变和物理性质(例如在气态下的扩散本领)有所差异。
同位素的表示是在该元素符号的左上角注明质量数,例如碳14,一般用C14而不用14C.自然界中许多元素都有同位素。
同位素有的是天然存在的,有的是人工制造的,有的有放射性,有的没有放射性。
同一元素的同位素虽然质量数不同,但他们的化学性质基本相同(如:化学反应和离子的形成),物理性质有差异[主要表现在质量上(如:熔点和沸点)]。

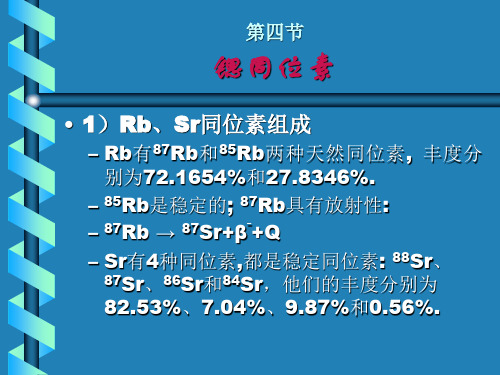
硫同位素地球化学硫有四种稳定同位素:32S,33S,34S,36S,其大致丰度为95.02%,0.75%,4.21%,0.02%。
以S34S/32S来表示硫同位素的分馏。
硫同位素标准是CDT。
自然界硫同位素组成范围大,最重的硫酸盐的δ34S为95‰,最轻的硫化物为-65‰。
等亚稳定络合物,不同价态含硫原子团富集34S的能力不同。
硫化物和硫酸盐之间的氧化还原作用,地表条件下微生物的还原作用,以及硫酸盐和硫化物的溶解度的极大差异,是造成硫的轻、重同位素分馏的重要原因。
7.4.1硫同位素分馏硫同位素的分馏过程主要有:各种硫化合物(硫酸盐、硫化物)之间的同位素交换反应,是一种平衡的同位素分馏;硫化合物发生价态改变的单向化学反应,是一种不可逆的氧化还原反应,具有动力分馏的性质,它既可是无机环境改变引起,也可是生物细菌的有机作用,而且生物细菌的作用往往能引起大的动力分馏。
岩浆环境和250℃以上热液流体中的硫酸盐和溶解的硫化氢、火山喷气口的二氧化硫和硫化氢气体、热液流体中溶解的硫化氢和沉淀的硫化物等是同位素平衡交换的典型体系,平衡条件下硫的重同位素倾向于富集在具有较强硫键的化合物中,由高价到低价,δ34S依次降低,因此各种含硫原子团7.3表示了一些含硫化合物和H2S之间的同位素分馏曲线,硫化物—H2S达到平衡时各种硫化物富34S的顺序大致如下:辉钼矿>黄铁矿>闪锌矿(磁黄铁矿)>H2S>黄铜矿>(HS1-)>铜蓝>方铅矿>辰砂>辉铜矿(辉锑矿)>辉银矿>S2-。
实测数据和理论计算结果大致相符。
低很小。
硫化合物的无机氧化还原作用是一种非平衡的单向化学反应。
硫化物氧化为硫酸盐是一种动力分馏过程,但分馏不明显。
硫酸盐无机还原为硫化物制,它的同位素效应比较明显。
但硫酸盐的无机还原作用需要较高的活化能,低温下参与反应的物质数量很少,因而有实际意义的反应多发生在约250℃以上的热液体系和地壳深部环境,如热液流体中水溶性硫酸盐被还原成水溶硫化物,火山气体中SO2被H2S还原底火山作用条件下,反应是海水演化成为成矿热液的重要反应。

第四章 质谱(Mass Specrometry)早在1921年,就已经出现了质谱仪,那时UV 、IR 、NMR 、GC 及HPLC 等分析技术都还没有出现。
早期质谱仪的最大成功是同位素的发现及其相对丰度的测量。
所以,那时的质谱仪主要用来作同位素的研究,随着石油化工的发展,到了40~50年代,质谱的应用开始向石油化工转移,1951年Brown 发表了测定汽油烃类组成的质谱法。
1957年I. Holms 和F. Moreell 首次实现了色谱-质谱联用。
50年代末,Beyon 、Bienann 和Mclafferty 都提出:官能团对分子中化学键的断裂有引导作用,因此有机质谱得到迅速发展。
4.1 概述质谱用于结构分析有点像:»¨»»ò»é»é»(»»»»»»÷»»¬»»»»)(»»»»»»÷»»¬»»»»)»»»ó»»¨»即:»»ö«»¬»»»¬»é»»«»¬»»¬»(M)( M )+根据各种碎片离子的质荷比及其相对丰度,就可以进行结构分析。
4.1.1定义质谱——按照离子的质荷比的大小依次排列的谱图。
从本质上讲,质谱并非电磁波谱,而是物质的质量谱,因而质谱中并无透光率、吸光度、波长等概念。

地质标准物质中铂族元素的同位素稀释法定值项目完成单位:国家地质实验测试中心项目完成人:胡明月吕彩芬何红蓼一前言铂族元素包括钌、铑、锇、铱、铂、钯六个元素,有很高的经济价值,并且在地球科学、空间科学、环境科学等领域具有较高的科研价值。
准确分析地质样品中的铂族元素一直是一项难度很大的任务,迫切需要可靠的标准物质对分析质量进行监控和溯源。
但是由于铂族元素分析本身难度大,各个实验室提交的分析数据往往离散程度很大,造成铂族元素标准物质定值的困难。
例如我中心承担研制的海洋沉积物标准物质,铂族元素是要求定值的重点项目,而来自不同国家十几个实验室的数据相差达数十倍。
同位素稀释法被公认为最可靠的分析方法,一定量的浓缩同位素一旦加入到样品中与被测同位素充分平衡,就不要求其后化学处理的完全回收,也不受测定过程中仪器漂移的影响,从而保证了分析结果的准确性。
同位素稀释法测定铂族元素不仅可为标样定值提供可靠数据,还可为铂族元素仲裁分析和铂族矿产开发品位确定等提供关键数据。
二稀释法原理2.1 基本原理天然的样品中,一般同位素组成是相对稳定的。
稀释法就是向某种样品中加入已知量的经过同位素富集的稳定同位素稀释剂,使样品中该元素同位素组成改变,从而计算样品中该元素的量。
“稀释剂”是指含有已知浓度的某一特定元素的溶液,而此元素的同位素组成已经由于其中一种天然同位素得到富集而发生了变化。
在被分析的样品中,这种元素的同位素成分是已知的,而浓度却不知道。
因而,已知量的样品溶液和已知量的“稀释剂”混合时,混合物的同位素组成就能用来计算样品溶液中该元素的量。
同位素稀释分析可以应用于具有两个以上天然同位素的元素。
2.2 样品中元素含量的计算进行同位素稀释法分析,要具备富集了待测元素的某种同位素的稀释剂溶液,在一定量的样品中加入一定量的这种稀释剂溶液,使天然样品与稀释剂充分混合达到平衡,然后彻底分解样品,使之转化为可以为质谱仪测定的形式,最后用质谱测定样品中的新的同位素组成,并计算样品中待测元素的含量。



kr的相对原子质量引言原子是构成物质的最基本单位,由核和电子组成。
相对原子质量是指一个原子与碳-12同位素的质量比。
本文将探讨kr元素(氪)的相对原子质量,包括其定义、计算方法、应用领域等内容。
什么是相对原子质量相对原子质量是原子质量的度量单位,通常用“原子质量单位”(amu)表示。
1 amu定义为12C同位素核与碳-12同位素核质量之比的1/12。
相对原子质量用于描述原子的质量大小,可用来比较同位素的质量和计算分子质量等。
kr的相对原子质量氪(Kr)是一种化学元素,原子序数为36,原子符号为Kr。
氪元素的相对原子质量是根据其自然界存在的同位素的质量比例加权平均得出的。
氪在自然界中存在着多个同位素,主要有Kr-78、Kr-80、Kr-82、Kr-83、Kr-84、Kr-86等。
这些同位素的质量和丰度不同,导致了氪的相对原子质量也有所不同。
下表列出了氪的主要同位素、相对原子质量和丰度:同位素相对原子质量(amu)丰度(%)Kr-78 77.920 0.35Kr-80 79.916 2.25Kr-82 81.913 11.58Kr-83 82.914 11.6Kr-84 83.911 57Kr-86 85.910 17.3由上表可知,氪的相对原子质量约为83.798 amu。
计算氪的相对原子质量氪的相对原子质量可以通过根据同位素质量和丰度的乘积求和来计算。
下面以氪为例进行说明:相对原子质量(氪)= (Kr-78质量× Kr-78丰度 + Kr-80质量× Kr-80丰度+ Kr-82质量× Kr-82丰度 + Kr-83质量× Kr-83丰度 + Kr-84质量× Kr-84丰度 + Kr-86质量× Kr-86丰度)/ 100代入相应的数值进行计算,即可得到氪的相对原子质量。
相对原子质量的应用领域相对原子质量是化学和物理学等科学领域中重要的概念,它的应用涉及到许多领域,包括但不限于以下几个方面:1. 元素鉴定和化学计量相对原子质量是确定元素同位素丰度和分子式的重要工具。


丰度的定义和表示方法
一种化学元素在某个自然体中的重量占这个自然体总重量的相对份额(如百分数),称为该元素在自然体中的丰度。
同位素在自然界中的丰度,又称天然存在比,指的是该同位素在这种元素的所有天然同位素中所占的比例。
丰度的大小一般以百分数表示;人造同位素的丰度为零。
周期表上所列的原子量实际上是各种同位素按丰度加权的平均值,这是因为各种同位素在自然界中往往分布的比较均匀,取平均值计算比较准确。
丰度,是指一种化学元素在某个自然体中的重量占这个自然体总重量的相对份额(如百分数)。
丰度表示方法主要分为重量丰度、原子丰度和相对丰度。
丰度,是指一种化学元素在某个自然体中的重量占这个自然体总重量的相对份额(如百分数)。
丰度表示方法主要分为重量丰度、原子丰度和相对丰度。
绝对丰度:指某一种同位素在所有稳定同位素总量中的相对份额,常以该同位素与1H(取1H=1012)或28Si(28Si=106)的比值表示。
这种丰度一般是由太阳光谱和陨石的实测结果给出元素组成,结合各元素的同位素的组成计算的。
相对丰度:指同一元素各同位素的相对含量.如12C=98.90%。
如氢的同位素丰度:1H=99.985%,D=0.015%;氧的同位
素丰度:16O=99.76%,17O=0.04%,18O=0.20%。