常见元素的天然同位素丰度
- 格式:doc
- 大小:158.00 KB
- 文档页数:2
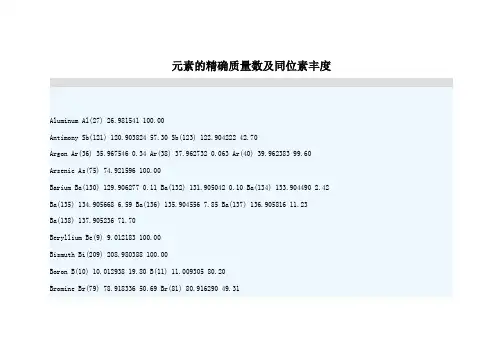
元素的精确质量数及同位素丰度Aluminum Al(27) 26.981541 100.00Antimony Sb(121) 120.903824 57.30 Sb(123) 122.904222 42.70Argon Ar(36) 35.967546 0.34 Ar(38) 37.962732 0.063 Ar(40) 39.962383 99.60 Arsenic As(75) 74.921596 100.00Barium Ba(130) 129.906277 0.11 Ba(132) 131.905042 0.10 Ba(134) 133.904490 2.42 Ba(135) 134.905668 6.59 Ba(136) 135.904556 7.85 Ba(137) 136.905816 11.23Ba(138) 137.905236 71.70Beryllium Be(9) 9.012183 100.00Bismuth Bi(209) 208.980388 100.00Boron B(10) 10.012938 19.80 B(11) 11.009305 80.20Bromine Br(79) 78.918336 50.69 Br(81) 80.916290 49.31Cadmium Cd(106) 105.906461 1.25 Cd(110) 109.903007 12.49 Cd(111) 110.904182 12.80 Cd(112) 111.902761 24.13 Cd(113) 112.904401 12.22 Cd(114) 113.903361 28.73Cd(116) 115.904758 7.49Calcium Ca(40) 39.962591 96.95 Ca(42) 41.958622 0.65 Ca(43) 42.958770 0.14Ca(44) 43.955485 2.086 Ca(46) 45.953689 0.004 Ca(48) 47.952532 0.19Carbon C(12) 12.000000 98.90 C(13) 13.003355 1.10Cerium Ce(136) 135.907140 0.19 Ce(138) 137.905996 0.25 Ce(140) 139.905442 88.48 Ce(142) 141.909249 11.08Cesium Cs(133) 132.905433 100.00Chlorine Cl(35) 34.968853 75.77 Cl(37) 36.965903 24.23Chromium Cr(50) 49.946046 4.35 Cr(52) 51.940510 83.79 Cr(53) 52.940651 9.50Cr(54) 53.938882 2.36Cobalt Co(59) 58.933198 100.00Copper Cu(63) 62.929599 69.17 Cu(65) 64.927792 30.83Dysprosium Dy(156) 155.924287 0.060 Dy(158) 157.924412 0.10 Dy(160) 159.925203 2.34 Dy(161) 160.926939 18.90 Dy(162) 161.926805 25.50 Dy(163) 162.928737 24.90Dy(164) 163.929183 28.20Erbium Er(162) 161.928787 0.14 Er(164) 163.929211 1.61 Er(166) 165.930305 33.60Er(167) 166.932061 22.95 Er(168) 167.932383 26.80 Er(170) 169.935476 14.90Europium Eu(151) 150.919860 47.80 Eu(153) 152.921243 52.20Fluorine F(19) 18.998403 100.00Gallium Ga(69) 68.925581 60.10 Ga(71) 70.924701 39.90Gadolinium Gd(152) 151.919803 0.200 Gd(154) 153.920876 2.18 Gd(155) 154.822629 14.80 Gd(156) 155.922130 20.47 Gd(157) 156.923967 15.65 Gd(158) 157.924111 24.84Gd(160) 159.927061 21.86Germanium Ge(70) 69.924250 20.50 Ge(72) 71.922080 27.40 Ge(73) 72.923464 7.80Ge(74) 73.921179 36.50 Ge(76) 75.921403 7.80Gold Au(197) 196.966560 100.00Hafnium Hf(174) 173.940065 0.16 Hf(176) 175.941420 5.20 Hf(177) 176.943233 18.60 Hf(178) 177.943710 27.10 Hf(179) 178.945827 13.74 Hf(180) 179.946561 35.20 Helium He(3) 3.016029 .0001 He(4) 4.002603 100.00Holmium Ho(165) 164.930332 100.00Hydrogen H(1) 1.007825 99.99 H(2) 2.014102 0.015Indium In(113) 112.904056 4.30 In(115) 114.903875 95.70Iodine I(127) 126.904477 100.00Iridium Ir(191) 190.960603 37.30 Ir(193) 192.962942 62.70Iron Fe(54) 53.939612 5.80 Fe(56) 55.934939 91.72 Fe(57) 56.935396 2.20Fe(58) 57.933278 0.28Krypton Kr(78) 77.920397 0.35 Kr(80) 79.916375 2.25 Kr(82) 81.913483 11.60Kr(83) 82.914134 11.50 Kr(84) 83.911506 57.00 Kr(86) 85.910614 17.30 Lanthanum La(138) 137.907114 0.09 La(139) 138.906355 99.91Lead Pb(204) 203.973037 1.40 Pb(206) 205.974455 24.10 Pb(207) 206.975885 22.10Pb(208) 207.976641 52.40Lithium Li(6) 6.015123 7.42 Li(7) 7.016005 92.58Lutetium Lu(175) 174.940785 97.40 Lu(176) 175.942694 2.60Magnesium Mg(24) 23.985045 78.90 Mg(25) 24.985839 10.00 Mg(26) 25.982595 11.10 Manganese Mn(55) 54.938046 100.00Mercury Hg(196) 195.965812 0.15 Hg(198) 197.966760 10.10 Hg(199) 198.968269 17.00 Hg(200) 199.968316 23.10 Hg(201) 200.970293 13.20 Hg(202) 201.970632 29.65Hg(204) 203.973481 6.80Molybdenum Mo(92) 91.906809 14.84 Mo(94) 93.905086 9.25 Mo(95) 94.905838 15.92Mo(96) 95.904676 16.68 Mo(97) 96.906018 9.55 Mo(98) 97.905405 24.13Mo(100) 99.907473 9.63Neodymium Nd(142) 141.907731 27.13 Nd(143) 142.909823 12.18 Nd(144) 143.910096 23.80 Nd(145) 144.912582 8.30 Nd(146) 145.913126 17.19 Nd(148) 147.916901 5.76Nd(150) 149.920900 5.64Neon Ne(20) 19.992439 90.60 Ne(21) 20.993845 0.26 Ne(22) 21.991384 9.20Nickel Ni(58) 57.935347 68.27 Ni(60) 59.930789 26.10 Ni(61) 60.931059 1.13Ni(62) 61.928346 3.59 Ni(64) 63.927968 0.91Niobium Nb(93) 92.906378 100.00Nitrogen N(14) 14.003074 99.63 N(15) 15.000109 0.37Osmium Os(184) 183.952514 0.02 Os(186) 185.953852 1.58 Os(187) 186.955762 1.60Os(188) 187.955850 13.30 Os(189) 188.958156 16.10 Os(190) 189.958455 26.40Os(192) 191.961487 41.00Oxygen O(16) 15.994915 99.76 O(17) 16.999131 0.038 O(18) 17.999159 0.20Palladium Pd(102) 101.905609 1.02 Pd(104) 103.904026 11.14 Pd(105) 104.905075 22.33 Pd(106) 105.903475 27.33 Pd(108) 107.903894 26.46 Pd(110) 109.905169 11.72 Phosphorus P(31) 30.973763 100.00Platinum Pt(190) 189.959937 0.010 Pt(192) 191.961049 0.79 Pt(194) 193.962679 32.90 Pt(195) 194.964785 33.80 Pt(196) 195.964947 25.30 Pt(198) 197.967879 7.20Potassium K(39) 38.963708 93.20 K(40) 39.963999 0.012 K(41) 40.961825 6.73 Praseodymium Pr(141) 140.907657 100.00Rhenium Re(185) 184.952977 37.40 Re(187) 186.955765 62.60Rhodium Rh(103) 102.905503 100.00Rubidium Rb(85) 84.911800 72.17 Rb(87) 86.909184 27.84Ruthenium Ru(96) 95.907596 5.52 Ru(98) 97.905287 1.88 Ru(99) 98.905937 12.70Ru(100) 99.904218 12.60 Ru(101) 100.905581 17.00 Ru(102) 101.904348 31.60Ru(104) 103.905422 18.70Samarium Sm(144) 143.912009 3.10 Sm(147) 146.914907 15.00 Sm(148) 147.914832 11.30 Sm(149) 148.917193 13.80 Sm(150) 149.917285 7.40 Sm(152) 151.919741 26.70Sm(154) 153.922218 22.70Scandium Sc(45) 44.955914 100.00Selenium Se(74) 73.922477 0.90 Se(76) 75.919207 9.00 Se(77)76.919908 7.60Se(78) 77.917304 23.50 Se(80) 79.916521 49.60 Se(82) 81.916709 9.40Silicon Si(28) 27.976928 92.23 Si(29) 28.976496 4.67 Si(30) 29.973772 3.10Silver Ag(107) 106.905095 51.84 Ag(109) 108.904754 48.16Sodium Na(23) 22.989770 100.00Strontium Sr(84) 83.913428 0.56 Sr(86) 85.909273 9.86 Sr(87) 86.908902 7.00Sr(88) 87.905625 82.58Sulfur S(32) 31.972072 95.02 S(33) 32.971459 0.75 S(34) 33.967868 4.21S(36) 35.967079 0.020Tantalum Ta(180) 179.947489 0.012 Ta(181) 180.948014 99.99Tellurium Te(122) 121.903055 2.60 Te(123) 122.904278 0.91 Te(124) 123.902825 4.82 Te(125) 124.904435 7.14 Te(126) 125.903310 18.95 Te(128) 127.904464 31.69Te(130) 129.906229 33.80Terbium Tb(159) 158.925350 100.00Thallium Tl(203) 202.972336 29.52 Tl(205) 204.974410 70.48Thorium Th(232) 232.038054 100.00Thulium Tm(169) 168.934225 100.00Tin Sn(112) 111.904826 0.97 Sn(114) 113.902784 0.65 Sn(115) 114.903348 0.36Sn(116) 115.901744 14.70 Sn(117) 116.902954 7.70 Sn(118) 117.901607 24.30Sn(119) 118.903310 8.60 Sn(120) 119.902199 32.40 Sn(122) 121.903440 4.60 Sn(124) 123.905271 5.60Titanium Ti(46) 45.952633 8.00 Ti(47) 46.951765 7.30 Ti(48) 47.947947 73.80Ti(49) 48.947871 5.50 Ti(50) 49.944786 5.40Tungsten W(180) 179.946727 0.13 W(182) 181.948225 26.30 W(183) 182.950245 14.30 W(184) 183.950953 30.67 W(186) 185.954377 28.60Uranium U(234) 234.040947 0.006 U(235) 235.043925 0.72 U(238) 238.050786 99.27 Vanadium V(50) 49.947161 0.25 V(51) 50.943963 99.75Xenon Xe(124) 123.905894 0.10 X(126) 125.904281 0.09Xe(128) 127.903531 1.91 Xe(129) 128.904780 26.40 Xe(130) 129.903510 4.10Xe(131) 130.905076 21.20 Xe(132) 131.904148 26.90 Xe(134) 133.905395 10.40Xe(136) 135.907219 8.90Ytterbium Yb(168) 167.933908 0.13 Yb(170) 169.934774 3.05 Yb(171) 170.936338 14.30 Yb(172) 171.936393 21.90 Yb(173) 172.938222 16.12 Yb(174) 173.938873 31.80Yb(176) 175.942576 12.70Yttrium Y(89) 88.905856 100.00Zinc Zn(64) 63.929145 48.60 Zn(66) 65.926035 27.90 Zn(67) 66.927129 4.10Zn(68) 67.924846 18.80 Zn(70) 69.925325 0.60Zirconium Zr(90) 89.904708 51.45 Zr(91) 90.905644 11.27 Zr(92) 91.905039 17.17Zr(94) 93.906319 17.33 Zr(96) 95.908272 2.78。

元素的各种同位素相对原子质量的加权平均值元素的各种同位素相对原子质量的加权平均值是指在自然界中存在的各种同位素所占的比例与其相对原子质量的乘积的总和。
同位素是具有相同原子序数但质量数不同的原子种类。
同一元素的不同同位素具有不同的中子数,因此其相对原子质量也不同。
同位素的相对原子质量是根据同位素丰度和相对原子质量的乘积进行加权平均得出的。
在自然界中,元素的不同同位素存在不同的丰度,即不同同位素的相对丰度不同。
相对丰度是指某一同位素在自然界中所占的比例。
以碳元素为例,其存在的两种主要同位素是碳-12和碳-13,其丰度分别约为98.9%和1.1%。
根据相对丰度和相对原子质量的乘积进行加权平均,可以得到碳元素的相对原子质量,即12.01。
这意味着在自然界中存在的碳元素的平均相对原子质量为12.01。
同样的道理,其他元素的相对原子质量也是通过各种同位素的相对丰度和相对原子质量的乘积进行加权平均得出的。
例如,氢元素存在两种主要同位素,即氢-1和氢-2,其相对丰度分别约为99.98%和0.02%。
根据加权平均的原理,氢元素的相对原子质量为1.01。
各种同位素的相对原子质量的加权平均值对于计算元素的摩尔质量、化学反应的计量关系以及同位素的应用具有重要意义。
在化学实验和工业生产中,常常需要知道元素的摩尔质量,以便进行计量和配比。
同位素的加权平均值可以提供准确的摩尔质量数据,确保实验和生产的准确性。
同位素的加权平均值还可以用于确定同位素的丰度和同位素的分馏过程。
同位素的丰度可以通过质谱仪等仪器测量得出,从而可以了解同位素在地球上的分布以及地球的演化过程。
同位素的分馏过程是指同位素在地球上的不同地质过程中由于物理、化学性质的差异而发生分离的现象。
通过研究同位素的分馏过程,可以揭示地球的演化历史和地质过程。
元素的各种同位素相对原子质量的加权平均值是根据同位素的相对丰度和相对原子质量进行加权平均得出的。
这一值在化学实验、工业生产、地质研究等领域具有重要应用,可以提供准确的摩尔质量数据,揭示同位素的丰度和分馏过程,为科学研究和应用提供有力支持。

同位素的天然存在与应用同位素是指原子核中的质子数相同,但中子数不同的同种元素,因为中子数的不同使它们的原子质量不同。
同位素既存在于自然界中,也可以通过人工合成得到。
同位素在科学、医学、工业、能源等领域中有着广泛的应用。
一、天然存在的同位素同位素在自然界中广泛存在,例如,碳同位素有碳-12、碳-13和碳-14,其中碳-12和碳-13是稳定同位素,而碳-14是不稳定的放射性同位素。
地球上的矿物、动植物体内、大气层中的二氧化碳、水体中的水分子等都含有天然同位素。
同位素的存在丰度(同位素的相对丰度)与它们的出现频率有关。
相对丰度可以用千分之一为单位来表示,例如,碳-14的相对丰度约为万分之一。
二、同位素的应用同位素在各领域有着广泛的应用,下面介绍一些常见的应用。
1. 同位素在医学中的应用同位素在医学中有着广泛的应用,其中最常见的应用是核医学。
核医学是一种以放射性同位素为标记的诊疗技术,通过观察同位素放射性衰变所释放出的射线来进行影像诊断和治疗。
放射性同位素可以用于放射性标记的药物、抗体等的研究,也可以用于治疗肿瘤等疾病。
2. 同位素在工业中的应用同位素在工业中的应用也是非常广泛的。
例如,铀-235、钚-239等放射性同位素可以用于核燃料制造,还可以应用于核武器制造。
稳定同位素也有着各种应用,如利用氘(氢-2)来合成重水,利用同位素碳-13标记化合物等。
3. 同位素在环境中的应用同位素在环境监测和研究中也有着广泛的应用,例如,利用碳-14同位素测定地貌、地层年代,利用放射性同位素测定水体中的污染物、空气中的气体成分等。
4. 同位素在能源中的应用同位素也在能源方面有着应用,例如,利用铀-235和钚-239来制造核燃料,这种方式可以产生巨大的能量。
此外,氢-2同位素也是一种理论上非常有能源潜力的燃料。
总之,同位素广泛存在于自然界中,也有着广泛的应用。
人们通过研究同位素的性质和应用来推动科学技术的发展,实现更好的生活和社会发展。

化学元素的同位素化学元素是构成物质的基本单位,而同位素则是化学元素的一种变种。
同位素指的是原子核中质子数相同,但中子数不同的核素。
在元素周期表上,同位素往往以该元素的原子质量和化学符号表示。
同位素的存在对于科学研究及实际应用具有重要意义。
本文将对化学元素的同位素进行详细讨论。
一、同位素的概念和分类同位素是由于原子核中中子数的不同而存在的变种。
同一种元素的同位素具有相同的原子序数(即原子核中的质子数),但其原子质量(即原子核中质子数加中子数的总和)不同。
根据同位素的原子质量,可以将其分为稳定同位素和放射性同位素两类。
1. 稳定同位素稳定同位素的原子核十分稳定,不会发生自发核变。
稳定同位素在自然界中存在丰度较高,对元素的化学性质并无明显影响。
以氧元素为例,其主要同位素有氧-16、氧-17和氧-18,其中氧-16的丰度最高,占氧元素总量的99.76%。
2. 放射性同位素放射性同位素具有不稳定的原子核,会发生自发核变并释放出放射性粒子或电磁辐射。
放射性同位素在自然界中存在丰度较低,但对研究和应用具有重要意义。
例如,放射性同位素碳-14可用于进行古代生物和地质年代测定,放射性同位素放射性碘-131可用于治疗甲状腺疾病。
二、同位素的发现和研究同位素的发现和研究是一个渐进的过程。
早在19世纪末,科学家们就开始研究放射性现象,并逐渐发现了一些放射性同位素。
例如,亨利·贝克勒尔在1896年发现了放射性铀,进一步研究发现了镭、钋等放射性同位素。
随着科学技术的发展,人们越来越能够准确地测定同位素的质量和丰度。
现代科学研究中,同位素广泛应用于多个领域。
例如,同位素示踪技术可以用来追踪化学反应中的原子或分子,帮助科学家揭示反应过程和机理。
同位素标记技术可以将同位素引入化合物或生物分子中,用于药物研发、生物学研究等领域。
三、同位素在环境和生物体中的应用同位素在环境和生物体中的应用广泛而重要。
通过测定环境中同位素的丰度变化,可以研究地球科学、气象学、生态学等方面的问题。


水自然丰度的氘同位素
氘是氢的同位素,具有一个质子和一个中子。
水分子(H₂O)中的氢原子可以包含氘,形成重水(D₂O)。
在重水中,氢的位置被氘取代。
普通水(H₂O)和重水(D₂O)之间的主要区别在于氢的同位素。
普通水中的氢是氢-1同位素(含有一个质子,没有中子),而重水中的氢是氘同位素(含有一个质子和一个中子)。
在自然界中,重水的存在相对较稀少。
地球上的水主要是普通水,其中氘的含量相对较低。
重水通常用于特定的实验室研究和工业应用,因为其性质和普通水有所不同。
例如,在核反应堆中,重水可用作冷却剂和中子减速剂。

星际物质中的同位素分布与元素丰度星际物质是宇宙中广阔而神秘的领域。
它是构成恒星、行星和星系的基础,也是探索宇宙奥秘的重要线索。
了解星际物质中的同位素分布与元素丰度,有助于揭开宇宙的演化历程以及地球和生命的起源。
首先,我们先来了解一下同位素分布的基本概念。
同位素指的是具有相同原子序数(即元素的序数)但质量数不同的原子,它们拥有不同数量的中子。
例如,氢有三种同位素,分别是质子数分别为1、2、3的氢。
同位素的分布在不同的星系、不同的恒星和不同的行星中可能会有所差异,这取决于它们的形成和演化过程。
在星际物质中,氢和氦的丰度是最高的。
这是因为大爆炸时,宇宙诞生了大量的氢和少量的氦。
除了氢和氦之外,其他元素的丰度相对较低,它们主要来自于恒星的核聚变和超新星爆炸。
恒星的核聚变过程中,氢被转化为氦,同时释放出巨大的能量。
这个过程不断重复,导致了高质量恒星的演化。
当恒星耗尽了核燃料,无法抵抗引力坍缩时,会发生超新星爆炸,将内部合成的重元素喷射到星际空间中。
在星际介质中,重元素的丰度随着时间的推移逐渐增加。
这是因为新一代星系的形成和演化中,包含有更多的重元素。
这些重元素在恒星形成过程中被吸积,并最终形成新的行星系。
例如,地球上的金属元素就来自于恒星的合成和超新星爆炸。
这一过程耗费了数十亿年的时间,才形成了我们现在所见到的丰富元素组合。
除了重元素,同位素的分布也是星际物质中的重要研究方向之一。
同位素具有不同的稳定性和衰变特性,可以用来追溯宇宙的演化过程。
比如,碳同位素的分布可以提供有关星系形成的信息,氧同位素的分布可以揭示行星形成和生命起源的环境条件。
同时,同位素还可以用来研究宇宙射线、星际尘埃和陨石等物质的来源和性质。
在过去的几十年里,科学家们利用地面和太空观测装置,不断深入研究星际物质中的同位素分布和元素丰度。
他们通过分析星际云气体和尘埃中的成分,探索它们的产生机制和演化历程。
同时,还利用先进的实验技术,对地球上的陨石和月球样本进行研究,以寻找有关宇宙起源和演化的线索。

碳酸锂标准同位素碳酸锂(Li2CO3)是一种无机化合物,由锂、碳和氧元素组成。
锂有两种天然存在的同位素:锂-6和锂-7。
锂-6的相对丰度约为7.5%,锂-7的相对丰度约为92.5%。
因此,在自然界中,锂的同位素主要是锂-7。
锂的同位素在地球上以及宇宙空间中有广泛的应用。
在地质学中,研究锂同位素的分布可以帮助科学家了解地球内部化学成分、地球与其他星球的比较以及地球的地壳变化。
在生物学中,锂同位素的研究可以用来追踪生物地球化学循环以及生态系统之间的关系。
锂同位素的研究对于科学家理解锂的地质和地球化学行为至关重要。
在地球内部,锂同位素的组成可以揭示地壳中岩石、水体以及岩浆的起源和演化。
同位素分析可以用于研究水文地质、火山活动以及矿床形成等领域。
通过分析不同水体中的锂同位素组成,科学家可以追踪水的来源和循环方式,从而了解地下水资源的分布和管理。
锂同位素在宇宙空间中也有重要的研究价值。
科学家通过分析太阳系中不同天体的同位素组成,可以了解天体的起源和演化过程。
例如,锂同位素的分析可以用来研究星团、星云以及行星的形成。
通过比较地球上的锂同位素和其他星球的同位素,科学家可以了解太阳系内不同天体之间的差异和相似之处。
碳酸锂是一种常见的锂化合物,在工业生产中有广泛的应用。
它可用于制备锂离子电池、陶瓷材料、玻璃制品以及钢铁冶炼等领域。
锂离子电池是一种高效、轻巧的电池,广泛应用于移动电子设备、电动汽车以及储能系统中。
碳酸锂在锂离子电池的正极材料中起到了重要的作用,它可以提供锂离子的储存和释放。
通过研究碳酸锂的同位素组成,可以了解锂离子电池中锂的来源和循环方式,从而提高电池的效能和寿命。
在农业和环境领域,锂同位素的研究可以用于追踪土壤和地下水中的污染源以及水的来源。
例如,锂同位素与其他元素的比例可以揭示水体中的冲刷和颗粒物运移过程。
同位素分析还可以应用于食物链中的研究,通过分析食物中的锂同位素组成,可以了解食物链中不同生物的食物来源和相互关系。

锶的同位素单位锶(英文:Strontium)是化学元素周期表中的一种碱土金属元素,原子序数为38,化学符号为Sr。
锶具有银白色的金属光泽,是一种相对稳定和耐腐蚀的金属。
它在自然界中主要以锶矿物和天然水体中存在。
锶有四个天然同位素,分别是锶-84、锶-86、锶-87和锶-88。
其中锶-86和锶-88是非放射性同位素,锶-84和锶-87是放射性同位素。
锶-87是锶的稳定同位素之一,它的存在丰度约为7%,是最常见的锶同位素。
锶-87具有一定的指示意义。
在地球科学中,科学家常用锶-87的同位素比值来推断和研究岩石和矿物的年龄。
因为岩石中的锶-87会随着时间的推移逐渐衰变为钇-87,而锶-86的数量相对稳定,因此可以通过同位素的比值来确认岩石的年龄。
锶的同位素在医学和环境科学中也具有重要意义。
锶-89是一种放射性同位素,具有较长的半衰期,可以用于癌症的治疗。
它可以通过注射进入体内,靶向性地破坏癌细胞,从而起到治疗作用。
此外,锶-90是一种放射性同位素,它是核爆炸中产生的产物,并且具有较长的半衰期。
锶-90对环境和人体健康具有潜在危害,因此需要进行监测和控制。
锶同位素还常用于食品和饮用水的追溯和溯源。
由于不同地区的土壤和地下水中锶同位素比值存在差异,可以通过锶同位素的分析来确定食品和饮用水的产地和来源。
利用锶同位素分析技术,可以提供科学依据,确保食品和水源的质量安全。
锶的同位素研究在众多领域起着重要的作用,丰富了我们对地球历史、医学治疗和环境科学的理解。
随着科学技术的不断发展,相信锶同位素的研究将为我们带来更多有益的发现和应用。

丰度与相对原子质量元素的重要指标元素的丰度和相对原子质量是研究化学元素性质的重要指标。
在化学研究和工业生产中,掌握元素的丰度和相对原子质量,不仅能帮助我们了解元素的性质,还对实验设计和反应过程有着重要的影响。
本文将深入探讨丰度和相对原子质量的概念与应用。
一、丰度的概念与计算丰度是指某一元素在自然界中的出现频率和数量。
我们常用的丰度表示方法有质量丰度和体积丰度两种。
质量丰度是指单位质量的某元素在化合物或物质中所占的比例,通常用百分数表示。
体积丰度则是指单位体积的某元素在化合物或物质中所占的比例,如以气体为例,可以用体积比或体积分数来表示。
计算丰度需要借助相对原子质量。
相对原子质量是指元素相对于碳-12同位素的质量比值。
举个例子来说,氧的相对原子质量为16,表示氧的质量是碳-12质量的16倍。
在计算丰度时,我们可以利用元素的相对原子质量和普适性质量比例来推导计算公式。
例如,如果一种化合物中氧的相对原子质量为16,碳的相对原子质量为12,那么我们可以通过比值计算出氧的质量丰度,即16 / (16 + 12) * 100% = 57.14%。
二、丰度与元素性质的关系元素的丰度对其性质具有重要影响。
丰度越高,元素在化合物中的含量越大,因此其性质也更加突出。
以金属铁为例,铁在地壳中丰度较高,因此其具有很好的导电性和导热性。
相反,丰度较低的元素,如稀土元素镧(La),在地壳中含量很少,因此具有较特殊的性质和应用。
此外,丰度的变化也会对物质的性质和反应过程产生重要影响。
举例来说,催化反应是指通过添加少量的催化剂来改变化学反应的速率和选择性。
催化剂通常是高丰度的金属或其化合物,在反应中起到活化物质的作用。
因此,了解元素的丰度和其催化性能之间的关系,可以帮助我们设计和改进催化反应工艺。
三、相对原子质量与元素识别相对原子质量是识别元素的重要指标之一。
通过对元素的质量进行测定和比对,可以确定元素的相对原子质量。
这对于分辨不同元素、确定元素的同位素和进行元素分析都具有重要的意义。

元素周期表中各元素介绍氢是元素周期表中的第一号元素,元素名来源于希腊文,原意是“水素”。
氢是由英国化学家卡文迪许在1766年发现,称之为可燃空气,并证明它在空气中燃烧生成水。
1787年法国化学家拉瓦锡证明氢是一种单质并命名。
氢在地壳中的丰度很高,按原子组成占15.4%,但重量仅占1%。
在宇宙中,氢是最丰富的元素。
在地球上氢主要以化和态存在于水和有机物中。
有三种同位素:氕、氘、氚。
氢在通常条件下为无色、无味的气体;气体分子由双原子组成;熔点-259.14°C,沸点-252.8°C,临界温度33.19K,临界压力12.98大气压,气体密度0.0899克/升;水溶解度21.4厘米?/千克水(0°C),稍溶于有机溶剂。
在常温下,氢比较不活泼,但可用合适的催化剂使之活化。
在高温下,氢是高度活泼的。
除稀有气体元素外,几乎所有的元素都能与氢生成化合物。
非金属元素的氢化物通常称为某化氢,如卤化氢、硫化氢等;金属元素的氢化物称为金属氢化物,如氢化锂、氢化钙等。
氢是重要的工业原料,又是未来的能源。
氦,原子序数2,原子量4.002602,为稀有气体的一种。
元素名来源于希腊文,原意是“太阳”。
1868年有人利用分光镜观察太阳表面,发现一条新的黄色谱线,并认为是属于太阳上的某个未知元素,故名氦。
后有人用无机酸处理沥青铀矿时得到一种不活泼气体,1895年英国科学家拉姆赛用光谱证明就是氦。
以后又陆续从其他矿石、空气和天然气中发现了氦。
氦在地壳中的含量极少,在整个宇宙中按质量计占23%,仅次于氢。
氦在空气中的含量为0.0005%。
氦有两种天然同位素:氦3、氦4,自然界中存在的氦基本上全是氦4。
氦在通常情况下为无色、无味的气体;熔点-272.2°C(25个大气压),沸点-268.9°C;密度0.1785克/升,临界温度-267.8°C,临界压力2.26大气压;水中溶解度8.61厘米?/千克水。
化学元素的同位素同位素是指原子核中具有相同质子数但中子数不同的同一种化学元素。
在自然界中,许多元素都存在多种同位素,同位素的存在使得元素具有不同的质量数,并且在化学和物理性质上可能有所区别。
本文将介绍同位素的定义、性质以及应用领域。
一、同位素的定义同位素也被称为同重异质素,是指拥有相同原子序数(即质子数)的元素中,质子数相同而中子数不同的核。
同位素具有相同的化学性质,但由于中子数的不同,其质量数各不相同。
例如,氧元素的同位素有氧-16、氧-17、氧-18,它们的质子数都是8,但中子数分别是8、9、10,因此质量数分别为16、17、18。
二、同位素的性质1. 相对丰度:自然界中的元素通常由多种同位素组成,其相对丰度是指每种同位素在自然界中的存在比例。
相对丰度的测定通常使用质谱仪等仪器设备进行分析。
2. 放射性:许多同位素是放射性同位素,其原子核不稳定,会经历衰变过程释放出射线,同时转变成其他元素。
这种放射性衰变过程有助于研究同位素的性质以及进行放射性同位素的应用。
3. 核稳定性:某些同位素的原子核非常稳定,不会自发衰变。
这些稳定同位素具有重要的应用价值,例如用于同位素标记实验、同位素示踪等。
三、同位素的应用1. 同位素标记实验:将同位素标记在分子中,可以追踪分子在化学反应或生物过程中的转化和分布。
例如,通过在分子中标记含有放射性同位素碳-14的氨基酸,可以研究蛋白质的合成和代谢途径。
2. 同位素示踪:利用同位素的放射性特性,可以追踪物质在环境中的迁移、转化和归宿。
例如,利用放射性同位素碳-14可对化石、土壤、岩石等进行年代测定,探寻地球历史和生物进化过程。
3. 同位素医学:同位素的放射性特性在医学领域有广泛应用。
例如,使用人工合成的同位素技术进行放射性示踪,可以对人体内部的器官、组织以及代谢过程进行影像学检查和诊断。
4. 放射性治疗:某些放射性同位素可以被用于治疗癌症等疾病。
通过将放射性同位素定位到肿瘤细胞并释放射线,可以起到杀死肿瘤细胞的作用。
卤素同位素峰
卤素同位素峰是指在质谱图中,由于卤素元素(如氟、氯、溴、碘)存在同位素而形成的特定峰。
这些同位素峰的出现是因为卤素元素有多种同位素形式,这些同位素在自然界中的丰度不同。
在质谱分析中,当卤素元素存在于化合物中时,其同位素会以不同的质量数出现在质谱图中,形成同位素峰。
卤素同位素峰的存在对于化合物的分析和鉴定具有重要意义。
首先,同位素峰的出现可以帮助确认化合物的元素组成,因为不同元素的同位素具有不同的质量数。
其次,同位素峰的相对强度可以提供有关化合物中卤素原子同位素分布的信息,这对于了解化合物的来源、合成途径以及反应机理等方面具有重要意义。
在质谱分析中,同位素峰的相对强度受到多种因素的影响,包括同位素的相对丰度、化合物的分子结构以及质谱仪器的分辨率等。
因此,对于卤素同位素峰的分析需要综合考虑这些因素,以获得准确的结果。
总之,卤素同位素峰是质谱图中重要的特征之一,对于化合物的分析和鉴定具有重要意义。
通过对同位素峰的研究,可以深入了解化合物的组成、结构和性质,为化学研究和应用提供有力的支持。
硼同位素丰度简介硼(B)是一种化学元素,它存在于自然界中多种形式的化合物中。
硼同位素是硼原子核中质子和中子的组合不同所形成的核种类。
目前已知的硼同位素有两种稳定同位素:硼-10和硼-11。
硼同位素丰度指的是自然界中硼的不同同位素相对丰度的比例。
硼同位素丰度在不同地理区域、岩石类型和水体中具有差异,因此研究硼同位素丰度可以为地质学、环境学和生物学等领域提供重要的信息。
重要性及应用硼同位素丰度在地质学中有广泛的应用。
地壳中的岩石和矿物中都含有硼,通过测量岩石和矿物中硼同位素丰度的变化,可以了解地壳形成和演化的过程。
硼同位素丰度还可以用来追踪水体的起源和循环路径。
在环境学中,硼同位素丰度可以用来研究地下水中的污染物扩散和迁移过程。
此外,硼同位素丰度还可以用来探索物种的生态起源和进化关系,以及确定古代生物的生活环境和气候变化等。
测量方法测量硼同位素丰度通常使用质谱仪或电感耦合等离子体质谱仪进行。
具体步骤如下:1.样品预处理:将待测样品中的硼提取出来,并转化为硼酸盐。
2.离子化:将硼酸盐样品转化为离子状态,通常采用热电离(ThermalIonization)或电感耦合等离子体质谱仪(Inductively Coupled PlasmaMass Spectrometry,ICP-MS)等方法将样品中的硼离子化。
3.分离:利用质谱仪中的磁扇分离器(Magnetic Sector)或质量过滤器(Mass Filter)等装置,将离子按照质量分离。
4.检测:通过测量硼同位素离子的数量比例,确定硼同位素丰度。
影响因素硼同位素丰度受多种因素影响,包括地质过程、水文循环、生物活动等。
以下列举几个常见的影响因素:1.岩浆演化:岩浆的形成和演化过程中,硼同位素丰度可能发生变化。
不同岩浆来源和演化路径会导致硼同位素的不同丰度。
2.地质作用:地壳中的热液活动、变质作用和岩浆浅显作用等地质过程都会对硼同位素丰度产生影响。
3.水体来源:不同地区的水体来源不同,硼同位素丰度也会受到影响。
镍的相对原子质量计算时取多少
镍是一种化学元素,其原子序数为28,相对原子质量为58.69。
相对原子质量是指元素相对于碳-12同位素的质量比值。
因此,镍的相对原子质量是其质量与碳-12质量比值的比例。
在计算镍的相对原子质量时,应该使用其常见同位素的相对丰度加权平均值。
镍有五个天然同位素,分别是58Ni、60Ni、61Ni、62Ni 和64Ni,相对丰度分别为68.077%、26.223%、1.139%、3.634%和0.926%。
因此,镍的相对原子质量计算公式为:
(58.69 × 0.68077) + (59.93 × 0.26223) + (60.93 ×
0.01139) + (61.93 × 0.03634) + (63.93 × 0.00926) = 58.6934
因此,镍的相对原子质量为58.6934。
在化学计算中,应该使用这个数值作为镍的相对原子质量。
- 1 -。
铅的同位素铅是一种常见的金属元素,具有多种同位素。
同位素是指原子核中具有相同质子数(即原子序数)但中子数不同的原子。
铅的同位素主要有铅-204、铅-206、铅-207和铅-208。
铅-204是铅的一种稳定同位素,其原子核由82个质子和122个中子组成。
铅-204的丰度非常低,仅占铅的1.4%左右。
由于其稳定性较高,铅-204在地球上存在的时间非常长。
研究人员可以通过测量铅-204的比例来研究地质年代学和射线测年等领域。
铅-206是铅的一种稳定同位素,其原子核由82个质子和124个中子组成。
铅-206的丰度较高,约占铅的24.1%。
在地球科学中,铅-206的丰度比例被广泛用于测量岩石和矿物的年龄。
这是因为铅-206是铀系列衰变链中的一个中间产物,其形成速率相对稳定,可以用来确定岩石和矿物中铀的衰变历史。
铅-207是铅的一种稳定同位素,其原子核由82个质子和125个中子组成。
铅-207的丰度约占铅的22.1%。
铅-207的比例在地球科学中也被广泛应用于年代测定。
与铅-206类似,铅-207也是铀系列衰变链中的一个中间产物,其形成速率相对稳定。
铅-208是铅的一种稳定同位素,其原子核由82个质子和126个中子组成。
铅-208的丰度最高,约占铅的52.4%。
铅-208的丰度比例也被广泛用于年代测定。
在地球科学中,铅-208的比例还可以用于研究地球内部的物质循环和地球化学过程。
除了这些稳定同位素,铅还有一些放射性同位素,如铅-210和铅-212等。
这些同位素具有较短的半衰期,会不断衰变放出放射性粒子。
由于放射性同位素的不稳定性,它们在地球上的存在时间相对较短,但在核物理学研究和医学应用中具有重要作用。
总结而言,铅具有多种同位素,包括稳定同位素铅-204、铅-206、铅-207和铅-208,以及放射性同位素铅-210和铅-212等。
这些同位素在地质年代学、射线测年、地球化学和核物理学等领域具有重要应用价值。