细胞培养基的Exosome提取方案
- 格式:docx
- 大小:17.26 KB
- 文档页数:1

外泌体(Exosome)知识与检测方法一、 Exosome 简介最近几年,一种叫做Exosome的小囊泡正受到大家广泛的关注。
Exosome是直径约为30-150nm,密度在1.13-1.21g/m1的小囊泡。
Exosome天然存在于体液中,包括血液、唾液、尿液和母乳,外泌体(Exosome)是活细胞分泌的来源于晚期核内体(也称为多囊泡体)的膜性囊泡。
Exosome在30年前被人们所发现。
早期的研究认为,exosome 执行蛋白运输功能,特异靶定受体细胞,交换蛋白和脂类或引发下游信号事件。
直到2007年,研究人员发现exosome也运输核酸,参与细胞间通讯。
总之,其蛋白、RNA和脂肪成分特异,且携带了一些重要的信号分子,有望在多种疾病的早期诊断中发挥作用,这使得exosome的市场也在快速扩展,并成为热门的研究对象。
不同组织细胞来源exosome由于携带的蛋白质不同,而能够发挥不同的生物学功能。
例如,肿瘤细胞分泌的exosome能够介导血管再生肿瘤细胞增殖及免疫逃逸;而树突状细胞源性exosome则能够引起机体有效的抗肿瘤免疫应答。
目前研究发现,Exosome内含有与细胞来源相关的蛋白质rRNA和microRNA,并且exosome能够通过生物屏障,在细胞间传递功能性核酸分子,从而发挥各种生物学功能,故exosome有望成为一种新型给药途径及基因治疗载体。
Exosome携带蛋白质包括源细胞非特异性和源细胞特异性两类蛋白分子。
前者可能与exosome的生物发生和生物学作用有关,主要包括:细胞溶质蛋白、参与细胞内信号转导的蛋白、各种代谢酶、热休克蛋白和四跨膜蛋白;另一类是特殊蛋白质,这类蛋白质只存在于某种特殊的细胞分泌的exosome,而这些特定细胞源的exosome与其生物学功能有着密切联系,例如分子来源的Exosome上含有MHCII类分子。
二, Exosome 提取Exosome是由活细胞分泌的,它是一种亚细胞成分,组要成分是磷脂双分子和携带的膜性分子,其界定依据形态学和生物化学及提取方式不同细胞源的exosome是不同的,这些不同的理化性质有利于exosome的提取。

大鼠T细胞源性exosome提取方法比较孙祯;黄赤兵;宋亚军;陈益荣;李传贵【摘要】目的:采用3种方法从大鼠T细胞培养上清中提取纯化exosome ,以获取高质量的exosome。
方法分别采用Exo-Quick Precipitation提取法、超滤密度梯度离心法、差速离心法提取 T 细胞培养上清中的exosome。
利用透射电镜进行形态学观察,2,2-联喹啉-4,4-二甲酸二钠(BCA )法进行蛋白定量,十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE )分析蛋白表达的差异,Western blotting检测白细胞介素2(IL-2)的表达。
结果3种方法均可提取出exosome;ExoQuick Precipitation 提取法、超滤密度梯度离心法所得样本浓度显著高于差速离心法所得样本浓度(P<0.05);SDS-PAGE结果显示3种方法所得样本具有蛋白表达强度的差异;Western blotting显示3种方法所得样本均表达IL-2。
结论 ExoQuick Precipitation提取法、超滤密度梯度离心法可获得高纯度、无蛋白丢失的exosome样本。
%Objective The purification methods of the exosomes derived form T cells were established in order to get high quan-tity exosomes .Methods Exosomes from T cells culture supernatants were purified by ExoQuick Precipitation ,ultrafiltration and sucrose gradient centrifugation ,differential ultracentrifugation ,and confirmed via using transmission electron microscopy .The pro-tein expression of the exosomes were analyzed by SDS-PAGE electrophoresis .Western blotting was used to test the expression of IL-2 .Results The protein concentrationof the exosomes purified through ExoQuick Precipitation ,ultrafiltrationand sucrose gradi-ent centrifugation were higher than through differential ultracentrifugation (P<0 .05) .SDS-PAGE displayed the difference amongthe exosome purified by three methods .Three kinds of exosomes all expressed IL-2 .Conclusion ExoQuick Precipitation ,ultrafiltra-tion and sucrose gradient centrifugation technique can obtain high purity and complete exosome sample .【期刊名称】《重庆医学》【年(卷),期】2013(000)029【总页数】4页(P3512-3514,3517)【关键词】exosome;Exo Quick Precipitation;超滤密度梯度离心;差速离心【作者】孙祯;黄赤兵;宋亚军;陈益荣;李传贵【作者单位】第三军医大学新桥医院泌尿外科,重庆400037;第三军医大学新桥医院泌尿外科,重庆400037;第三军医大学新桥医院泌尿外科,重庆400037;第三军医大学新桥医院泌尿外科,重庆400037;第三军医大学新桥医院泌尿外科,重庆400037【正文语种】中文Exosome是一种起源于内吞体系统并被排出胞外的膜性囊泡,直径在30~100nm[1],含有大量与其来源相关的特异性蛋白,并由此发挥不同的功能[2]。

外泌体分离提纯草案By 朱旭峰一、以超高速离心的方法来分离外泌体(细胞上清)1.1细胞培养液(CM)是来自无菌的80%-90%的培植细胞,并用浓度比1:1.000的蛋白酶抑制剂混合。
(sigma)1.2快速地将CM用0.22μm 的过滤筛(Millipore)过滤,来分离完整地细胞和残渣。
超速离心于120,000_g (Sorvall WX ULTRA SERIES, rotorA-641) 4 ℃. 2 小时1.3用1mL 冷的PBS 重悬和清洗小囊泡,再次超速离心120,000_g(Sorvall WX ULTRA SERIES, rotor A-641) 4 ℃. 2 小时1.4再用100μL 冷的PBS 重悬后转移到低粘附的管中1.5快速地使用或置于-80℃中待用为检测外泌体的蛋白浓度,取2μL的样品置于卡上,用Direct Detect™(Millipore)2材料a)细胞培养液b)蛋白酶抑制(Sigma)c)过滤筛(Millipore)d)冷的PBSe)低粘附的管f)Direct Detect™(Millipore)二、以超高速离心的方法来分离外泌体(人血浆)1.1在提取外泌体之前应该向血浆里添加1;500浓度比的蛋白酶抑制剂(Sigma)1.2将上清液移至一个新的管中离心200*g 20分钟4℃1.3小心地再将上清液移至新的管中离心10000*g 30分钟于4℃来去除较大的囊泡、1.4此阶段的样品可以1.5将样品用0.22μm的注射器滤筛(Millipore)过滤并且离心110000g(Sorvall WX ULTRA SERIES, rotor F65L) 2小时4℃1.6用冷的PBS重悬后再次超速离心(110,000g, 1 h, 4 ℃).,1.7将外泌体小心干燥并且用冷的PBS重悬1.8外泌体应该立即使用或-80摄氏度冷藏2.材料a)蛋白酶抑制(Sigma)b)过滤筛(Millipore)c)冷的PBSd)低粘附的管e)Direct Detect™(Millipore)三、ExoQuick TM化学沉淀法1.1ExoQuick TM的使用要按照厂家提供的说明书来实行1.2该试剂盒可以简单地提取CM,人血浆,和血清里的外泌体,只需用倒相管按照所指示的量来加入ExoQuick TM试剂盒里的溶液1.3溶液孵化过夜,在4℃温和的摇晃1.4在流式细胞仪缓冲液中洗涤1.5试剂盒里的带荧光的免疫磁珠已经被绑定,用流式细胞仪鉴定即可(BD Biosciences) 配合使用CellQuest 的软件。
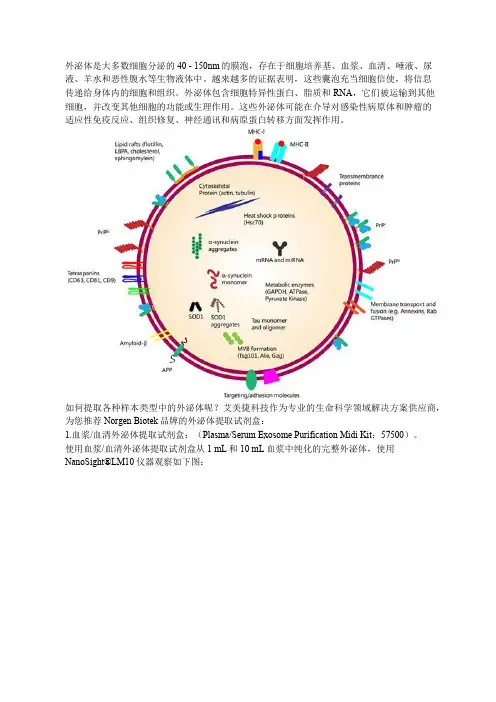
外泌体是大多数细胞分泌的40 - 150nm的膜泡,存在于细胞培养基、血浆、血清、唾液、尿液、羊水和恶性腹水等生物液体中。
越来越多的证据表明,这些囊泡充当细胞信使,将信息传递给身体内的细胞和组织。
外泌体包含细胞特异性蛋白、脂质和RNA,它们被运输到其他细胞,并改变其他细胞的功能或生理作用。
这些外泌体可能在介导对感染性病原体和肿瘤的适应性免疫反应、组织修复、神经通讯和病原蛋白转移方面发挥作用。
如何提取各种样本类型中的外泌体呢?艾美捷科技作为专业的生命科学领域解决方案供应商,为您推荐Norgen Biotek品牌的外泌体提取试剂盒:1.血浆/血清外泌体提取试剂盒:(Plasma/Serum Exosome Purification Midi Kit;57500)。
使用血浆/血清外泌体提取试剂盒从1 mL和10 mL血浆中纯化的完整外泌体,使用NanoSight®LM10仪器观察如下图:【血浆/血清外泌体提取试剂盒-各品牌横向对比】Norgen的试剂盒分离出55 nm外泌体,回收率为每毫升血浆9.64 x 1013颗粒。
另外与其他两种竞争对手相比,从1mL血浆中纯化的外泌体覆盖50nm-150nm的更宽尺寸范围,血浆浓度更高。
2.尿液外泌体提取试剂盒(Urine Exosome Purification Midi Kit;57800):图4使用尿液外泌体提取试剂盒从10 mL尿液中纯化的完整外泌体与使用超速离心发相比,使用NanoSight®LM10仪器观察如下图:经过Norgen的试剂盒纯化的外泌体大小从65nm到195nm,总回收率为7.63×108个颗粒/ mL。
【尿液外泌体提取试剂盒-各品牌横向对比】Norgen的试剂盒分离出115 nm外泌体,回收率为每毫升尿液8.36 x 109颗粒。
另外与其他两种竞争对手相比,从5mL尿液中纯化的外泌体覆盖75nm-250nm的更宽尺寸范围,尿液浓度更高。


尿液exosomes RNA提取SOP实验步骤:A.exosome 沉淀——10ML样本起始量(用ExoQuick-TC 分离exosomes)1.尿液离心(3000g,15min,4℃),取上清(沉淀为细胞或细胞碎片)2.转移上清至无菌试管,加入2ML的ExoQuick-TC , 颠倒试管混匀。
3.4℃冷藏过夜(至少12h)(冷藏期间试管需静置,勿旋转)。
4.离心(1500g, 30min,4℃或室温),离心后,exosomes为管底的米黄色/白色小球。
5.去除上清,再次离心(1500g, 5min),尽量去除所有的液体,小心别碰到沉淀。
6.在上步沉淀中加入350ul LYSIS Buffer,涡旋15sB.exosomes RNA提取1.在上步沉淀中加入350ul LYSIS Buffer,涡旋15s;2.室温放置5min(使exosomes裂解完全);3.加入200ul 100%乙醇(RNAse-free),涡旋10s;4.将柱子装入收集管,将600ul 上述溶液转移到柱子中;5.离心(13000rpm,1min,4℃);6.弃废液;7.加入400ul WASH Buffer;8.离心(13000rpm,1min,4℃);9.重复⑹-⑻,再洗一次(共洗两次);10.弃废液,离心(13000rpm,2min,4℃)(关键,为了甩干柱子便于更好地洗脱RNA);11.将柱子转移到新的1.5ml EP管(RNAse-free)中;12.加入30ul Elution buffer 至膜中央;13.离心(2000rpm,2min, 此步为使Elution buffer 浸透膜);14.增加转速离心(13000rpm,1min, 此步为洗脱RNA)。
15.弃柱子,将提取的RNA立即放-80℃。

exo-fect的原理EXO-FECT技术原理解析引言:EXO-FECT是一种新型的基因转染技术,通过利用细胞外囊泡(exosome)作为载体,将外源基因或RNA引入目标细胞中,实现基因转染和基因表达。
本文将详细介绍EXO-FECT技术的原理及应用。
一、EXO-FECT技术的基本原理1. 细胞外囊泡(exosome)的提取:细胞外囊泡是由细胞分泌的一种小型脂质囊泡,直径约为30-150纳米。
通过超速离心、滤膜或聚合物沉淀等方法,可以从细胞培养上清液、体液或尿液中提取到细胞外囊泡。
2. 外源基因或RNA的包装:将外源基因或RNA通过某种方法导入到细胞外囊泡中,可以利用转染剂、电穿孔或共沉淀等技术实现。
外源基因一般是经过表达载体构建的,可以携带特定的启动子和调控元件,实现基因在目标细胞中的表达。
3. 细胞外囊泡的靶向:通过对细胞外囊泡表面的蛋白质或糖基进行修饰,可以实现细胞外囊泡的靶向。
例如,可以通过修饰特定的抗体或配体,使细胞外囊泡能够选择性地结合到目标细胞表面的受体上。
4. 细胞外囊泡的摄取:经过靶向修饰后的细胞外囊泡可以与目标细胞表面的受体结合,通过内吞作用进入目标细胞内。
在目标细胞内,细胞外囊泡可以与内质网或溶酶体融合,释放出内部的外源基因或RNA。
5. 外源基因或RNA的表达:在目标细胞内,被释放出的外源基因或RNA可以进入细胞核,并与细胞内的转录因子结合,启动特定基因的表达。
这样,外源基因或RNA就可以在目标细胞中发挥作用。
二、EXO-FECT技术的应用1. 基因治疗:EXO-FECT技术可以用于将治疗基因引入患者体内的靶细胞中,实现基因治疗。
例如,可以将修复基因导入到患者的干细胞或肌肉细胞中,用于治疗遗传性疾病或肌肉萎缩等疾病。
2. 肿瘤治疗:EXO-FECT技术可以用于将抗癌基因或siRNA引入肿瘤细胞中,抑制肿瘤的生长和扩散。
通过靶向修饰细胞外囊泡,可以使基因或siRNA选择性地进入肿瘤细胞内,减少对正常细胞的影响。

人们往往以为,血液、尿液、乳汁和脑脊液这些体液系统是均匀的,不过事情并非这么简单。
蛋白和核酸的确能够在这些体液系统中自由流动。
但也有一些生物分子被包裹在脂质囊泡中,这些囊泡被称为胞外体(Exosome)。
近年来研究者们渐渐发现,这些胞外体中含有大量可以成为生物学指标的分子。
研究者们已经在相应数据库中录入了胞外体的许多分子成分,包括脂质、蛋白和核酸。
比较常用的两个网站是Vesiclepedia和ExoCarta,这两个网站都是澳大利亚La Trobe大学的Suresh Mathivanan开发的。
外泌小体(Exosome)是一种囊泡结构,直径通常在30-150nm,常见于正常体液和病理样本,培养细胞也可分泌。
研究人员已经在血液、唾液、尿液、母乳等中发现外泌小体,其运载的蛋白和核酸涉及其细胞间物资、信息交流,影响和调控着多方面的生理功能,包括肿瘤发生、免疫促进、凋亡调控、血管生成、炎症反应及发育和分化等。
由于在体液中出现,外泌小体对于临床生物标志物检测特别有利。
近年来随着分离纯化技术的提高,关于外泌小体的研究成果颇丰,主要集中于其在细胞间物资交流、通讯方面作用,远期则预计有临床应用的潜力。
因此这一领域已渐成热点。
研究的前提是方便、高效、标准化地分离纯化外泌小体。
这一点上默克密理博已经建立了操作标准(研究通讯备索),相较于需要昂贵的设备及繁琐操作的超速密度梯度离心,用这样的简单流程操作,研究人员对外泌小体的探讨变得简便多了。
超滤方法纯化:简单6步,exosome制备不再成为你的拦路虎∙用Sterifip®真空抽滤对样品进行澄清[目录号SCGP00525; 0.22µm MilliporeExpress PLUS (PES)膜]∙用PBS平衡Amicon® Ultra-15超滤管(目录号UFC901024,10 kDaMWCO),离心4000g X 10 min。
∙从超滤管内管及收集管吸走PBS。

最常用的外泌体提取方法外泌体作为近几年来的研究热点,受到了科研工作者的青睐及追捧。
由于外泌体内携带有大量的miRNA, 少量lncRNA,Mrna 以及DNA蛋白质成为液体活检的潜力无限的研究对相。
所以,获得纯度高、内容物完整的外泌体非常之重要,那么,外泌体的提取方法也显得尤为重要。
一、差速离心法差速离心法可以说是最传统最普遍的外泌体提取方法。
原理是:首先低速离心以除去细胞和细胞凋亡碎片;随后,高速离心以去除大囊泡;最后高速离心以沉淀外泌体。
具体步骤是: 以下所有步骤都在4℃下进行,1、300×g 10min,弃沉淀,去除细胞2、2000×g 20min,弃沉淀,去除死细胞3、10,000×g 30min ,弃沉淀,去除细胞碎片等亚细胞成分4、10,000×g 70min,弃上清,沉淀即为外泌体5、PBS(每10ml细胞培养液用30mlPBS重悬)清洗沉淀物,混匀, 10,000×g 70min6、l ml PBS溶解沉淀(外泌体),立即使用或置于-80℃备用。
7、一般超速离心法会结合密度梯度离心,这样得到的外泌体更纯,具体做法第4步后蔗糖梯度离心,10,000×g 70min,以去除密度大于1.21g/ml的颗粒。
优点是:成本低,操作简单,获得的囊泡数较多。
缺点是:耗时耗力(需用时8-30h,并且每次只能处理6个样本),获得的外泌体纯度不是很高,高速及重复离心也会对外泌体产生很大的伤害,并且不适用于如血浆和血清等粘性液体生物样本。
二、密度梯度离心法该方法由于比较繁琐,用的较少。
原理是:像所有的脂质小囊泡一样,外泌体可以悬浮于特定密度梯度的蔗糖中,其密度范围1.13g/ml-1.21g/ml,将要分离外泌体的样本液体置于梯度蔗糖介质上,随后通过离心将外泌体分离。
此法获得的外泌体纯度较高,但步骤繁琐,耗时,对离心时间极为敏感。
具体步骤是:收集培养2d的上清液。

乳腺癌细胞来源的Exosomes的提取和鉴定赵明芳;曲晶磊;曲秀娟;侯科佐;张晔;刘静;刘云鹏【期刊名称】《山西医药杂志》【年(卷),期】2010(039)001【摘要】目的从MCF-7B乳腺癌细胞培养上清液中分离获得Exosomes,并进行形态学观察鉴定.方法通过低速、高速、超滤及超高速离心等方法, 从MCF-7B乳腺癌细胞培养上清中分离Exosomes, 用透射电子显微镜观察其形态特征,Lorry方法蛋白定量,通过用免疫印记进行组织相容性抗原(MHC)分子鉴定.结果 MCF-7B乳腺癌细胞上清中分泌大量的Exosomes,电镜下观察呈椭圆形或圆形的双层膜的囊泡, 直径为50~100 nm, 具有完整的细胞膜.结论用离心的方法可从MCF-7B乳腺癌细胞培养上清中提取Exosomes,有可能作为乳腺癌免疫治疗潜在的抗原,同时也为研究肿瘤的发病机制提供一个新的途径.【总页数】3页(P10-12)【作者】赵明芳;曲晶磊;曲秀娟;侯科佐;张晔;刘静;刘云鹏【作者单位】中国医科大学附属第一医院,110001;中国医科大学附属第一医院,110001;中国医科大学附属第一医院,110001;中国医科大学附属第一医院,110001;中国医科大学附属第一医院,110001;中国医科大学附属第一医院,110001;中国医科大学附属第一医院,110001【正文语种】中文【相关文献】1.骨肉瘤细胞来源的exosomes制备和鉴定 [J], 董革辉;刘福慧;韩建华;夏本杰;黄俊琼2.喉癌 Hep -2细胞来源的 exosomes 的发现和鉴定 [J], 吉晓滨;梁俊毅;刘启才;谢景华3.胃癌细胞来源的exosome的提取和鉴定 [J], 赵明芳;曲品磊;曲秀娟;侯科佐;张晔;刘静;刘云鹏4.喉癌Hep-2细胞来源的exosomes提取和鉴定 [J], 吉晓滨;梁俊毅;刘启才;谢景华5.成纤维细胞系3T3细胞来源exosome对小鼠乳腺癌细胞增殖能力的影响 [J], 王雅琴;陈智因版权原因,仅展示原文概要,查看原文内容请购买。
Exosome简介,提取,分析(全)一,Exosome简介最近几年,一种叫做Exosome的小囊泡正受到大家广泛的关注。
Exosome 是直径约为30-150nm,密度在1.13-1.21g/m1的小囊泡。
Exosome天然存在于体液中,包括血液、唾液、尿液和母乳,外泌体(Exosome)是活细胞分泌的来源于晚期核内体(也称为多囊泡体)的膜性囊泡。
Exosome在30年前被人们所发现。
早期的研究认为,exosome执行蛋白运输功能,特异靶定受体细胞,交换蛋白和脂类或引发下游信号事件。
直到2007年,研究人员发现exosome也运输核酸,参与细胞间通讯。
总之,其蛋白、RNA 和脂肪成分特异,且携带了一些重要的信号分子,有望在多种疾病的早期诊断中发挥作用,这使得exosome的市场也在快速扩展,并成为热门的研究对象。
不同组织细胞来源exosome由于携带的蛋白质不同,而能够发挥不同的生物学功能。
例如,肿瘤细胞分泌的exosome能够介导血管再生肿瘤细胞增殖及免疫逃逸;而树突状细胞源性exosome则能够引起机体有效的抗肿瘤免疫应答。
目前研究发现,Exosome内含有与细胞来源相关的蛋白质rRNA和microRNA,并且exosome 能够通过生物屏障,在细胞间传递功能性核酸分子,从而发挥各种生物学功能,故exosome有望成为一种新型给药途径及基因治疗载体。
Exosome携带蛋白质包括源细胞非特异性和源细胞特异性两类蛋白分子。
前者可能与exosome的生物发生和生物学作用有关,主要包括:细胞溶质蛋白、参与细胞内信号转导的蛋白、各种代谢酶、热休克蛋白和四跨膜蛋白;另一类是特殊蛋白质,这类蛋白质只存在于某种特殊的细胞分泌的exosome,而这些特定细胞源的exosome与其生物学功能有着密切联系,例如分子来源的Exosome上含有MHCII类分子。
二,Exosome提取Exosome是由活细胞分泌的,它是一种亚细胞成分,组要成分是磷脂双分子和携带的膜性分子,其界定依据形态学和生物化学及提取方式不同细胞源的exosome是不同的,这些不同的理化性质有利于exosome的提取。
外泌体提取的具体方法及步骤
一、技术简介
外泌体(Exosome)是由细胞分泌而来的微小囊泡,直径约为30-200 nm,密度在1.13-1.21g/ml,具有杯状形态、双层膜结构,天然存在于血液、尿液、唾液、母乳和细胞培养基等生物体液中。
包括肿瘤细胞在内几乎所有类型的细胞(免疫细胞、神经细胞、干细胞),都可以产生并释放exosome。
目前外泌提取主要有超速离心、过滤离心、试剂盒提取等方法。
本司采取超速离心分离得到外泌体,纯度高,得率大,满足于后续不同实验的需求。
二、实验流程
血清/血浆样本:
1. 分离得到血浆/血清。
2. 低速离心去除碎片及杂质。
3. 超速离心获得外泌体沉淀。
4. 外泌体纯化。
5. BCA法检测外泌体浓度。
6. 提供实验报告。
培养上清样本:
1. 培养液收集。
2. 低速离心去除细胞、碎片及杂质。
3. 超速离心获得外泌体沉淀。
4. 外泌体纯化。
5. BCA法检测外泌体浓度。
6. 提供实验报告。
从细胞培养上清液中分离Exo的步骤用含胎牛血清的标准生长介质在14cm细胞培养皿中培养细胞,直到细胞浓度达到70%~80%用1×PBS洗一次细胞以除去FCS残留,再用无血清的培养基(15ml/盒)培养24~48h用Exo耗尽的胎牛血清交替培养(FCS 100000 rpm, 4 ℃离心过夜,取上清液过滤除菌)NOTE 1. Alternatively, medium for Exo production can be supplemented with the Exo-depleted fetal calf serum (FCS). For the depletion, FCS should be centrifuged overnight by 100,000 × g , 4 °C; the supernatants filter-sterilized and applied instead of FCS; the pellets containing FCS Exo can be discarded.控制细胞活性,取上清液,以减少Exo凋亡的或其他类型的气泡污染,细胞活力应与在FCS培养基培养的细胞相当。
收获细胞上清液,取大概200ml做实验。
2000 g 15min 4℃离心弃细胞碎片取上清5000 g 15min 4℃离心弃大囊泡取上清NOTE 2. According to our experience, higher Exo yield can be enriched if fresh cell culture supernatants are used for the Exo isolation. If it is desired to store supernatants prior proceeding with the isolation protocol, cell debris should be removed (proceed until step 6 of the protocol). Then protease inhibitors should be added to the supernatants to prevent Exo degradation. Supernatants can be stored for several weeks at −80 °C. However, according to our observations, amount and biological activity of Exo might be significantly decreased after storage.12000 g 30min 4℃离心弃大囊泡取上清Pellets can be discarded; alternatively, if examination of MVs is desired, pellets after centrifugation by 12,000 × g should be carefully resuspended in a small volume, e.g., 100 μl of 1× PBS supplemented with protease inhibitors and stored at −80 °C.0.22μm过滤以保证大碎块完全除去取滤液110 000 rpm 120min 4℃超离心取Exo沉淀NOTE 3. If a fixed-angle rotor (45Ti or 50.2 Ti) for centrifugation of large volumes is not available, a concentration step can be included into the protocol after the cell culture supernatants were filtered through the 0.22 μm filter. For the concentration of supernatants to a desired volume, a stirred cell can be used, for instance, 8400 (Millipore) supplied with ultrafiltration disks made of regenerated cellulose (Ultracel Amicon Ultrafiltration Discs, 100 kDa).用1×PBS洗Exo沉淀再110 000 rpm 90min 4℃超离心取Exo沉淀每200~300ml细胞培养上清液,用100μl含蛋白酶抑制剂的1×PBS重悬,-80℃保存。
外泌体透射电镜样品的制备方法摘要:外泌体透射电镜样品的制备方法 1外泌体透射电镜样品的制备方法 1外泌体(exosom)是细胞外囊泡(extracellular vesicle,EV)中的重要组成部分,由于他们含有丰富的生物标志物,在细胞的社交网络里充当重要角色,作为生物学研究中的一个新兴领域越来越受到关注。
根据国际细胞外囊泡协会2014年发表的一个指导手册(MISEV),用透射电镜来观察样品中细胞外囊泡的形态特征是鉴定EV的基本方法之一。
外泌体的30~150nm杯状膜性微囊结构,可采用透射电镜负染色技术观察记录。
(1)试验样品的准备实验样品为脐静脉内皮细胞源的外泌体小泡。
提取方法如下。
①梯度离心细胞培养基先后300g(10min)、2000g (10min)、18000g(30min),4℃低温离心,离心后收取上清液,0.22μm滤器过滤,以去除培养基中的死细胞、细胞碎片、微泡及凋亡小体。
②超滤将上述培养基用于1×105超滤管浓缩为2mL左右。
③蔗糖重水垫将0.6mL的300g/L蔗糖重水溶液(密度1.210g/cm3)加到超离管中,将含有外泌体的液体小心加到蔗糖重水垫的上方,以PBS缓冲液补足体积。
使用超速离心机以110000g速度4℃低温离心70min。
④吸弃上层PBS,收集含有外泌体的蔗糖重水层,以10mL左右冷PBS稀释后加到1×105超滤管中浓缩为0.2mL左右。
将上述0.2mL超滤液加到超离管中,以PBS补足体积,超速离心机110000g低温离心70min,管底可见黄白色沉淀物。
⑤弃上清,将沉淀物以4mL冷PBS重悬,110000g低温离心70min,弃上清,所得沉淀物即为纯化后的外泌体。
采用BCA 试剂盒定量。
-80℃冰箱保存。
注意所有离心都必须在4℃低温进行。
(2)实验试剂与材料准备①新鲜配制的PBS缓冲液(pH 7.4)。
②2.5%戊二醛固定液(pH7.0~7.4)。
巨噬细胞外泌体提取方法摘要:一、引言二、巨噬细胞外泌体的功能与作用三、巨噬细胞外泌体的提取方法1.细胞培养2.收集细胞培养液3.离心分离4.制备外泌体富集液5.纯化外泌体四、提取过程中的注意事项五、外泌体的应用领域六、总结正文:一、引言巨噬细胞外泌体(Macrophage exosomes)作为一种具有生物活性的纳米级囊泡,含有丰富的生物信息物质,如蛋白质、核酸和代谢物等。
在生物学、医学研究领域备受关注。
本文将介绍一种简便、有效的巨噬细胞外泌体提取方法,以供研究者参考。
二、巨噬细胞外泌体的功能与作用巨噬细胞外泌体具有多种生物学功能,如传递信号、调控免疫反应、参与细胞间通讯等。
此外,外泌体在疾病发生与发展过程中起着关键作用,如肿瘤发生、炎症反应和神经退行性疾病等。
因此,对巨噬细胞外泌体的研究有助于深入探讨相关疾病的发病机制,为临床诊断和治疗提供新思路。
三、巨噬细胞外泌体的提取方法1.细胞培养:选择合适的巨噬细胞株,如RAW264.7,进行体外培养。
可用含有10%胎牛血清的RPMI-1640培养基进行传代培养。
2.收集细胞培养液:将培养皿中的细胞培养液倒入离心管中,注意避免剧烈振荡,以免破坏外泌体结构。
3.离心分离:将收集到的细胞培养液进行低速短时间离心,如300×g离心5分钟,以去除细胞碎片和其他杂质。
4.制备外泌体富集液:将离心后的上清液转移至新的离心管中,再次进行高速长时间离心,如1000×g离心30分钟,使外泌体富集于上清液中。
5.纯化外泌体:采用超速离心法,如10000×g离心1小时,收集沉淀物,即为纯化的巨噬细胞外泌体。
四、提取过程中的注意事项1.细胞培养过程中要保证无菌操作,避免外源性污染。
2.离心过程中,根据实验需求选择合适的离心速度和时间。
3.制备外泌体富集液时,可采用多次离心方法,以提高外泌体富集效果。
4.纯化外泌体时,注意超速离心的条件,避免过度离心导致外泌体破裂。
尊敬的编辑部老师:您们好!我们已按照外审专家的意见,对文章进行了修改,修改部分用红色标注了。
现对审稿人提出的意见逐条回答如下:第一审稿人意见:<1>探索研究一种提取exosome的方法具有鲜明的创新意义。
但本文少有欠缺在于没用与经典的超速离心方法进行比较,也没有对效率进行评价研究,仅仅报道了可以提取出exosome,若能增加这些研究内容则更好。
若既往未见超滤提取的报道,建议标题该为:“旋转超滤:一种提取细胞外泌体的新方法”。
我们使用100kDa NWCO超滤膜能够截留分子量在100Kda的物质,即相当于分子直径在40nm以上的物质,而分子量小于100KDa的物质被过滤除去,以达到提取exosome 的目的。
前期步骤如弃除细胞碎片等与经典的超速离心方法相同,文献中报道使用超速离心法从106个BMSCs的细胞培养基中提取约5.62μg exosome(见文中引用文献13),我们从每106个BMSCs的细胞培养基中平均能提取约7.2ug的exosome,由于旋转超滤避免了超速离心的高压力对微泡损害引起的损失,因此提取的exosome的质量应该优于超速离心方法。
旋转超滤的最主要优势是避免了对超速离心机的依赖,有利于大家对exosome的研究。
此次研究我们虽没有使用超速离心技术进行对比,但与现有文献对比已可说明旋转超滤技术的优势。
目前尚未见用旋转超滤技术提取exosome的报道,按照审稿人意见,我们将题目改为“旋转超滤:一种提取细胞外泌体的新方法”。
二、第二审稿人一审意见:发明一种合适的外泌体分离和纯化的方法,保证外泌体的含量、纯度及生物活性,对深入开展外泌体特性及其功能的研究具有重要意义。
因此,本文具有较好的创新性,但存在以下几方面的问题需要改进:<1>首先也是最重要的,作为一种可能的优化方案,除了在讨论中分析其他分离方法的缺陷和不足外,需要从外泌体的含量、纯度及生物活性等三方面数据与其他实验方案进行比较,才能体现新方法的优越性(其他方案的数据可以引用文献)。
细胞培养基上清提取外泌体
外泌体产生细胞(Exosome源细胞)的选取:
293T细胞:常用于基因改造外泌体;
Mouse immature dendritic cells(imDCs):小鼠未成熟的树突细胞,常用于小鼠in vivo 体内反应使用,产生的外泌体引起的免疫反应极小;
Mouse lymphoma cell line(EL-4):小鼠淋巴细胞;
各类癌细胞系:常用于研究各个癌产生的外泌体本身特性研究:
……
不同实验的需求不同, Exosome源细胞的细胞选择不同,例如:需要基因改造就选择较容易感染的293T,体内实验就要避免机体的免疫反应,要充分了解实验要求和各个细胞系背景。
Exosome源细胞用量:
以293T为例,2个15cm盘=4.5个10cm 盘=4*107 cells,最终的Exosome 20ul/20ul 可用于体内原位癌3*104/1ul注射给药,15ul/50ul 可用于105 受体细胞培养加药。
P S: 王红阳方法1ug Exosome=5*106 cells,原位癌注射用量5ug,105细胞培养用量1ug。
我约莫算了一下,差不多。
楼上的方法不要定量,更简单方便,以楼上为主。
以293T细胞为例制备Exosome:
1.2盘10cm 盘在60-70%进行病毒感染,1盘感染GFP(control病毒),1盘感染plv-cs
2.0-myc-PD1,病毒感染后16-18h后换液;
2.36-48h后进行传代:准备10盘10cm盘,每盘加入15ml Exosome-free的10%血清的DMEM,放入37°C培养箱备用。
取出2感染好的2盘细胞,迅速用5ml PBS/遍洗涤3遍,加入1ml胰酶,摇匀使每个细胞都孵育胰酶,37°C静置消化1min,加入4ml Exosome-free 的10%血清的DMEM静置,获得5ml细胞悬液,加入到准备好的10盘10cm盘中,获得5盘GFP、5盘plv-cs2.0-myc-PD1稳转293T 细胞系,37°C培养48h;
3.取4根灭菌处理过的50ml管,收集细胞培养基,分装成37.5ml GFP、plv-cs2.0-myc-PD1各两管,进行三步法离心:
✓4°C离心200-300g,5min去细胞,分别小心吸取上清34ml入新的灭菌50ml 管;
✓4°C离心12,000-16,000g,45min去碎片,分别吸取31ml上清入新的灭菌50ml 管,0.22um滤膜(Millipore)过滤,最后62ml左右汇入一管Beckman快速密
封管Beckman Quick seal tubes;
✓Beckman 70Ti 转子4°C超离100,000-110,000g,90-120min,弃上清,用50ul PBS重悬exoxome。
3’.收取上清,进行三步法离心:200-300g 5min去细胞;12,000-16,000g 45min去碎片,0.22um滤膜过滤,用100kDa的超滤管(Millipore)将上清浓缩至200ul,加入15ml PBS 浓缩至50ul。
4.取 1、3、5、15ul/50ul 的Exosome 加入105受体细胞中,培养48h,观察或检测目的基因、药物的摄入情况。
(GFP观察荧光,RNA用RT-PCR,蛋白用WB)。