江西省南昌市新建二中2013-2014学年高二下学期化学周练2(实验班)
- 格式:doc
- 大小:364.50 KB
- 文档页数:4

新建二中2011—2012学年度高三下学期化学周练(一)考试内容:有机化学基础考试时间:2012-02-17命题人:王峰审题人:高三化学备课组1.生活中常常碰到涉及化学知识的某些问题,下列叙述正确的是()①生活中常用的普通肥皂是由高级脂肪酸钠盐制成的②甲醛溶液具有良好的杀菌作用,可用于浸泡海产品保鲜③变质的油脂有难闻的特殊气味,是由于油脂发生了水解反应④棉花和木材的主要成分都是纤维素,禽类羽毛和蜘蛛丝的主要成分是蛋白质⑤蜂蚁叮咬人的皮肤将分泌物甲酸注入人体,此时可在患处涂抹小苏打或稀氨水⑥木糖醇(C5H12O5)是一种甜味剂,它属于多羟基化合物,与葡萄糖互为同系物A.①④⑤B.②③⑥C.①②④⑤D.全部2.下列有关实验的叙述中,不正确...的有()①蒸干AlCl3溶液可得纯净的无水氯化铝;②试管里加入少量淀粉,再加入一定量稀硫酸,加热3~4分钟,然后加入银氨溶液,片刻后管壁上有“银镜”出现;③无法用分液漏斗将甘油和水的混合液体分离;④用酸式滴定管量取20.00mL高锰酸钾酸性溶液;⑤为了测定某溶液的pH,将未经湿润的pH试纸浸入到待测溶液,过一会取出,与标准比色卡进行对比;⑥苯与溴水在铁粉的催化作用下制备溴苯;⑦配制银氨溶液时,将稀氨水慢慢滴加到硝酸银溶液中,产生沉淀后继续滴加到沉淀刚好溶解为止;⑧在苯酚溶液中滴入少量稀溴水溶液中立即出现白色沉淀。
A.4句B.5句C.6句D.7句3.下列有机物命名正确的是()A.1,3,4-三甲苯B.2-甲基-2-氯丙烷C.2-甲基-1-丙醇D.2-甲基-3-丁炔4.分子式为C8H18的烷烃中,含有4个甲基的同分异构体的数目是()A.5种B.6种C.7种D.8种5.分子式为C5H11Cl的卤代烃,其分子中含有两个—CH3,两个—CH2—,一个和一个—Cl,它可能的结构有()A.2种B.3种C.4种D.5种6.三氯生是一种抗菌剂,其结构如右图所示,遇含氯自来水能生成有毒的三氯甲烷。

精 品 试 卷高中化学学习材料(灿若寒星**整理制作)新建二中2014-2015学年下学期高三化学实验班周练(四)考试范围:综合 命题人:王峰考试时间:2015、3、25 审题人:高三化学备课组 1.化学与生产、生活、社会密切相关。
下列有关说法中,正确的是( )A .明矾水解时产生具有吸附性的胶体粒子,可以用于饮用水的杀菌消毒B .SiO 2制成的玻璃纤维,由于导电能力强而被用于制造通讯光缆C .鼓励汽车、家电“以旧换新”,可减少环境污染,发展循环经济,促进节能减排D .焰火“脚印”、“笑脸”,使北京奥运会开幕式更加辉煌、浪漫,这与高中化学中“焰色反应”的知识相关,焰色反应是化学变化2.设N A 为阿伏加德罗常数的值,下列说法中正确的是( )A .100mL 1mol·L -1AlCl 3溶液中含阳离子数等于0.1N AB .标准状况下,22.4L CCl 4中含有CCl 4分子数为N AC .将2mL 0.5mol·L -l Na 2SiO 3溶液滴入稀盐酸中制得H 2SiO 3胶体,所含胶粒数为0.001N A D .一定条件下,2.3gNa 完全与O 2反应生成3.6g 产物时失去的电子数为0.1N A3.下列离子方程式正确的是( )A .等物质的量的NH 4HCO 3与Ba (OH )2溶液混合后加热:NH +4+OH -=====△NH 3↑+H 2OB .酸性淀粉碘化钾溶液在空气中变蓝:4I -+O 2+4H +=2H 2O +2I 2C .1molCl 2通入含1mol FeI 2的溶液中:2Fe 2++2I -+2Cl 2=2Fe 3++4Cl -+I 2D .将过量SO 2通入Ba (NO 3)2溶液中:3SO 2+2NO 3-+3Ba 2++2H 2O =3BaSO 4↓+2NO ↑+4H +[4.下列有关溶液组成的描述合理的是( )A .在Fe 2(SO 4)3溶液中可以大量存在: K +、Fe 2+、Cl -、B r -、SCN -B .c(H +)=1×10-13mol/L 的溶液中可以大量存在:Mg 2+、Cu 2+、HCO 3-、NO 3-C .加水稀释时c(OH -)/c(H +)值增大的溶液中可大量存在:MnO 4-、CO 32-、K +、NH 4+D .在碱性溶液中可以大量存在:S 2O 32- 、AlO 2-、SiO 32-、S 2-、Na + 5.下列有关热化学方程式的叙述正确的是( )A .已知2H 2(g)+O 2(g)=2H 2O(g) ΔH =-483.6 kJ·mol -1,则氢气的燃烧热为241.8kJ·mol -1B .已知C (石墨,s )=C (金刚石,s ) ΔH =+1.9kJ·mol -1,则金刚石比石墨稳定C .含0.5mol NaOH 的稀溶液与稀醋酸完全中和,放出26.7kJ 的热量,则表示该反应中和热的热化学方程式为:OH -(aq )+H +(aq )=H 2O (l ) ΔH =-53.4kJ·mol -1D .已知2H 2S (g )+ O 2(g )= 2S (g )+2H 2O (l ) ΔH 1 ;2H 2S (g )+ 3O 2(g )=2SO 2(g )+2H 2O (l )ΔH 2, 则ΔH 1>ΔH 26.X 、Y 、Z 、R 、W 是原子序数依次增大的五种短周期元素。
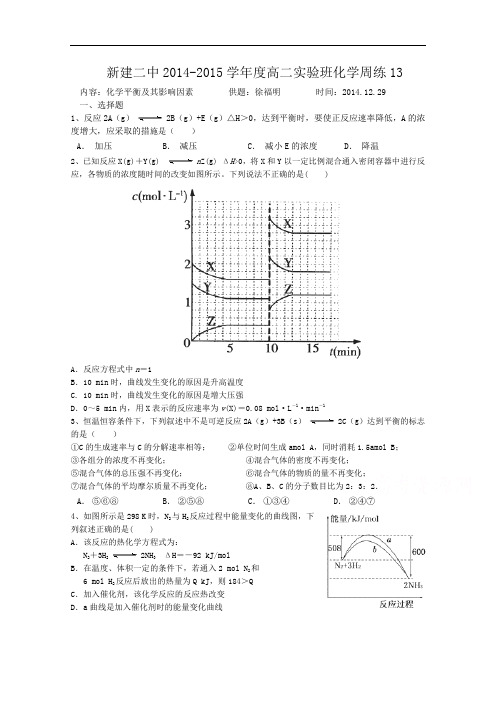
新建二中2014-2015学年度高二实验班化学周练13内容:化学平衡及其影响因素供题:徐福明时间:2014.12.29一、选择题1、反应2A(g)2B(g)+E(g)△H>0,达到平衡时,要使正反应速率降低,A的浓度增大,应采取的措施是()2、已知反应X(g)+Y(g) n Z(g) ΔH>0,将X和Y以一定比例混合通入密闭容器中进行反应,各物质的浓度随时间的改变如图所示。
下列说法不正确的是( )A.反应方程式中n=1B.10 min时,曲线发生变化的原因是升高温度C. 10 min时,曲线发生变化的原因是增大压强D.0~5 min内,用X表示的反应速率为v(X)=0.08 mol·L-1·min-13、恒温恒容条件下,下列叙述中不是可逆反应2A(g)+3B(s)2C(g)达到平衡的标志的是()①C的生成速率与C的分解速率相等;②单位时间生成amol A,同时消耗1.5amol B;③各组分的浓度不再变化;④混合气体的密度不再变化;⑤混合气体的总压强不再变化;⑥混合气体的物质的量不再变化;⑦混合气体的平均摩尔质量不再变化;⑧A、B、C的分子数目比为2:3:2.4、如图所示是298 K时,N2与H2反应过程中能量变化的曲线图,下列叙述正确的是( )A.该反应的热化学方程式为:N2+3H22NH3ΔH=-92 kJ/molB.在温度、体积一定的条件下,若通入2 mol N2和6 mol H2反应后放出的热量为Q kJ,则184>QC.加入催化剂,该化学反应的反应热改变D.a曲线是加入催化剂时的能量变化曲线5、在容积不变的密闭容器中,在一定条件下发生反应:2A(?) B (g)+C(s),且达到平衡,当升高温度时,容器内气体的密度变大,则下列判断错误的是A.若正反应为吸热反应,则A为非气态B.若正反应为放热反应,则A为气态C.若在平衡体系中加入少量C,则该平衡不移动D.压强对该平衡的移动无影响6、已建立化学平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动时,下列有关叙述正确的是①生成物的百分含量一定增加②生成物的产量一定增加③反应物的转化率一定增大④反应物浓度一定降低⑤正反应速率一定大于逆反应速率⑥使用了合适催化剂A.①② B.②⑤ C.③⑤D.④⑥7、将相等物质的量的CO和H2O(g)混合,在一定条件下反应:CO(g)+ H2O(g)CO2(g)+ H2(g),达到平衡后CO的转化率为25%,平衡混合气体的密度是相同条件下氢气的倍数是A.46 B.23 C.11.5 D.5.758、一定温度下,向容积恒定的密闭容器中投入2molA和1molB,发生如下可逆反应:2A(g)+B(g)C(g)+D(s)。


新建二中2012-2013学年高三化学周练22命题:袁明 2013-3-15试题说明:1.本试卷满分为100分. 2.考试时间为120分钟Ⅰ卷(共48分)可能用到的相对原子质量:H:1 Na:23 K:39 N:14 C:12 O:16 Al:27 Ba:137一、选择题(本题包括16小题,每小题3分,共48分,每小题只有一个选项符合题意)1、下列与含氯化合物有关的说法正确的是【】A.HClO是弱酸,所以NaClO是弱电解质B.向沸水中逐滴加入少量饱和FeCl3溶液,可制得Fe(OH)3胶体C.HCl溶液和NaCl溶液均通过离子导电,所以HCl和NaCl均是离子化合物D.电解NaCl溶液得到22.4LH2(标准状况),理论上需要转移N A个电子(N A表示阿伏加德罗常数)2、下列离子方程式书写正确的是【】A.用铂电极电解氯化镁溶液:Cl-+2H2O Cl2↑+H2↑+2OH-B.NaHSO4溶液中滴入Ba(OH)2溶液至中性:H++SO42-+Ba2++OH-===BaSO4↓+H2O C.在H2O2中加入酸性KMnO4溶液:2MnO4-+5H2O2+6H+====2Mn2+ +5O2↑+8H2OD.溴乙烷与6mol/L氢氧化钠水溶液共热:C2H5Br +OH-CH2=CH2↑+Br-+H2O3、下列卤族元素的有关实验,说法正确的是【】A.往稀米粥中加入少量加碘食盐,能检验食盐中是否含碘B.已知I3- I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫红色,说明KI3在CCl4中的溶解度比在水中的大C.用溴水即可鉴别苯酚溶液、2,4-己二烯和苯D.浓盐酸长期暴露在空气中因为见光分解而浓度降低4、常温下,下列各组离子在给定条件下一定能大量共存的是【】A.在pH=0的溶液中:I-、Ca2+、NO3-、NH4+B.存在大量Fe2+的溶液:Cl-、Na+、NO3-、SO42-C.在由水电离出的c(OH-)=10-13mol·L-1的溶液中:ClO-、Na+、SO32-、Cl-D.在c(OH-)=10-13 mol·L-1的溶液中:Na+、S2-、AlO2-、SO32-5、下列关于原子结构、元素性质的说法正确的是【】A.非金属元素组成的化合物中只含共价键B.IA族金属元素是同周期中金属性最强的元素C.同种元素的原子均有相同的质子数和中子数D.ⅦA族元素的阴离子还原性越强,其最高价氧化物对应水化物的酸性越强6、下列实验操作正确的是【】A.中和滴定实验时,用待测液润洗锥形瓶B.盛放NaOH溶液时,使用带玻璃塞的磨口瓶C.用苯萃取溴水中的溴时,将溴的苯溶液从分液漏斗下口放出D.NaCl溶液蒸发结晶时,蒸发皿中有晶体析出并剩余少量液体即停止加热7、下列图示实验合理的是【】A .图1为证明非金属性强弱:S C Si >>B .图2为制备少量氧气C .图3为配制一定浓度硫酸溶液D .图4为制备并收集少量NO 2气体 8、将磁性氧化铁放入稀HNO 3中可发生如下反应:3Fe 3O 4+ 28HNO 3=9Fe(NO 3)x + NO ↑+14H 2O 。

新建二中2013-2014学年度高三化学实验班周练(13)一.单项选择题(每小题3分,共48分)1.化学在人类生活中扮演着重要角色,以下应用正确的是()A.食盐是咸味剂,工业上常用电解饱和食盐水制备氯气和钠B.在结冰的路面上撒盐,是利用盐与水发生化学反应放出大量热量,促使冰雪融化C.用浸泡过高锰酸钾溶液的硅土吸收水果释放的乙烯,可达到水果保鲜的目的D.太阳能电池板中的硅是二氧化硅,光导纤维的主要成分是硅单质2.Na2O2、Cl2和SO2均能使品红溶液褪色(N A为阿伏加德罗常数的值)。
下列说法正确的是( )A.在Na2O2中阴阳离子所含的电子数目相等B.标准状况下,1 mol Na2O2和22.4LSO2反应,转移电子数目为N AC.等物质的量的Cl2和SO2同时通入品红溶液中,品红褪色更快D.Na2O2、Cl2、SO2依次属于电解质、单质、非电解质3.氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:3SiO 2+6C+2N2Si3N4+6CO。
下列叙述不正确...的是()A.若已知上述反应为放热反应,升高温度,其平衡常数减小B.上述反应中每生成1molSi3N4,N2得到12mol电子C.在氮化硅的合成反应中,N2是还原剂,SiO2是氧化剂D.若使压强增大,上述平衡向逆反应方向移动4.下列正确的叙述有()① CO2、NO2、P2O5均为酸性氧化物② Ca(HCO3)2、Fe(OH)3、FeCl2均可由化合反应制得③泡沫灭火器的药品是纯碱和硫酸铝④熔融氢氧化钠固体不能用瓷坩埚和刚玉坩埚⑤灼热的炭与CO2反应、Ba(OH)2·8H2O与NH4Cl的反应均既属于氧化还原反应,又是吸热反应⑥C、S分别在空气中燃烧均可得到两种不同的氧化物⑦普通玻璃的主要成分是纯碱、石灰石和二氧化硅⑧铝箔在酒精灯火焰上加热熔化但不滴落,因为铝箔表面的氧化铝熔点高于铝⑨明矾和漂白粉常用于自来水的净化和杀菌消毒,两者的作用原理相同⑩“光化学烟雾”与碳氢化合物和氮氧化合物的大量排放有关A.3个 B.4个 C.5个 D.6个5.常温条件下,下列溶液中的各组离子一定能够大量共存的是( )A.pH=1的溶液:Na+、Fe2+、Cl-、NO3-B.含有大量I-的溶液:ClO-、Na+、Cl-、CO32-C.加入铝粉能放出大量H2的溶液:K+、Cl-、SO42-、NO3-D.c(H+)/c(OH-)=1010 mol·L-1的溶液:NH4+、Na+、SO42-、Fe3+6.混合下列各组物质使之充分反应,加热蒸干产物并在300℃灼烧至质量不变,最终残留固体不是纯净物的是( )A.向Fe、FeO和Fe2O3的混合物中加入过量氯水B.等物质的量的 NaHCO3与 Na2O2固体C.等物质的量浓度、等体积的(NH4)2SO4与 BaC12溶液D.在NaBr溶液中通入过量氯气7.化学中常用图像直观地描述化学反应的进程或结果。
新建二中2013-2014学年高三实验班化学周练二十四可能用到的相对原子质量:H:1 Na:23 K:39 N:14 C:12 O:16 Al:27 Ba:137 As:75 一、选择题(本题包括16小题,每小题3分,共48分,每小题只有一个选项符合题意)1.下列叙述正确的是:①离子化合物中不一定含有金属阳离子;②分子晶体中不一定含有共价键;③有机物中不一定都含有氢元素;④酸酐都能直接与水反应生成相应的酸;⑤酸与碱混合都只发生中和反应;⑥酸式盐溶于水得到的溶液都显酸性;A、只有①②B、只有①②③C、只有③⑤⑥D、只有①②④⑥2、设N A表示阿伏加德罗常数,下列叙述中正确的是①31g白磷含有的P—P键数为N A② 1mol3CH(碳正离子)中含有电子数为10N A③1mol铜与足量硫蒸气反应,转移电子数为2N A④用惰性电极电解CuCl2溶液,阴极析出32g铜时,线路中通过的电子数为N A⑤0.84 g3NaHCO晶体中阳离子和阴离子总数为0.03N A⑥3.9gNa2O2吸收足量的CO2时转移的电子数是0.05N A⑦标准状况下,3.2g铜与足量的浓硝酸反应生成的气体含有的分子数一定是0.1N AA.①②④ B.④⑥ C.③④⑤ D.④⑥⑦3、下列实验操作能够达到实验目的的是()A.实验室采用图①所示装置收集SO2B.可用图②所示装置比较KMnO4、Cl2、S的氧化性强弱C.实验室制取的溴乙烷中常含有少量溴,加适量的苯,振荡、静置后分液,可除去溴乙烷中的溴D.称取0.40 g NaOH,置于100 mL容量瓶中加水至刻度线,可配制0.10 mol/L NaOH溶液4、下列实验现象及相关的离子方程式均正确的是A、C12与FeI2溶液反应,当以n(C12)︰n(FeI2)=1︰1时:2Fe2+ +2I- +2C12 =2Fe3+ +I2 +4Cl-B、向BaC12溶液中通入S02气体,出现白色沉淀: Ba2+ +SO2 +H2O==BaSO3↓ +2H+C、把Fe(OH)2固体投入到稀HNO3中:Fe(OH)2+2H+=Fe2++2H2OD、将等物质的量浓度、等体积的Ba(OH)2溶液和NaHS04溶液混合,生成白色沉淀:Ba2++SO42‾+H++OH‾ ==BaSO4↓+H2O5、X、Y、Z是原子序数依次递增的短周期元素,3种元素的原子核外电子数之和与Ca2+的核外电子数相等,X、Z分别得到一个电子后均形成稀有气体原子的稳定电子层结构。
江西省南昌市第二中学2013—2014学年度高二下学期期中考试化学试卷可能用到的相对原子质量: H-1 C-12 O-16一、选择题〔每一小题只有一个选项符合题意,每一小题3分,共48分〕1.如下关于醇和酚的说法中,正确的答案是:A.含有羟基的化合物一定是醇 B.分子内有苯环和羟基的化合物一定是酚C.苯甲醇与2-甲基苯酚互为同分异构体D.酚和醇具有一样的官能团,因而具有一样的化学性质2.右图是一种有机物的比例模型,该模型代表的有机物可能是:A.饱和一元醇 B.羟基酸C.羧酸酯 D.饱和一元醛3.有机物具有如下性质:能发生银镜反响,滴入石蕊试液不变色,参加少量碱液并滴入酚酞试液,共煮后红色消失。
原有机物是如下物质中的:A.甲酸乙酯 B.乙酸甲酯 C.乙醛 D.甲酸4.如下除去杂质的方法正确的答案是:① 除去乙烷中少量的乙烯:光照条件下通入Cl2,气液别离;② 除去乙酸乙酯中少量的乙酸:用饱和碳酸钠溶液洗涤,分液、枯燥、蒸馏;③ 除去苯中混有的少量苯酚:参加浓溴水后过滤取滤液;④ 除去乙醇中少量的乙酸:加足量生石灰,蒸馏。
A.① ② B.② ④ C.③ ④ D.② ③5.某有机物中有一个C6H5—,一个—CH2—,一个—C6H4—,一个—OH,如此该有机物中能使FeCl3溶液显紫色结构有:A.二种 B.三种 C.四种 D.五种6.如下离子方程式正确的答案是:A.实验室用大理石与醋酸反响制取二氧化碳:CaCO3+2H+=Ca2++CO2↑+H2OB.氯乙酸与氢氧化钠溶液共热: CH2ClCOOH+OH-→CH2ClCOO-+H2OC.苯酚钠溶液中通入少量二氧化碳: 2C6H5O-+CO2+H2O→2C6H5OH+CO23D.用银氨溶液检验乙醛中的醛基:CH3CHO +2Ag(NH3)2+ + 2OH-CH3COO- + NH4+ +3NH3+ 2Ag↓+ H2O7.如下关于苯酚的表示中,错误的答案是......:A.其水溶液显酸性,俗称石炭酸B.其浓溶液对皮肤有强烈的腐蚀性,如果不慎沾在皮肤上,应立即用酒精擦洗C.其在水中的溶解度随温度的升高而增大,超过65℃可以与水以任意比互溶D.碳酸氢钠溶液中滴入苯酚的水溶液后会放出二氧化碳8.食品香精菠萝酯的生产路线〔反响条件略去〕如下:如下表示错误的答案是:A .步骤〔1〕产物中残留的苯酚可用FeCl 3溶液检验 B .苯酚和菠萝酯均可与酸性KMnO 4溶液发生反响 C .苯氧乙酸和菠萝酯均可与NaOH 溶液发生反响 D .步骤〔2〕产物中残留的烯丙醇可用溴水检验9.化合物丙由如下反响得到:C 4H 10O C 4H 8C 4H 8Br 2 甲 乙 丙 丙的结构简式不可能是:A .CH 3CH 2CHBrCH 2BrB .CH 3CH(CH 2Br)2C .CH 3CHBrCHBrCH 3D .(CH 3)2CBrCH 2Br10.某有机物的结构简式为,它在一定条件下可能发生的反响是:①加成;②水解;③酯化;④氧化;⑤中和;⑥消去;⑦复原A .①③④⑤⑥⑦ B.①③④⑤⑦ C.①③⑤⑥⑦ D. ②③④⑤⑥ 11.某有机物分子中含有强复原性基团,将其与苛性钠溶液共煮后,可得到两种有机物,其中一种仍有强复原性,如此该有机物可能是:A .B .C .D . 12.S – 诱抗素的分子结构如右图所示,它可以保证鲜花盛开。
新建二中2013-2014届高三实验班化学周练五一、选择题(本题包括16小题,每小题3分,共48分,每小题只有一个选项符合题意) 1.SO2是常见的大气污染物之一,下列措施中能够减少SO2排放量的是( )①用天然气代替煤炭作民用燃料②使用水煤气或干馏煤气作燃料③硫酸厂使用V2O5作催化剂,加快SO2的转化速率④将块状煤粉碎,提高其燃烧效率⑤在煤中加入生石灰后燃用⑥循环处理吸收塔放出的尾气A.①②③④⑤ B.①③⑤⑥ C.①②⑤⑥ D.②③④⑥2.化学反应经常伴随着颜色变化,下列关于颜色的叙述正确的是()①淀粉溶液遇碘化钾——蓝色②FeSO4溶液中加入KSCN——红色③溴化银见光分解——白色④FeCl3溶液中加入铁粉——无色⑤新制氯水久置后——无色⑥过氧化钠在空气中久置——淡黄色⑦Fe(OH)2遇空气——红褐色⑧石蕊试液中通二氧化硫气体——无色⑨无水硫酸铜吸收水蒸气——浅绿色⑩含有酚酞的NaOH溶液中通入Cl2—红色A.2个B.3个C.4个D.5个3.下列说法中不正确的有()①氯气与烧碱溶液或石灰乳反应都能得到含氯消毒剂;②光照氯水有气泡逸出,该气体是Cl2;③燃煤时加入适量石灰石,可减少废气中SO2的量;④pH在5.6~7.0之间的降水通常称为酸雨;⑤室温下浓硫酸与铜片不会发生剧烈的化学反应,原因是铜被钝化。
⑥氯气易液化,液氯可以保存在钢瓶中;⑦常温下浓硫酸可以用铝制容器盛放;⑧分解高锰酸钾制氧气后,残留在试管内壁上的黑色物质可用稀盐酸洗涤A.2个B.3个C.4个D.5个4.按如图实验,反应后可能出现的现象是()A.a装置中有白色固体B.b装置中产生白色沉淀C.c装置中溶液先变红后褪色D.d装置中溶液变蓝色5.下列实验能证明某无色气体一定为SO2的是()①能使澄清石灰水变浑浊②能使湿润的蓝色石蕊试纸变红③能使品红试液褪色,加热后又显红色④通入足量NaOH溶液中,再滴加BaCl2溶液,有白色沉淀产生,该沉淀溶于稀盐酸⑤能使溴水褪色,再滴加酸化的BaCl2溶液有白色沉淀产生A.都能证明B.都不能证明C.③⑤D.③④⑤6.标准状况下,某同学向100 mLH2S饱和溶液中通入SO2,所得溶液pH变化如图所示,下列分析中正确的是( )A.ab段反应是:SO2+2H2S===3S↓+2H2OB.亚硫酸是比氢硫酸更弱的酸C.原H2S溶液的物质的量浓度为0.05 mol/LD.b点对应的溶液导电性最强7.下列除杂方法正确的是( )①Cl2(HCl):将混合气体通过碱石灰中;②HCl(C l2)将混合气体通入四氯化碳中;③H2S(HCl):将混合气体通入饱和硫化钠溶液中;④SO2(SO3):将混合气体通入98.3%的浓硫酸中;⑤CO2(SO2): 将混合气体通入硝酸钡溶液中;⑥CO2(CO):混合气体点燃即可;⑦SO2(SO3):将混合气体通入饱和亚硫酸氢钠溶液中。
新建二中2013-2014学年上学期高三化学实验班周练(15)一、选择题1.以下说法:①福尔马林和纯盐酸都是混合物; ②沼气和核能都是可再生能源; ③冰和干冰既是纯净物又是化合物; ④不锈钢和建筑用螺纹钢都是合金; ⑤臭氧层的破坏和空气液化制取氮气都是发生物理变化; ⑥氯水使红墨水褪色原理和NH 4HSO 3溶液使KMnO 4溶液褪色原理相同; ⑦豆浆和雾都是胶体。
上述说法正确的是( ) A .①②③④B .①②⑤⑥C .③⑤⑥⑦D .①③④⑦2.下列有关叙述正确的是( )A .AlCl 3、FeCl 3、NaHCO 3固体均不能采用将溶液直接蒸干的方法制备B .澄清石灰水与过量小苏打溶液混合的离子方程式为:Ca 2++ OH -+HCO 3-= CaCO 3↓ + H 2OC .用氨水和硫酸不能鉴别AgNO 3、BaCl 2、K 2SO 3和Mg(NO 3)2四种溶液(不考虑它们间的相互反应)D .Al+NaOH+H 2O→NaAlO 2+H 2↑,Br 2+SO 2+H 2O→H 2SO 4+HBr 反应中水的作用相同 3.设N A 为阿佛加德罗常,下列叙述正确的是( )A .在100mL0.5mol/LCH 3COOH 溶液中CH 3COOH 分子数等于0.05N AB .在标况下,22.4L 辛烷含共价键数为25N AC .已知PbI 2的K SP =7.0×10-9,将1.0×10-2mol/L 的KI 与Pb(NO 3)2溶液等体积混合,则生成PbI 2沉淀所需Pb(NO 3)2溶液的最小浓度为5.6×10-4mol/L D .25℃时,1LpH=13的Ba (OH )2溶液中含有OH -数目为0.2N A 4.下列各组离子在指定溶液中能大量共存的是( )①常温下,c (H +)/c (OH 一)=1×10-12的溶液:K +、AlO 2—、CO 32—、Na +②加入苯酚显紫色的溶液:K +、NH 4+、Cl —、I 一③使甲基橙变红的溶液中:Fe 3+、Al 3+、NO 3—、SO 42—④使pH 试纸变蓝的溶液中:Al 3+、Na +、SO 42—、Cl 一⑤无色溶液中:K +、Al 3+、NO 3—、HCO 3—⑥常温条件下,()Kw c H=0.1 mol/L 的溶液:Na +、K +、SiO 32-、CO 32-A .②③B .①③⑥C .①③⑤D .①④⑤ 5.玻璃棒是化学实验中常用的仪器,其作用是用于搅拌、过滤或转移液体时引流。
新建二中2013-2014学年度下学期高二化学实验班周练(二)考查内容:脂肪烃、芳香烃命题人:王峰考试时间:2014.3.4 审题人:高二化学备课组1.下列说法中正确的是()。
①乙烯的结构简式可以表示为CH2CH2②甲苯中所有原子都处于同一平面③甲烷可以与氯气反应,而乙烯不能与氯气反应④乙烯和苯都能使溴水褪色,褪色的原因相同⑤2-甲基戊烷的一氯代物有(不考虑立体异构)4种⑥C3H8的二氯代物有4种⑦苯在一定条件下能发生加成反应,也可与溴水发生取代反应⑧分子式为CH4O和C2H6O的物质一定互为同系物⑨聚乙烯可发生加成反应,还能使KMnO4酸性溶液褪色⑩分子式为C7H16的烷烃,含有3个甲基的同分异构体有3种A.2个B.3个C.4个D.5个2.某烷烃的各种同分异构体中,主链上有4个碳原子的只有两种结构,则含有相同碳原子数且主链上也有4个碳原子的烯烃(只含一个碳碳双键)的同分异构体有()A.2种B.3种C.4种D.5种3.关于分子式为C5H10的烯烃的下列说法正确的是()A.该烯烃的一种同分异构体为CH2=CHCH(CH3)2名称为2-甲基-3-丁烯B.其属于烯烃的同分异构体有5种C.有一种同分异构体的名称为:2,2-二甲基-1-丙烯D.该物质的结构简式最多有两个侧链4.已知:,如果要合成,所用的原始原料可以是()A.2 -甲基-l,3 -丁二烯和1 -丁炔B. l,3 –戊二烯和2 -丁炔C.2,3 -二甲基-1,3 -戊二烯和乙炔D. 2,3 -二甲基-l,3 -丁二烯和丙炔5.某烃与氢气加成后得到2,2-二甲基丁烷,该烃的名称是()A.3,3-二甲基-1-丁炔B.2,2-二甲基-3-丁炔C.2,2-二甲基-1-丁烯D.2,2-二甲基-3-丁烯6.某烃的化学式为C4H m,下列关于C4H m的说法中正确的是()A.当m=8时,该烃一定与乙烯互为同系物B.当m=4时,该烃一定含有碳碳双键C.该烃不可能同时含有碳碳双键和碳碳三键D.1mol C4H m完全燃烧,不可能生成3.5mol H2O7.下列各组化合物中,不论二者以任何比例混合,只要总质量一定,则完全燃烧时消耗O2的质量和生成水的质量不变的是()A.CH4、C2H6B.C2H6、C3H6C.C2H4、C3H6D.C2H4、C3H48.下列描述分子结构的叙述中,正确的是()A.6个碳原子都在一条直线上B.该烃属于苯的同系物C.至少有10个碳原子在同一平面上D.所有碳原子不可能都在同一平面上9.组成为C10H14的芳香烃,其苯环上有两个取代基时的同分异构体数目为()A.6种B.9种C.12种D.15种10.下列变化中,由加成反应引起的是()A.乙烯通入酸性高锰酸钾溶液中,高锰酸钾溶液褪色B.苯在一定温度、压强和催化剂的作用下和氢气反应,生成环己烷C.一定条件下,苯滴入浓硝酸和浓硫酸的混合液中,有油状物生成D.苯加入到溴水中,振荡后溴水层褪色11.要鉴别己烯中是否混有少量甲苯,正确的实验方法是()A.先加足量的酸性高锰酸钾溶液,然后再加入溴水B.先加足量溴水,然后再加入酸性高锰酸钾溶液C.点燃这种液体,然后再观察火焰的颜色D.加入浓硫酸与浓硝酸后加热12.150℃时取1升混合烃与9升O2混合, 在容积固定的容器中充分燃烧, 当恢复到150℃时,容器内压强增大8%, 则混合烃可能的组成为()A.甲烷和乙烯B.丙炔和乙炔C.丁烯和丁烷D.乙烯和丁烯13.14.下列装置或操作能达到实验目的(必要的夹持装置及石棉网已省略)的是()15.两种气态烃组成的混合气体完全燃烧后所得到CO2和H2O的物质的量随混合烃总物质的量的变化如右图所示。
下列有关混合气体的说法错误的是()A.该混合气体中一定含有乙烯B.该混合气体中有且只有一种烷烃C.组成该混合气体的烃分子所含氢原子数均为4D.若混合气体由CH4和C2H4组成,则其体积比为2∶316.按要求填空:(1)2-甲基-1,3-丁二烯的键线式为:;(2)的一氯取代物有种(3)所含官能团的名称..是;该有机物发生加聚反应后,所得产物的结构简式为。
(4)用甲苯制TNT的反应方程式______________________________,反应类型:__________;(5)烯烃在一定条件下氧化时,由于C=C键断裂,转化为醛、酮,如:若在上述类似条件下发生反应,请模仿上例写出该反应的方程式:__________________________________________________________(6)在烷烃(C n H2n+2)分子中的基团:中的碳原子分别称为伯、仲、叔、季碳原子,数目分别用n1、n2、n3、n4表示。
例如:分子中,n1=6、n2=1、n3=2、n4=1。
试根据不同烷烃的组成结构,分析出烷烃(除甲烷外)中各原子数的关系。
四种碳原子数之间的关系为n1=________ 。
17.为探究苯与溴的取代反应,甲用如图装置Ⅰ进行如下实验:将一定量的苯和液溴放在烧瓶中,同时加入少量铁屑,3~5 min后发现装有AgNO3溶液的锥形瓶中有浅黄色的沉淀生成,即证明苯与溴发生了取代反应。
(1)装置I中①的化学方程式为:________________________________________________,_______________________________________________________。
(2)①中长导管的作用是__________________________________________________________。
(3)烧瓶中生成的褐色油状液滴的成分是__________________________,要想得到纯净的产物,可用____________试剂洗涤。
洗涤后分离产品应使用的仪器是_______________。
(4)甲做实验时,乙观察到烧瓶中液体沸腾并有红棕色气体从导管中逸出,提出必须先除去红棕色气体,才能验证锥形瓶中的产物,原因是___________________________________。
(5)乙同学设计如图所示装置Ⅱ,并用下列某些试剂完成该实验。
可选用的试剂是:苯;液溴;浓硫酸;氢氧化钠溶液;硝酸银溶液;四氯化碳。
a的作用是_____________________________________________;b中的试剂是___________________________________________;比较两套装置,装置Ⅱ的主要优点是:(答出一点即可)______________________________。
18.通常用燃烧的方法测定有机物的分子式,可在燃烧室内将有机物样品与纯氧在电炉加热下充分燃烧,根据产品的的质量确定有机物的组成。
下图所示的是用燃烧法确定有机物分子式的常用装置。
现准确称取0.44 g样品(只含C、H、O三种元素中的两种或三种),经燃烧后A管增重0.88 g,B管增重0.36g。
请回答:(1)按上述所给的测量信息,装置的连接顺序应是:D________ ;(2)C管中浓硫酸的作用是_______________________________________________;(3)要确定该有机物的分子式,还必须知道的数据是___________。
①C装置增加的质量②样品的摩尔质量③CuO固体减少的质量(4)相同条件下,若该有机物蒸气对氢气的相对分子质量为22,且它的核磁共振氢谱上有两个峰,其强度比为3:1,试通过计算确定该有机物的结构简式。
(要求写推理过程)。
新建二中2013-2014学年度下学期高二化学实验班周练(二)答题卷班级:_____________ 学号:__________姓名:____________一、选择题二、非选择题16.按要求填空:(1)____________________________________________________________________;(2)_________________(3)___________________________________;________________________________________。
(4)______________________________________________________________,_________________;(5)_____________________________________________________________________________ (6)_______________________________。
17.(1)______________________________________________________________________________,______________________________________________________________________________。
(2)__________________________________________________________。
(3)__________________________,_____________________。
___________________。
(4)______________________________________________________________________。
(5)______________________________________________________________________________;____________________________________________________________________________;_______________________________________________________________________________。
18.(1)______________________;(2)_______________________________________________;(3)___________。
(4)新建二中2013-2014学年度下学期高二化学实验班周练(二)参考答案1. B2.C3. B4.D5. A6.D7.C8.A 9. B 10. B 11.B 12.D 13. D 14. D15.A16.略17.(1)2Fe+3Br2===2FeBr3(2)导气,冷凝回流(3)与Br2NaOH溶液分液漏斗(4)挥发出的溴蒸气也能与硝酸银溶液反应产生AgBr浅黄色沉淀(5)防止倒吸安全装置苯或四氯化碳主要优点是:①防止倒吸②可以控制反应进行程度③避免杂质干扰④防止污染空气18.(1)DCFBA(2)除去氧气中的水蒸气(3)②(4)依题意可知:n(CO2)=0.88g/44g.mol-1=0.02mol,n(H2O)=0.36 /18g.mol-1=0.02mol;有n(C):n(H): n(O)=0.02:0.04:(0.44-0.02×12-0.04×1)/16=2:4:1故该物质最简式为C2H4O;设该物质分子式为(C2H4O)n,又已知Mr=22×2=44,有44n=44,得n=1,故该物质分子式为C2H4O;又依题意:它的核磁共振氢谱上有两个峰,其强度比为3:1,可推出该有机物的结构简式为CH3CHO。