溶液的配制
- 格式:doc
- 大小:37.00 KB
- 文档页数:4

实验室所需溶液配制1.费休氏试液,购买;2.氢氧化钠溶液,C=0.01mol/l;氢氧化钠分子量40.0,准确称取氢氧化钠固体0.4g溶于200ml蒸馏水中,并在1L容量瓶中定容,即得到上述浓度溶液;3.中性红溶液,C=1%;准确称取中性红固体1g溶于50ml蒸馏水中,并在100ml容量瓶中定容,即得到上述浓度溶液;4.溴百里香酚蓝溶液,C=1%;准确称取溴百里香酚蓝固体1g溶于50ml蒸馏水中,并在100ml容量瓶中定容,即得到上述浓度溶液;5.碘化钾溶液,C=10%;准确称取KI固体50g溶于50ml蒸馏水中,并在500ml容量瓶中定容,即得到上述浓度溶液;6.硫代硫酸钠溶液,C=0.1mol/l;硫代硫酸钠分子量158.11,准确称取硫代硫酸钠固体15.811g溶于200ml蒸馏水中,并在1000ml容量瓶中定容,即得到上述浓度溶液;7.硫酸溶液,C=2mol/l,硫酸分子量98.08,浓度98%时密度约1.84g/ml,准确量取硫酸液体108.78ml稀释与500ml蒸馏水中,向水中加入硫酸而非向硫酸中加水,冷却后在1000ml容量瓶中定容即可得到上述浓度溶液;8.淀粉溶液,C=0.5%;准确称取可溶性淀粉0.5g,溶于50ml水中,并在100ml容量瓶中定容,即得到上述浓度溶液;9.铬酸钾溶液,C=50g/L;准确称取铬酸钾固体50g,溶于500ml水中,并在1000ml容量瓶中定容,搅拌下逐滴加入10%的硝酸银溶液,直至溶液出现棕红的悬浮物为止.静置1昼夜,用干净的滤纸漏斗过滤即可,不一定用饱和硝酸银溶液,用10%硝酸银溶液即可.配制方法:1克硝酸银+10毫升纯水溶解,置于棕色瓶中;10.氯化钠基准试剂,C=0.1mol/l,氯化钠分子量58.5,准确称取氯化钠固,5.85g溶于500ml蒸馏水中,并在1000ml容量瓶中定容,即得到上述浓度溶液;11.硝酸银溶液,C=0.1mol/l,硝酸银分子量169.87,准确称取硝酸银固体8.49g溶于200ml蒸馏水中,并在500ml容量瓶中定容,即得到上述浓度溶液,用前采用基准氯化钠试剂10标定,需保存于棕色试剂瓶中;12.酚酞指示剂,C=0.1%,准确称取酚酞固体0.1g溶于50ml蒸馏水中,并在100ml容量瓶中定容,即得到上述浓度溶液;13.氯化钡溶液,C=10%,准确称取氯化钡固体10g溶于50ml蒸馏水中,并在100ml容量瓶中定容,即得到上述浓度溶液;14.乙醇溶液,C=1%,准确移取乙醇AR1ml与100ml容量瓶中定容,即可得到上述浓度溶液;15.盐酸标准溶液,C=1mol/l,分子量36.46,D154=1.2039.11%,1.1529.57%、1.1020%、1.0510.17%;准确量取39.11%盐酸77.68ml或称取93.216g,稀释与500ml蒸馏水中,向水中加入盐酸而非向盐酸中加水,冷却后在1000ml容量瓶中定容即可得到上述浓度溶液;16.甲基橙指示剂,C=0.1%,准确称取甲基橙固体0.1g溶于50ml蒸馏水中,并在100ml容量瓶中定容,即得到上述浓度溶液;17.邻苯二甲基二辛酯DOP标准液C=100ppm配制:用1ml移液管移取1mlDOPAR加入250ml容量瓶中,并用二氯甲烷稀释至250ml定容,摇匀即可得DOP浓度为4000ppm溶液;用5ml移液管移取浓度为4000ppmDOP溶液2.5ml,加入100ml 容量瓶中,用二氯甲烷稀释至100ml,摇匀即可得浓度为100ppmDOP溶液;18.钼酸铵溶液的配制,C=5%,准确称取钼酸铵固体5g,溶于50ml蒸馏水中,并在100ml容量瓶中定容,即可得到上述浓度溶液;19.硫酸溶液,C=10mol/l,硫酸分子量98.08,浓度98%时密度约1.84g/ml,准确量取硫酸液体543.9ml稀释与300ml蒸馏水中,向水中加入硫酸而非向硫酸中加水,冷却后在1000ml容量瓶中定容即可得到上述浓度溶液;20.氢氧化钠溶液,C=5%,准确称取氢氧化钠固体5g,溶于50ml蒸馏水中,并在100ml容量瓶中定容,即可得到上述浓度溶液;21.氯化亚锡溶液,C=10%,准确称取氯化亚锡固体5g,溶于50ml蒸馏水中,并在100ml容量瓶中定容,即可得到上述浓度溶液,溶液配置完成后向其中投入锡粒一颗并保存于大口瓶中;22.二氧化硅贮备液,1ml相当于1.0mg二氧化硅:准确称取分析纯硅酸钠4.730g分子式Na2SiO3·9H2O,分子量284.22溶于200ml蒸馏水中,并与1L容量瓶中定容,保存于塑料瓶中;23.二氧化硅工作液,C=20ppm,用移液管移取二氧化硅贮备液20ml与1L容量瓶中定容,即可得上述浓度溶液,保存于塑料瓶中;24.硫酸溶液,C=1mol/l,硫酸分子量98.08,浓度98%时密度约1.84g/ml,准确量取硫酸液体54.4ml或称取100.096g稀释与500ml蒸馏水中,向水中加入硫酸而非向硫酸中加水,冷却后在1000ml容量瓶中定容即可得到上述浓度溶液;25.硫代硫酸钠溶液,C=0.05mol/l,硫代硫酸钠分子量158.11,准确称取硫代硫酸钠固体7.9055g溶于200ml蒸馏水中,并在1000ml容量瓶中定容,即得到上述浓度溶液;26.硼酸溶液,C=2%,准确称取硼酸固体2g,溶于50ml蒸馏水中,并在100ml容量瓶中定容,即可得到上述浓度溶液,保存于塑料大口瓶中;27.氢氧化钠溶液,C=40%,准确称取硼酸固体40g,溶于50ml蒸馏水中,冷却后在100ml容量瓶中定容,即可得到上述浓度溶液,保存于塑料大口瓶中或胶塞玻璃瓶中;=1.2039.11%,1.1529.57%、28.盐酸溶液,C=0.05mol/l,分子量36.46,D1541.1020%、1.0510.17%;准确量取39.11%盐酸3.884ml或称取4.661g,稀释与500ml蒸馏水中,向水中加入盐酸而非向盐酸中加水,冷却后在1000ml容量瓶中定容即可得到上述浓度溶液;29.甲基红乙醇溶液,C=1%,准确称取甲基红固体1g,溶于50ml蒸馏水中,并在100ml容量瓶中定容,即可得到上述浓度溶液;30.溴甲酚绿乙醇溶液,C=1%,准确称取溴甲酚绿固体1g,溶于50ml蒸馏水中,并在100ml容量瓶中定容,即可得到上述浓度溶液;31.甘油水溶液,C=2%,准确移取甘油AR2ml与100ml容量瓶中定容,即可得到上述浓度溶液;32.盐酸溶液,C=6mol/l,分子量36.46,D15=1.2039.11%,1.1529.57%、1.1020%、41.0510.17%;准确量取39.11%盐酸466.08ml或称取559.296g,稀释与300ml蒸馏水中,向水中加入盐酸而非向盐酸中加水,冷却后在1000ml容量瓶中定容即可得到上述浓度溶液;33.氢氧化钠溶液,C=6mol/l,氢氧化钠分子量40.0,准确称取氢氧化钠固体240g溶于500ml蒸馏水中,并在1L容量瓶中定容,即得到上述浓度溶液;34.氢氧化钠溶液,C=1mol/l,氢氧化钠分子量40.0,准确称取氢氧化钠固体40g溶于500ml蒸馏水中,并在1L容量瓶中定容,即得到上述浓度溶液;。

溶液配制方法一、指示剂配制1.0.3%二甲酚橙指示剂:称取0.15g二甲酚橙,加5ml无水乙醇,用水稀释至50ml。
2.5g/L液体铬黑T:称取0.5g铬黑T和2.0g氯化羟胺,溶于乙醇,用乙醇稀释至100ml,此使用前配备。
贮存于100ml棕色试剂瓶中。
3.固体铬黑T:称取1.0g铬黑T和100g氯化钠研磨混合均匀,贮存于100ml棕色广口瓶中备用。
4.1%紫脲酸胺:1g紫脲酸胺与100g固体氯化钠混合,研磨,烘干。
5.1g/L酚酞指示剂:称取0.1g酚酞指示剂,加乙醇100ml溶解混合。
6.10 g/L酚酞指示剂:称取1.0 g酚酞指示剂,加乙醇100ml溶解混合。
7.甲基红—溴甲酚绿指示剂:1份2g/L甲基红乙醇溶液与三份1g/L溴甲酚绿乙醇溶液混合。
8.甲基红-亚甲基蓝指示剂:一份甲基红乙醇溶液(1g/L)与两份亚甲基蓝乙醇溶液(1g/L)混合。
9.品红试剂(0.15%):称取0.15g酸性品红,加75ml水,加热到品红溶解,冷却到室温,加4ml盐酸搅拌。
再加15ml10%亚硫酸钠溶液搅匀,放置过夜,加活性炭过滤于100ml容量瓶中。
二、标准溶液的配制1.钴标准溶液:称取3.000g金属钴(99.98%)置于250ml烧杯中,加少量蒸馏水润湿,盖上表面皿,缓慢加入20ml硝酸,加热溶解完全后,洗表面皿及烧杯壁于烧杯中,移入1000ml容量瓶中,用蒸馏水稀释至刻度,摇匀。
此溶液1ml含钴3.000mg。
2.铁氰化钾标准溶液:C﹝K3Fe(CN)6﹞=0.03mol/L,称取9.9g铁氰化钾溶于水中,并稀释至1000ml,摇匀,贮存于棕色瓶中。
3.硫酸钴标准溶液:C(CoSO4)=0.15mol/L,称取4.2g硫酸钴(CoSO4·7H2O)溶于水中,并稀释至1000ml,摇匀,此溶液1ml含钴大约0.9mg。
4.锂标准贮存溶液:称取 5.3228g光谱纯级碳酸锂(预先于110℃、烘2个小时置于干燥器中冷却)置于250ml烧杯中,加少量水润湿,盖上表面皿,沿杯壁缓慢加入15ml盐酸,待溶解后转入1000ml容量瓶中,用蒸馏水定容。


实验常用试剂配置1.铜标准贮备溶液:称取1.000±0.005g金属铜(纯度99.9%)置于150ml烧杯中,加入20ml1+1硝酸,加溶解后,加入10ml1-1硫酸并加热至冒白烟,冷却后,加水溶解并转入1L容量瓶中,用水稀释至标缓。
此溶液每毫升含1.00mg铜。
2.铜标准溶液:吸取5.00ml铜标准贮备溶液于1L容量瓶中,用水稀至标线。
此溶液每毫升含5.0μg铜。
3.二乙基二硫代氨基甲酸钠0.2%(m/v)溶液:称取0.2克二乙基二硫代氨基甲酸钠三水合物(C5H10NS2Na •3H2O,或称铜试剂cupral)溶于水中并稀释至100ml,用棕色玻璃瓶贮存,放于暗处可用两星期。
4.EDTA-柠檬酸铵-氨性溶液:取12g乙二胺四乙酸二钠二水合物(Na-EDTA•2H2O)、2.5g柠檬酸铵[(NH4)3•C6H5O7],加入100ml水和200ml浓氨水中溶解,用水稀释至1L,加入少量0.2%二乙基二硫代氨基甲酸钠溶液,用四氯化碳萃取提纯。
4.1EDTA-柠檬酸铵溶液:将5g乙二胺四乙酸二钠二水合物(Na2-EDTA•2H2O)20g柠檬酸铵[(NH4)3•C6H5O7]溶于水中并稀释至100ml,加入4滴甲酚红指示液,用1+1氨水调至PH=8~8.5(由黄色变为浅紫色),加入少量0.2%二乙基二硫代氨基甲酸钠溶液,用四氯化碳萃取提纯。
5.氯化铵-氢氧化铵缓冲溶液将70g氯化铵(NH4Cl)溶于适量水中,加入570ml浓氨水,用水稀释至1L。
6.甲酚红指示液0.4g/L:称取0.02克甲酚红(C21H18O5S)溶于50ml195%(v/v)乙醇中。
7.碘溶液C=0.05mol/L:称12.7g碘片,加到含有25g碘化钾+少量水中,研磨溶解后用水稀释至1000mL。
8.丁二酮肟[(CH3)2C2(NOH)2]溶液5g/L:称取0.5g丁二酮肟溶解于50mL浓氨水中,用水稀释至100mL9.丁二酮肟乙醇溶液,10g/L:称取1g丁二酮肟,溶解于100mL乙醇(3.4)中。

1、硝酸15%
量取15ml浓硝酸稀释100ml刻度混匀
2、硫酸(1+3)
量取100ml浓硫酸缓慢注入300ml水中
3、硝酸(1+1)
一份硝酸和一分水混匀
4、钼酸铵20%
称固体钼酸铵20克溶解于水中稀释至100ml
5、氢氧化钾溶液20%
称固体氢氧化钾20克溶解于水中稀释至100ml
6、三乙醇胺(1+2)
一份三乙醇胺2分水混匀
7、酒石酸5%ml
称取酒石酸5克,以水溶解并稀释至100ml
8、钼酸铵5%
称取钼酸铵5克,以水溶解过滤并稀释至100ml
9、酒石酸钾钠5%
称取酒石酸钾钠5克,以水溶解并稀释至100ml
10、铜试剂1%
称取二乙基二硫代氨基甲酸钠(铜试剂)1克,以水溶解并稀释至100ml
11、氯化铵10%
称固体氯化铵10克,以水溶解并稀释至100ml
12、洗液
浓硝酸65ml、水5ml、固体K2Cr2O72克配一份
13、氢氧化钠标准溶液0.1424mol/L
配制,称取氢氧化钠5.696g于500ml塑料烧杯中加水300ml,于冷水盆中不断搅拌使之溶解,加入氢氧化钡(10%)1 ml用水稀释至1000 ml,移入塑料壶中,摇匀,静止,待碳酸钡沉淀下沉后,虹吸上层清液于另一塑料瓶中。
标定滴定度后使用
14、EDTA标准溶液0.01mol/L
配制,称取EDTA3.7226g置于300ml烧杯中,加水适量溶解,移入1000ml容量瓶中,冲刻度摇匀。
15、硝酸钾+乙醇洗液
10g硝酸钾加90ml水溶解后,加无水乙醇10ml摇匀备用
16、混合指示剂
中性红0.05%+亚甲基蓝0.05%(乙醇溶液)。
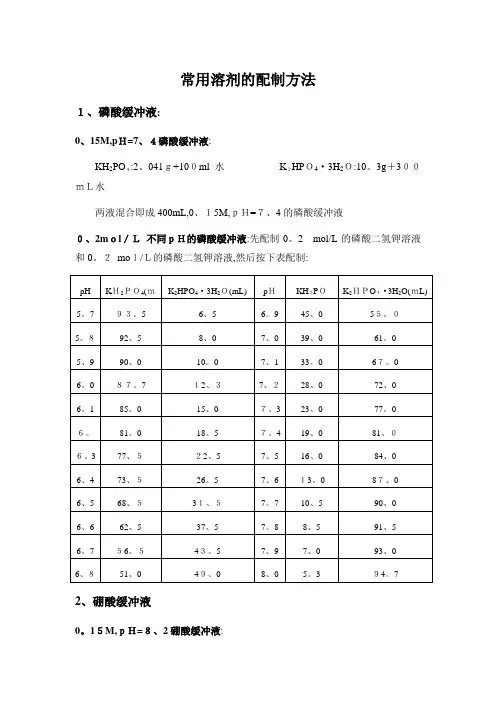
常用溶剂的配制方法1、磷酸缓冲液:0、15M,pH=7、4磷酸缓冲液:KH2PO4:2、041g+100ml水K2HPO4·3H2O:10。
3g+300mL水两液混合即成400mL,0、15M,pH=7、4的磷酸缓冲液0、2mol/L不同pH的磷酸缓冲液:先配制0。
2mol/L的磷酸二氢钾溶液和0。
2mol/L的磷酸二氢钾溶液,然后按下表配制:2、硼酸缓冲液0。
15M,pH=8、2硼酸缓冲液:四硼酸钠溶液:2g+35 mL水硼酸溶液:3。
246g硼酸+350 mL水两液混合即成700 mL,0、15M,pH=8、2的硼酸缓冲液0。
2 mol/L(硼酸根),不同pH的硼酸缓冲液:先配制0、2 mol/L的硼酸溶液和0、05 mol/L的四硼酸钠溶液,然后按下表配制:3。
甘氨酸-盐酸缓冲液:0、2 mol/L0。
2 mol/L甘氨酸溶液(15、01g/L)4。
柠檬酸缓冲液:0。
1mol/LC6H8O7·H2O:0。
1mol/L溶液为21。
01g/LNa3C6H5O7·2H2O:0、1mol/L溶液为29、41g/L5。
Tris-HCl缓冲液:0、1mol/L100mL0。
1mol/L三羟甲基氨基甲烷(Tris)溶液与一定量的0。
1mol/L盐酸混匀,可得0。
1mol/L,不同pH的缓冲液、200mL 0。
1MTris(2、42g)加入0、1M HCl 24mL→pH=9,0、1MTr is-HCl buffer6。
醋酸缓冲液:0。
2mol/L0、2mol/L醋酸钠:27、22g三水醋酸钠(无水的为16、4g)+1L水0。
2mol/L醋酸:11、55mL冰醋酸+1L水7。
碳酸缓冲液:0、1 mol/L(Ca2+、Mg2+存在时不得使用)0。
1 mol/LMES缓冲液:1。
921gMES+100mL水,pH=4、098、电泳溶液:电泳缓冲液:3gTris碱、14、4g甘氨酸和1gSDS溶于水中,调pH至8。

配制溶液的操作步骤
配制溶液的五个步骤:称量、溶解、转移、洗涤、定容。
1、称量:用托盘天平称量固体质量或用量筒量取液体体积。
2、溶解:在烧杯中溶解或稀释溶质,恢复至室温,检查容量瓶是否漏水。
3、转移:将烧杯内冷却后的溶液沿玻璃棒小心转入一定体积的容量瓶中。
4、洗涤:用蒸馏水洗涤烧杯和玻璃棒2~3次,并将洗涤液转入容器中,振荡,使溶液混合均匀。
5、定容:向容量瓶中加水至刻度线以下1cm~2cm处时,改用胶头滴管加水,使溶液凹面恰好与刻度线相切。
配置溶液需要的仪器:天平、吸管、烧杯、玻璃棒、量筒、容量瓶、移液管、胶头滴管、表面皿。
配好的溶液要及时装入试剂瓶中,盖好瓶塞并贴上标签(标签中应包括药品名称和溶液中溶质的质量分数或摩尔分数),放到相应的试剂柜中。

溶液的配制(一)标准溶液的配制方法在化学实验中,标准溶液常用mol·L-1表示其浓度。
溶液的配制方法主要分直接法和间接法两种。
1.直接法准确称取基准物质,溶解后定容即成为准确浓度的标准溶液。
例如,需配制500mL浓度为0.01000 mol·L-1 K2Cr2O7溶液时,应在分析天平上准确称取基准物质K2Cr2O71.4709g,加少量水使之溶解,定量转入500mL容量瓶中,加水稀释至刻度。
较稀的标准溶液可由较浓的标准溶液稀释而成。
例如,光度分析中需用1.79×10-3mol·L-1标准铁溶液。
计算得知须准确称取10mg纯金属铁,但在一般分析天平上无法准确称量,因其量太小、称量误差大。
因此常常采用先配制储备标准溶液,然后再稀释至所要求的标准溶液浓度的方法。
可在分析天平上准确称取高纯(99.99%)金属铁1.0000g,然后在小烧杯中加入约30mL 浓盐酸使之溶解,定量转入一升容量瓶中,用1mol·L-1盐酸稀释至刻度。
此标准溶液含铁1.79×10-2mol·L-1。
移取此标准溶液10.00mL于100mL容量瓶中,用1mol·L-1盐酸稀释至刻度,摇匀,此标准溶液含铁1.79×10-3mol·L-1。
由储备液配制成操作溶液时,原则上只稀释一次,必要时可稀释二次。
稀释次数太多累积误差太大,影响分析结果的准确度。
2.标定法不能直接配制成准确浓度的标准溶液,可先配制成溶液,然后选择基准物质标定。
做滴定剂用的酸碱溶液,一般先配制成约0.1mol·L-1浓度。
由原装的固体酸碱配制溶液时,一般只要求准确到1~2位有效数字,故可用量筒量取液体或在台秤上称取固体试剂,加入的溶剂(如水)用量筒或量杯量取即可。
但是在标定溶液的整个过程中,一切操作要求严格、准确。
称量基准物质要求使用分析天平,称准至小数点后四位有效数字。

溶液配制方法一、指示剂配制1.0.3%二甲酚橙指示剂:称取0.15g二甲酚橙,加5ml无水乙醇,用水稀释至50ml。
2.5g/L液体铬黑T:称取0.5g铬黑T和2.0g氯化羟胺,溶于乙醇,用乙醇稀释至100ml,此使用前配备。
贮存于100ml棕色试剂瓶中。
3.固体铬黑T:称取1.0g铬黑T和100g氯化钠研磨混合均匀,贮存于100ml棕色广口瓶中备用。
4.1%紫脲酸胺:1g紫脲酸胺与100g固体氯化钠混合,研磨,烘干。
5.1g/L酚酞指示剂:称取0.1g酚酞指示剂,加乙醇100ml溶解混合。
6.10 g/L酚酞指示剂:称取1.0 g酚酞指示剂,加乙醇100ml溶解混合。
7.甲基红—溴甲酚绿指示剂:1份2g/L甲基红乙醇溶液与三份1g/L溴甲酚绿乙醇溶液混合。
8.甲基红-亚甲基蓝指示剂:一份甲基红乙醇溶液(1g/L)与两份亚甲基蓝乙醇溶液(1g/L)混合。
9.品红试剂(0.15%):称取0.15g酸性品红,加75ml水,加热到品红溶解,冷却到室温,加4ml盐酸搅拌。
再加15ml10%亚硫酸钠溶液搅匀,放置过夜,加活性炭过滤于100ml容量瓶中。
二、标准溶液的配制1.钴标准溶液:称取3.000g金属钴(99.98%)置于250ml烧杯中,加少量蒸馏水润湿,盖上表面皿,缓慢加入20ml硝酸,加热溶解完全后,洗表面皿及烧杯壁于烧杯中,移入1000ml容量瓶中,用蒸馏水稀释至刻度,摇匀。
此溶液1ml含钴3.000mg。
2.铁氰化钾标准溶液:C﹝K3Fe(CN)6﹞=0.03mol/L,称取9.9g铁氰化钾溶于水中,并稀释至1000ml,摇匀,贮存于棕色瓶中。
3.硫酸钴标准溶液:C(CoSO4)=0.15mol/L,称取4.2g硫酸钴(CoSO4·7H2O)溶于水中,并稀释至1000ml,摇匀,此溶液1ml含钴大约0.9mg。
4.锂标准贮存溶液:称取 5.3228g光谱纯级碳酸锂(预先于110℃、烘2个小时置于干燥器中冷却)置于250ml烧杯中,加少量水润湿,盖上表面皿,沿杯壁缓慢加入15ml盐酸,待溶解后转入1000ml容量瓶中,用蒸馏水定容。

溶液的配制方法溶液的配制是化学实验中常见的操作,正确的配制方法能够确保实验结果的准确性和可重复性。
下面将介绍一些常见的溶液配制方法及注意事项。
一、固体溶解法。
固体溶解法是最常见的配制溶液的方法之一。
首先,需要准备所需的固体试剂和溶剂。
然后,按照一定的比例将固体试剂加入溶剂中,并用搅拌棒充分搅拌直至固体完全溶解。
在此过程中,需要注意控制溶解温度和搅拌时间,以确保溶液的均匀性和稳定性。
二、液体稀释法。
液体稀释法适用于需要配制低浓度溶液的情况。
首先,准备一定浓度的原液溶液和纯溶剂。
然后,按照一定的比例将原液溶液加入纯溶剂中,并用搅拌棒充分搅拌。
在此过程中,需要注意控制加入原液的比例和搅拌的均匀性,以确保配制出所需浓度的溶液。
三、溶液稀释法。
溶液稀释法适用于需要配制高浓度溶液的情况。
首先,准备一定浓度的原液溶液和纯溶剂。
然后,按照一定的比例将原液溶液取出一定量,加入纯溶剂中,并用搅拌棒充分搅拌。
在此过程中,需要注意控制取出原液的比例和搅拌的均匀性,以确保配制出所需浓度的溶液。
四、注意事项。
在进行溶液配制时,需要注意以下几点:1. 精确称量,使用精密天平进行精确称量,确保所配制的溶液浓度准确。
2. 搅拌均匀,在溶解固体试剂或稀释液体溶液时,需要充分搅拌,以确保溶液的均匀性。
3. 温度控制,一些试剂在溶解过程中会产生热量,需要控制溶解温度,避免溶液过热或结晶析出。
4. 容器选择,根据所配制溶液的性质选择合适的容器,避免发生化学反应或溶液泄漏。
5. 标签标注,配制好的溶液需要标注溶液名称、浓度、配制日期等信息,以便后续使用和识别。
在实验室中,正确的溶液配制方法不仅能够保证实验结果的准确性,还能够保障实验人员的安全。
因此,熟练掌握溶液配制方法并严格按照操作规程进行操作是非常重要的。
希望以上介绍的方法和注意事项能够对大家在实验中的溶液配制工作有所帮助。

溶液配制过程书写
溶液的配制是实验室中常见的操作,下面详细介绍溶液配制的书写过程。
一、计算所需溶质的质量
根据所需的浓度和体积,计算出所需溶质的质量。
例如,如果需要配制100mL 浓度为0.1mol/L的NaCl溶液,则需要称取0.1mol的NaCl,即5.85g。
二、称量所需溶质和溶剂
使用电子天平称量所需质量的溶质,并用量筒量取所需的溶剂。
例如,称取
5.85g的NaCl,并量取94.15mL的水作为溶剂。
三、将溶质溶解在溶剂中
将称取的溶质加入到量取的溶剂中,并用玻璃棒搅拌至溶解。
例如,将NaCl 加入到量取的水中,并用玻璃棒搅拌至溶解。
四、将溶液转移到容量瓶中
将溶解好的溶液转移到容量瓶中,容量瓶需要预先干燥并检查是否漏水。
例如,将溶解好的NaCl溶液转移到100mL的容量瓶中。
五、洗涤容量瓶并定容
用少量溶剂洗涤容量瓶内部的溶液,并将洗涤液全部转移到容量瓶中。
然后向容量瓶中加入适量的溶剂至刻度线。
例如,加入适量的水至刻度线。
六、摇匀溶液
轻轻摇动容量瓶,使溶液均匀混合。
七、贴上标签并标记溶液名称和浓度
在容量瓶上贴上标签,标记溶液的名称和浓度。
例如,在容量瓶上贴上标签,标记为“NaCl溶液,0.1mol/L”。
1%酚酞指示剂溶液:10g的酚酞加少量无水乙醇溶解,加乙醇定容至1L ,配制好了之后只需摇匀,使之形成均匀溶液。
中性无水乙醇;乙醇对于酚酞显示酸性,中性乙醇就是用氢氧化钠滴定让他对酚酞显示中性。
碘化钾溶液(100g/L):不含碘酸盐或游离碘;称取100g碘化钾,加入适量的水容解,定容至1L。
0.5%淀粉溶液:将5g可溶性淀粉在30mL水中混合,加此混合液于1000mL 沸水中煮沸3min并冷却。
溶剂:环己烷和冰乙酸等体积混合液。
氯仿-冰乙酸混合液:取氯仿40ml加冰乙酸60ml,混匀。
饱和碘化钾溶液:取碘化钾10g,加水5ml,贮于棕色瓶中。
0.01mol/L硫代硫酸钠标准溶液:吸取约0.1mol/L的硫代硫酸钠溶液10ml,注入100ml容量瓶中,加水稀释至刻度。
氢氧化钠(400g/l):称取400g氢氧化钠,加入适量的水容解,定容至1L。
硼酸(20g/l):称取20g硼酸,加入适量的水容解,定容至1L。
甲基红乙醇(1g/l):称取1g甲基红,加入适量的乙醇容解,用乙醇定容至1L。
嗅甲酚绿乙醇(1g/l):称取1g嗅甲酚绿,加入适量的乙醇容解,用乙醇定容至1L。
盐酸(1+1):量取5000ml盐酸缓慢加入500ml的水。
20%盐酸:量取550ml盐酸,加入450ml水。
10%氨水:量取100ml氨水,加入900ml水中。
5g/L铬黑T指示剂:量取5g铬黑T加入少量的水溶解,加水定容至1L。
PH≈10氨-氯化铵缓冲液:20%硫酸:5%铬酸钾:量取50g的铬酸钾溶加少量水溶解,加水定容至1L。
海砂:取用水洗泥土的海砂或河砂,先用盐酸(1+1)煮沸0.5h,用水洗至中性,再用氢氧化钠溶液(240g/l)煮沸0.5h,用水洗至中性,经100℃±5℃干燥备用。
磷脂饱和丙酮溶液的配制取经丙酮洗除油脂等丙酮可溶物的磷脂约2g,在50ml烧杯中用10ml石油醚溶解,加25ml丙酮使磷脂析出。
通过G3玻璃过滤坩埚抽滤,用80ml丙酮分四次洗涤磷脂,最后尽量抽除残留丙酮。
溶液配制方法简要
一、1+5硫酸溶液
①将450毫升蒸馏水倒入试剂瓶中;
②量取90毫升浓硫酸,缓慢加入到试剂瓶中;
③贴好标签,盖好盖放到指定位置。
二、PH标准溶液
①4.00:取一袋4.00标准物倒入250ml玻璃烧杯中,用水反复冲洗塑料袋,将水倒入烧杯中;
②向烧杯中加入100ml蒸馏水;
③将水倒入250毫升容量瓶,用水冲洗烧杯三次,倒入容量瓶;
④向容量瓶中加水到刻度,摇匀‘
⑤将溶液移入试剂瓶,贴标签,放到指定位置。
三、氯化钾溶液
3mol/l:112g kcl加入到500ml水中全部溶解。
3.3mol/l:123g kcl加入到500ml水中全部溶解。
四、5g/l淀粉溶液
称1.25g淀粉加入到250ml水中煮沸。
晾凉后转入试剂瓶,贴好标签。
五、10g/l淀粉溶液
称2.5g淀粉加入到250ml水中煮沸。
六、硫代硫酸钠溶液
[
版本 1 执行日期4/13/2013 页码1/2
将4瓶500g硫代硫酸钠加3000ml水煮沸。
15min,晾凉,过滤,转入塑料瓶中,避光保存2周。
430ml加9L水。
[
版本 1 执行日期4/13/2013 页码2/2。
溶液的配制方法溶液的配制是化学实验中非常重要的一环,正确的配制方法不仅能够保证实验结果的准确性,还能够确保实验的安全性。
下面我们将介绍几种常见的溶液配制方法及注意事项。
一、溶液的配制方法。
1. 固体溶解法。
固体溶解法是最常见的溶液配制方法之一。
首先,需要称取所需的固体试剂,然后将其加入容量较小的容器中。
随后,向容器中加入适量的溶剂,如蒸馏水或乙醇,然后用搅拌棒充分搅拌,直至固体完全溶解。
最后,将溶液转移至容量瓶中,并用溶剂补足至刻度线,摇匀即可。
2. 液体稀释法。
液体稀释法适用于已有浓度较高的溶液,需要将其稀释至所需浓度的情况。
首先,需要准备一个干净的容量瓶,然后向容量瓶中倒入一定量的原液。
接着,用溶剂逐渐稀释至刻度线,摇匀即可得到所需浓度的溶液。
3. 溶液稀释法。
溶液稀释法适用于需要将已有浓度较高的溶液稀释至所需浓度的情况。
首先,需要准备一个干净的容器,然后向容器中倒入一定量的原液。
接着,用溶剂逐渐稀释至所需浓度,搅拌均匀即可得到所需浓度的溶液。
二、注意事项。
1. 在配制溶液时,应严格按照实验要求和配制方法进行操作,避免因操作不当导致溶液浓度偏差或者安全事故的发生。
2. 在固体溶解法中,应注意固体试剂的称取精确度,避免因称取不准确导致溶液浓度偏差。
3. 在使用搅拌棒搅拌溶液时,应搅拌均匀,确保溶质充分溶解,避免因未溶解的溶质导致实验结果的不准确性。
4. 在配制溶液时,应注意安全操作,避免溶液溅出或者溶液挥发造成的危险。
5. 在配制完溶液后,应及时标注溶液名称、浓度、配制日期等信息,并妥善保存,避免混淆或者误用。
三、总结。
正确的溶液配制方法能够保证实验结果的准确性和安全性,因此在进行化学实验时,我们需要严格按照配制方法进行操作,并注意配制过程中的细节和安全事项。
希望以上介绍的溶液配制方法及注意事项能够对大家有所帮助,祝大家在化学实验中取得好成绩!。
配制溶液的操作方法
1. 准备容器:选择干净无菌的容器,比如试管、烧杯或容量瓶,并按照需要的配制溶液容量选择合适的容器大小。
2. 称量固体试剂:使用电子天平准确称取所需量的固体试剂,或者直接购买预先包装好的固体试剂。
3. 加入溶剂:将准确称取的固体试剂加入到容器中,然后加入适量的溶剂(如蒸馏水、乙醇等),按照配制溶液的浓度要求加入适量的溶剂,然后充分混合。
4. 溶解固体试剂:用搅拌棒或者磁力搅拌器将溶剂和固体试剂充分混合,直到固体试剂完全溶解在溶剂中。
5. 调节pH值:如果需要调节溶液的pH值,可以使用酸碱溶液进行调节,直到达到所需的pH值。
6. 过滤溶液:如果配制的溶液中含有悬浮固体颗粒,可以使用滤器或过滤纸将固体颗粒过滤掉,得到清澈的溶液。
7. 检查溶液:最后,使用PH试纸或PH计检查溶液的PH值是否符合要求,确保配制的溶液符合实验要求。
配制溶液的五个步骤
配制溶液的五个步骤是:材料准备、称量固体、溶解固体、调整溶液体积和混匀溶液。
第一步是材料准备。
在配制溶液之前,需要准备所需的材料和设备。
这包括所需要的溶剂和固体物质,以及称量仪器,容器和搅拌器等。
第二步是称量固体。
根据实验配方或需要的浓度,在称量仪器上准确称取所需的固体物质。
这个过程需要精确的称量,以确保最终溶液的准确浓度。
第三步是溶解固体。
将称取好的固体物质加入适当的容器中,并加入足够的溶剂。
然后使用搅拌器或振荡器等设备将固体完全溶解在溶剂中,以获得均匀的溶液。
第四步是调整溶液体积。
根据需要的最终体积,确定所需的溶液体积并进行调整。
在这一步中,可以添加足够的溶剂以达到所需的体积,或者使用其他方法如
浓缩或稀释来调整溶液的体积。
最后一步是混匀溶液。
将配制好的溶液慎重搅拌或振荡,以确保溶液中的固体物质充分均匀分布。
这样可以确保溶液中各组分的浓度均匀,从而得到稳定和有效的溶液。
总结起来,配制溶液的五个步骤包括材料准备、称量固体、溶解固体、调整溶液体积和混匀溶液。
这些步骤的顺序和操作方法都对获得高质量溶液至关重要。
以上五个步骤的执行确保了正确、准确、均匀和稳定的溶液制备过程。
7% PAGE变性胶的配制
1、UREA 210.6g x 2 403.2g
2、Formamide 192ml x 2 382g
3、40%丙烯酰胺105ml x 2 210ml
4、5 x TBE 120ml x 2 240ml 取500ml锥形瓶(放一磁转子),依次加入,磁转子搅拌,过滤,4℃。
10%过硫酸铵的配制
过硫酸铵1g加水1ml
银染液的配制
1、10% 乙酸50 ml HAC+400ml ddH2O
2、1.5%HNO3 500 ml 的浓HNO3加入500 ml水
3、0.2%AgNO3 500 ml (1 g AgNO3加入500 ml ddH2O)
4、3%Na2CO3
500 ml
0.075%甲醛(375 ml)
PAGE 加样缓冲液Binding (25 ml)
98%去离子甲酰胺 4.5 ddH2O
10 nM EDTA(PH8.0)20 ml 无水乙醇
0.025% 溴酚兰0.5 ml 冰乙酸
70 μl Binding
FISH 所用溶液的配制
70% FA 40 ml 50 ml
FA 28 ml 35 ml
20 x SSC 4 ml →终浓度为2 x SSC 5 ml
ddH2O 8 ml 10 ml
着丝粒探针变性所用的60%FA
60% FA 50 ml
FA 30ml
20 x SSC 5ml →终浓度为2 x SSC
ddH2O 15ml
20 x SSC 1000 ml
Nacl 175.3 g
柠檬酸钠88.2 g
ddH2O 800 ml
10 M NaOH调至PH=7.0 加水1000 ml
10 x PBS 500 ml
Nacl 40 g
Kcl 1 g
Na2HPO4-12H2O 14.35 g / Na2HPO4-7H2O 10.85 g
KH2PO4 1 g
加水到500 ml
1 x Pepsin x :0.01 N Hcl =0.5 ml :1 ml
75% 乙醇(分装)75μl (100% 乙醇)+ 25μl(ddH2O)
25 ml FA 20
50% FA 5 ml 20 x SSC 4
20 ml ddH2O 16
75% 乙醇50 ml ddH2O
150 ml 100% 乙醇
0.075 mol / l Kcl
母液:Kcl分子量:74.55 M =74.55 mol /l
100 ml H2O +11.2 g kcl→20 x
工作液:10 ml母液+ 190 ml ddH2O
一次配制0.075mol/l kcl
kcl 1.11825g (74.55g/mol)1.11825 / 74.55 = 0.015 mol
ddH2O 200 ml
1 % 多聚甲醛
多聚甲醛1g
1 x PBS 100 ml
(注:多聚甲醛难溶,要放在50-60℃的水浴锅里溶解)
4 x SSC /0.05% Tween20配制
20 x SSC 200 ml
ddH2O 800 ml PH=7.6
Tween20 0.5 ml
.
1 M Tris-HCl (pH7.4,7.6,8.0)
组份浓度1 M Tris-HCl
配制量1L
配制方法1.称量121.1 g Tris置于l L烧杯中。
2.加入约800 ml的去离子水,充分搅拌溶解。
3.按下表加入浓HCl量调节所需要的pH值。
pH值浓HCl
7.4 约70 ml
7.6 约60 ml
8.0 约42ml
4.将溶液定容至1 L。
5.高温高压灭菌后,室温保存。
注意:应使溶液冷却至室温后再调定pH值,因为Tris溶液的pH值随温度的变化差异很大,温度每升高l℃,溶液的pH值大约降低0.03个单位。
二
1 0×TE Buffer (pH7.4, 7.6,8.0)
组份浓度100 mM Tris-HCl,10 mM EDTA
配制量1 L
配制方法1.量取下列溶液,置于l L烧杯中。
1 M Tris-HCl Buffer(pH7.4,7.6,8.0) 100 ml
500 mM EDTA(pH8.0) 20 ml
2.向烧杯中加入约800 ml的去离子水,均匀混合。
3.将溶液定容至1 L后,高温高压灭菌。
4.室温保存。
三
3 M醋酸钠(pH5.2)
组份浓度3 M醋酸钠
配制量100 ml
配制方法1.称量40.8 g NaOAc•3H2O置于100~200 ml烧杯中,加入约40 ml的去离子水搅拌溶解。
2.加入冰醋酸调节pH值至5.2。
3.加去离子水将溶液定容至100 ml。
4.高温高压灭菌后,室温保存。
1×TE缓冲液(10mmol/L, pH7.5. Tris-HCl, 1mmol/L EDTA)
称取0.12g Tris,加适量蒸馏水溶解,用1mol/L盐酸调至pH8.0并定容至100m L,加入0.037gEDTA·Na2·2H2O,高压灭菌20min.
2 M醋酸钠(pH5.2)
组份浓度3 M醋酸钠
配制量100 ml
配制方法1.称量27.2 g NaOAc•3H2O置于100~200 ml烧杯中,加入约40 ml的去离子水搅拌溶解。
2.加入冰醋酸调节pH值至5.2。
3.加去离子水将溶液定容至100 ml。
4.高温高压灭菌后,室温保存。