第三章 化学反应反应速率
- 格式:ppt
- 大小:1.95 MB
- 文档页数:44

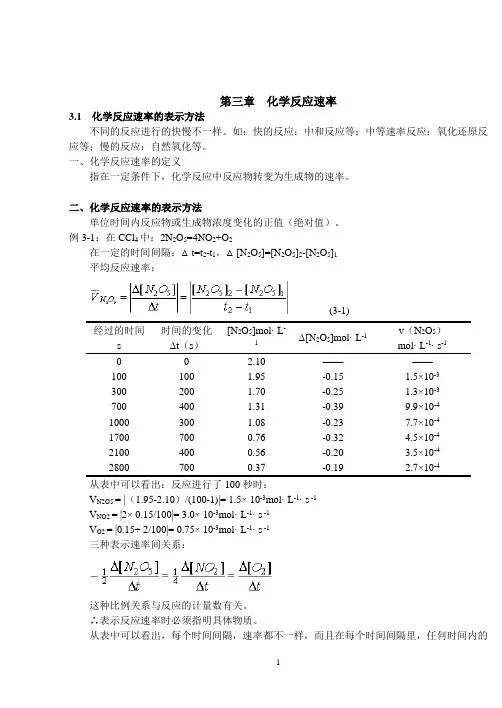
第三章化学反应速率3.1化学反应速率的表示方法不同的反应进行的快慢不一样。
如:快的反应:中和反应等;中等速率反应:氧化还原反应等;慢的反应:自然氧化等。
一、化学反应速率的定义指在一定条件下,化学反应中反应物转变为生成物的速率。
二、化学反应速率的表示方法单位时间内反应物或生成物浓度变化的正值(绝对值)。
例3-1:在CCl4中:2N2O5=4NO2+O2在一定的时间间隔:△t=t2-t1,△[N2O5]=[N2O5]2-[N2O5]1平均反应速率:(3-1)经过的时间s 时间的变化Δt(s)[N2O5]mol· L-1Δ[N2O5]mol· L-1v(N2O5)mol· L-1· s-10 0 2.10 ————100 100 1.95 -0.15 1.5×10-3300 200 1.70 -0.25 1.3×10-3700 400 1.31 -0.39 9.9×10-41000 300 1.08 -0.23 7.7×10-41700 700 0.76 -0.32 4.5×10-42100 400 0.56 -0.20 3.5×10-42800 700 0.37 -0.19 2.7×10-4从表中可以看出:反应进行了100秒时:V N2O5 = |(1.95-2.10)/(100-1)|= 1.5× 10-3mol· L-1· s -1V NO2 = |2× 0.15/100|= 3.0× 10-3mol· L-1· s -1V O2 = |0.15÷ 2/100|= 0.75× 10-3mol· L-1· s -1三种表示速率间关系:这种比例关系与反应的计量数有关。
∴表示反应速率时必须指明具体物质。

第三章 化学反应速率和化学平衡习题3-1 什么是反应的速率常数?它的大小与浓度、温度、催化剂等因素有什么关系? 答:反应的速率大都可以表示为与反应物浓度方次的乘积成正比:υ=k ·c (A)·c (B),式中比例常数k 就是速率常数。
速率常数在数值上等于反应物浓度均为1 mol ·L -1时的反应速率。
k 的大小与反应物浓度无关,改变温度或使用催化剂会使速率常数k 的数值发生变化。
习题 3-2 什么是活化能?答:Arrhenius 总结了大量实验事实,提出一个经验公式:速率常数k 的对数与1/T 有线形关系:C TRE k a +⋅-=1ln 式中E a 就是活化能,它表示活化分子具有的最低能量与反应分子平均能量之差。
习题3-3 什么是催化剂?其特点有哪些?答:某些物质可以改变化学反应的速率,它们就是催化剂。
催化剂参与反应,改变反应历程,降低反应活化能。
催化剂不改变反应体系的热力学状态,使用催化剂同样影响正、逆反应的速率。
不影响化学平衡,只能缩短达到平衡的时间。
习题3-4 NOCl 分解反应为2NOCl →2NO+Cl 2实验测得NOCl 的浓度与时间的关系如下:t/s0 10 20 30 40 50 c (NOCl )/mol ·L -12.001.420.990.710.560.48求各时间段内反应的平均速率;用作图法求t =25s 时的瞬时速率。
解:t=0-10s 时,1042.100.2-=∆∆=t c υ= 0.058mol ·L -1·s -1t=10-20s 时,102099.042.1--=∆∆=t c υ= 0.043mol ·L -1·s -1 t=20-30s 时,203071.099.0--=∆∆=t c υ= 0.028mol ·L -1·s -1 t=30-40s 时,304056.071.0--=∆∆=t c υ= 0.015mol ·L -1·s -1 t=40-50s 时,405048.056.0--=∆∆=t c υ= 0.008mol ·L -1·s -1 作图法略。


第三章化学反应速率化学动力学(chemical kinetics):研究化学反应速率的科学 .主要研究 :化学反应速率的理论反应机理影响反应速率的因素第一节化学反应速率和反应机理一化学反应速率表示方法化学反应速率(rate of a chemical reaction):衡量化学反应过程进行的快慢,即反应体系中各物质的数量随时间的变化率。
反应速率:平均速率瞬时速率过氧化氢(H2O2)水溶液的分解反应为:H2O2(aq)H2O(l) +12O2(g)I-v00.80200.400.40/20=0.020400.200.20/20=0.010600.10t /min[H 2O 2]/ (mol ⋅L -1)/(mol ⋅L -1⋅⋅min -1)800.050表7-1 H 2O 2水溶液在室温时的分解0.10/20=0.005 00.050/20=0.002 5平均速率(average rate) :瞬时速率(instantaneous rate) :令Δt 趋近于零时的速率。
通常所表示的反应速率均指瞬时速率。
tc v Δ)O H (Δ22-=tc t cd )O (H d O (H lim 2222-=∆∆-=)v反应的瞬时速率可通过作图法求得。
20min时H2O2分解的瞬时速率,A点切线的斜率,去负号即可.如合成氨的反应 :N 2 + 3H 2 ==== 2NH 3一般地,对于化学反应aA + bB = gG + hH 其反应速率定义为:tc t c t c t c νt ξVd NH d d H d d N d d d d d 1B B )(21)(31)(111322=-=-=⋅=⋅=v二 反应机理概念反应机理(reaction mechanism):就是化学反应进行的实际步骤,即实现该化学反应的各步骤的微观过程。
H 2(g)+I 2(g)2HI(g)I 2(g)2I(g)快反应)慢反应(速率控制步骤)H 2(g)+2I(g)2HI(g))2(g)2I(g)快反应(1)慢反应(速率H 2(g)+2I(g)2HI(g)(2)(一)基元反应和非基元反应(基)元反应(elementary reaction)是指反应物分子一步直接转化为产物分子的反应。


第三章 化学反应速率和化学平衡活化能:①活化能大的反应,反应速率慢。
②升高温度,活化能大的反应速率增加的倍数,比活化能小的反应多。
温度升高10度,化学反应速率增加一倍,则反应的活化能为51kJ/mol 温度升高100度,化学反应速率常数增加十倍,则反应的活化能为23kJ/mol影响反应速率的因素:(1)浓度:反应速率方程表达式、反应级数、速率常数单位?解:如aA+bB=cC+dD ,对于基元反应,V=kC a (A )·C b (B )速率常数单位:V 的单位是mol/L ·S 代进去可求K 的单位 A 的反应级数是a ,B 的反应级数是b ,反应总级数是a+b 。
⚠️求反应速率方程时,不用求出k 值,只要求出a 、b 的值,并标明物质A 、B 即可。
知反应速率常数求反应级数?(看常数K 上L 的指数,+1就是级数)解:对于非基元反应,常数k 单位:(mol ·L -1)1-(x+y)•S -1零级反应mol ·L -1·S -1 ( 前0) 一级反应S -1 (前1)二级反应mol -1·L ·S -1 ( 前2) 三级反应mol -2·L 2·S -1 (前3)(2)温度:由题意温度升高,K Θp 增大,反应是吸热反应还是放热反应?解:温度升高,K Θp 增大,根据吕·查德里(Le ·Chatelier)原理,可以判知该反应为吸热反应。
由阿仑尼乌斯公式可以看出?(由公式看出,唯一能加快反应速率的是温度) 解:公式写作 k=Ae -Ea/RT (指数式)。
k 为速率常数,R 为摩尔气体常量,T 为热力学温度,Ea 为表观活化能,由实验数据求得,又叫实验活化能,A 为指前因子(也称频率因子)升高温度,速率常数k 增大;加入催化剂,速率常数k 增大;其余,k 均不变; 平衡常数:温度不变,平衡常数不变。




第三章 化学反应的速率一、化学反应速率的概念化学反应速率是通过单位时间间隔内某反应物或某生成物浓度的变化来表示。
物质浓度的变化可以采用化学分析和仪器分析的方法测定。
单位为31mol dm s --⋅⋅,31mol dm min --⋅⋅等。
常用平均速率和瞬时速率来表示。
化学反应的瞬时速率等于时间间隔内0t ∆→时的平均速率的极限值。
表达式为0=lim t υυ∆→。
通常通过作图法来求瞬时速率,在c t -图像中,曲线上某一点切线的斜率的绝对值就是对应于该点横坐标t 的瞬时速率υ。
最有实际意义和理论意义的瞬时速率是初始速率0υ。
用反应进度定义的反应速率——对于任意一个化学反应0=B Bv B ∑,其反应速率可定义为单位体积内反应进度随时间的变化率。
表达式为1d d V tξυ=⋅ 用反应进度定义的反应速率值与物质的选择无关,也就是一个反应只有一个化学速率值,但与计量数有关。
二、化学反应速率理论——碰撞理论和过渡状态理论1、碰撞理论化学反应的发生,总要以反应物之间的接触为前提,即反应物分子之间的碰撞是有先决条件。
有效碰撞——能够发生反应的碰撞(1)能量要足够大(2)反应物分子要定向碰撞活化能和活化分子组——将具备足够能量(碰撞后足以反应)的反应物分子组,称为活化分子组。
分子组的能量要求越高,活化分子组的数量越少,这种能量要求称之为活化能,用a E 表示。
a E 在碰撞理论中,认为和温度无关。
a E →∞,活化分子组数则越少,有效碰撞分子数越小,故反应速率越慢。
分子不断碰撞,能量不断转移,因此分子的能量不断变化,故活化分子组也不是固定不变的。
但只要温度一定,活化分子组的百分数是固定的。
2、过渡状态理论(又称活化配合物理论)过度状态理论认为:反应的首要条件仍是反应物分子必须互相碰撞,但两个具有足够能量的反应物分子相互碰撞时,原来的化学键要断裂,新的化学键要形成,原子将要重新排列,经过一个过度状态,形成一种活化配合物。