实验三 小鼠脾细胞的分离制备及其活力检测
- 格式:doc
- 大小:24.00 KB
- 文档页数:2

姓名刘睿实验题目小鼠脾细胞原代培养及染色法鉴定细胞死活科目细胞生物学实验系年级2012级生科2班学号201200140063同组者马俊才日期2012.04.02【实验目的】1.回顾细胞培养的有关知识;2.学习小鼠脾细胞的分离技术及简单的细胞培养技术3.掌握无菌操作的具体过程及无菌操作台的使用;4.了解细胞原代培养的基本方法及操作过程;5.学习掌握染色法鉴别细胞的生死状态的原理及方法;6.学习使用血球计数板对细胞总数及活细胞数进行计数;7.学习实验过程的详细描述及实验记录。
【实验原理】1.细胞原代培养原代细胞培养是指直接从动物体内获取的细胞、组织和器官,经体外培养后,直到第一次传代为止。
这种培养,首先用无菌操作的方法,从动物体内取出所需的组织(或器官),经消化,分解成单个游离细胞,在人工培养下,使其不断的生长及繁殖。
细胞培养是一种操作繁琐而又要求十分严谨的实验技术。
是用无菌的方法将动物体内的组织(或器官)取出,模拟动物体内的生理条件,在体内进行培养,使其不断生长、繁殖,人们借以观察细胞生长、繁殖、细胞分化以及细胞衰老等过程的生命现象。
要使细胞能在体外长期生长,必须满足两个基本要求:一是供给细胞存活所必须的条件,如适量的水、无机盐、氨基酸、维生素、葡萄糖及其有关的生长因子、氧气、适宜的温度,注意外环境酸碱度与渗透压的调节。
二是严格控制无菌条件。
细胞培养的意义:具有其他生物技术无可比拟的优点培养条件易改变和控制便于单因子分析便于人们直接对细胞内结构、细胞生长及发育等过程的观察在生物学的各个领域如分子生物学、细胞生物学、遗传学、免疫学、肿瘤学及病毒学等已被广泛应用。
细胞培养的局限性在脱离机体复杂环境下细胞培养条件与躯体环境有一定距离观察到的结果有时难以正确反映机体内的状况细胞培养得到的产物少。
2.染色法鉴别细胞死活细胞死活的鉴定方法有很多种,常用的有染色法和仪器分析法。
染色法是常用的细胞死活鉴定方法,简便,易于操作。

解刨小鼠提取脾细胞实验报告
解刨小鼠提取脾细胞实验报告
一、实验目的
本实验旨在通过解刨小鼠,提取脾细胞,以便进行后续的免疫学研究。
二、实验材料和仪器
1. 实验材料:小白鼠、生理盐水、70%乙醇、福尔马林、石蜡等。
2. 实验仪器:手术刀、注射器、组织培养皿、显微镜等。
三、实验步骤
1. 解剖小白鼠:将小白鼠放入无菌条件下,用70%乙醇消毒表面。
然后用手术刀在胸部进行切口,打开胸腔,找到心脏,将心脏割断。
接
着将小白鼠向上抬起头部,用手术刀在颈部进行切口,打开颈部皮肤
和肌肉层,在颈动脉两侧夹住气管和食管,并清除周围组织。
最后将
气管和食管割断,并将颈动脉及其分支全部割断。
2. 取出脾脏:用注射器注入生理盐水,将脾脏从周围组织中分离出来,然后将脾脏放入组织培养皿中加入生理盐水洗涤。
3. 细胞处理:将清洗干净的脾脏放入福尔马林中固定30分钟,再用酒精和石蜡等物质进行包埋。
最后用显微镜观察并提取细胞。
四、实验结果
通过本实验,成功地解剖出小白鼠,并提取了脾细胞。
经过显微镜观察,我们可以看到细胞形态正常,并且数量充足。
五、实验注意事项
1. 实验操作要求严格无菌。
2. 解剖小白鼠时要保持手术刀的锋利度。
3. 在取出脾脏时要注意不要损伤其结构。
4. 细胞处理过程中要避免污染。
六、实验结论
通过本实验,我们成功地解剖了小白鼠并提取了脾细胞。
这为后续的免疫学研究奠定了基础。
同时,在操作过程中也需要注意无菌和仪器使用等方面的细节。

小鼠脾细胞原代培养,死活细胞鉴定山东大学实验报告山东大学实验报告 2013年6月8日姓名陈少坤系年级 2011级生科2班同组者张劲松王洪善科目细胞实验题目小鼠脾细胞原代培养,死活细胞鉴定一、前言细胞培养的概念:多细胞生物的细胞可以被分离出来,然后在体外特殊培养环境中继续存活,并保持其生理、生化特性直接从生物体分离出来,在体外培养过程中尚未分裂、增殖的细胞,称为原代培养细胞。
原代培养细胞在一定条件下可以继续增殖,在数量上大量扩增,这时就成为继代培养细胞。
细胞培养基要满足细胞的生长需要,包括 pH、渗透压、营养和生长因子等,已保证细胞的增殖。
细胞培养皿是特殊制造的使细胞可以贴壁。
细胞培养箱常指二氧化碳培养箱。
它可以提供合适的温度和二氧化碳浓度。
二氧化碳和培养基中的缓冲系统共同作用,保持细胞培养液的酸碱度。
超净台通过将空气进行过滤,为细胞培养的各种操作提供了一个干净的环境,使细胞培养免于细菌和真菌的污染。
细胞培养特点:大量实验材料单一、纯粹细胞类型培养基的成分可控,即生长条件可控/全合成、无血清培养基易于观察易于操作,改造活细胞必需通过控制物质进出细胞膜来保持内部生理环境的稳定性。
细胞死后,细胞膜通透性发生改变,原先不能进入细胞的物质也能够进入细胞。
台盘蓝染料正常情况下被活细胞阻拦在细胞膜外,只有细胞膜受损或者细胞死亡后,才能进入细胞。
因此,活细胞一般不能被台盘蓝染色,而死细胞会被染成蓝色。
伊红和苏木精是最常用的细胞染色剂。
山东大学实验报告山东大学实验报告二、实验目的回顾细胞培养的有关学习分离小鼠脾细胞的技术学习悬浮细胞的计数学习简单的细胞培养技术学习实验过程的详细描述及实验记录三、实验用品试剂:小鼠,70%酒精,蒸馏水, PBS, 细胞培养液,台盘蓝,伊红溶液仪器解剖盘,镊子,剪子,盖玻片,载玻片,显微镜,吸管,血细胞计数器四、实验步骤一、原代培养1.采用颈椎脱臼的方法牺牲小鼠。
2.将小鼠浸泡在 70%酒精中几分钟。

小鼠脾细胞的制备实验报告一、实验目的本实验旨在掌握从小鼠体内分离和制备脾细胞的方法,为后续的免疫学实验和细胞生物学研究提供材料。
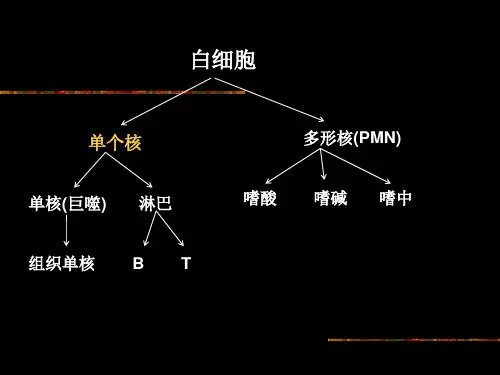
二、实验原理脾脏是机体重要的免疫器官,富含各类免疫细胞,如淋巴细胞、巨噬细胞等。
通过机械破碎和细胞筛过滤的方法,可以将脾组织分散成单细胞悬液,再经过离心、洗涤等步骤,去除杂质和红细胞,从而获得较为纯净的脾细胞。
三、实验材料与设备1、实验动物:健康成年小鼠2、主要试剂:无菌 PBS 缓冲液、红细胞裂解液、胎牛血清、培养基3、实验器材:手术器械(剪刀、镊子)、无菌培养皿、细胞筛、离心机、移液器、显微镜等四、实验步骤1、小鼠的处理提前将小鼠禁食不禁水 12 小时。
采用颈椎脱臼法处死小鼠,将其仰卧固定在解剖板上。
用 75%的酒精消毒小鼠腹部皮肤。
2、脾脏的获取在无菌条件下,沿腹部中线剪开皮肤和腹膜,暴露腹腔。
小心地分离出脾脏,避免损伤周围组织和血管。
将脾脏放入盛有少量无菌 PBS 缓冲液的培养皿中。
3、脾细胞的制备用镊子和剪刀将脾脏剪成小块,置于细胞筛上。
用注射器活塞轻轻研磨脾脏组织,使细胞通过筛网进入下方的离心管中。
加入适量 PBS 缓冲液冲洗细胞筛,收集全部细胞悬液。
4、离心和洗涤将细胞悬液离心(1500rpm,5 分钟),弃上清。
加入红细胞裂解液,轻轻吹打混匀,室温静置 5 分钟,以裂解红细胞。
再次离心(1500rpm,5 分钟),弃上清。
用 PBS 缓冲液洗涤细胞 2-3 次,每次离心后弃上清。
5、细胞计数和培养用适量含血清的培养基重悬细胞。
取少量细胞悬液,加入台盼蓝染液,在显微镜下计数活细胞数量。
根据实验需要,将细胞调整至合适的浓度,接种于培养板或培养瓶中,置于培养箱中培养。
五、实验结果1、细胞形态观察在显微镜下观察制备的脾细胞,可见多数细胞呈圆形,大小不一,有细胞核。
细胞形态完整,无明显的破碎和损伤。
2、细胞计数结果经台盼蓝染色后,计数活细胞比例,通常应在 90%以上。

小鼠脾脏淋巴细胞分离方法需要提前准备的材料:提前高压灭菌:手术器械,200目尼龙网,除菌过滤:8.5%和0.85%的Nacl溶液各40ml,1XPBS溶液,hanks液40ml。
红细胞裂解液,六孔板,培养皿,75%酒精,100ml烧杯,无菌注射器5-10ml,15ml、50ml 离心管,4mlEP管,离心机等。
1、配制的percoll工作液:配制15 ml100%percoll液(简称工作液):13.5ml percoll原液+1.5 ml 8.5%Nacl溶液混匀备用。
2、配制6个梯度,每个梯度2ml,实际配制3ml70%percoll液(1.090g/ml):2.1 ml工作液+0.9 ml 0.85%Nacl溶液混匀备用60%percoll液(1.077g/ml):1.8 ml工作液+1.2 ml 0.85%Nacl溶液混匀备用50%percoll液(1.067g/ml):1.5 ml工作液+1.5 ml 0.85%Nacl溶液混匀备用40%percoll液(1.050g/ml):1.2 ml工作液+1.8 ml 0.85%Nacl溶液混匀备用30%percoll液(1.043g/ml):0.9 ml工作液+2.1 ml 0.85%Nacl溶液混匀备用20%percoll液(1.031g/ml):0.6 ml工作液+2.4 ml 0.85%Nacl溶液混匀备用找一只15ml离心管,从低到高(20% percoll液→70%percoll液)依次装入,装好备用。
3、小鼠脾脏细胞分离(1)颈椎脱臼处死小鼠。
75%酒精浸泡10min(2)无菌条件下取出小鼠脾脏,去除筋膜等置于Hanks’ 液中,将脾脏放入2ml离心管中剪碎。
(3)将200目尼龙网置于六孔板上,用注射器头研磨,过程中不停加Hanks’ 液冲洗。
(4)收集脾细胞悬液置于离心管中,1500rpm 10min,弃上清。
(5)加10ml?红细胞裂解液混悬沉淀,室温静置10min,再1500rpm 10min(6)洗三遍,1500rpm 5min,离心去上清(7)加入2ml 0.85%Nacl溶液混悬沉淀。

小鼠脾脏单个核细胞分离及细胞计数实验时间:实验地点:实验人:1实验原理小鼠脾脏位于上腹部左后侧,体积较大,长条形,属于外周免疫器官。
外周血中淋巴细胞可经再循环驻如脾脏等外周免疫器官的特定区域,所以富含各类免疫细胞。
免疫细胞的分离:采用红细胞裂解法,是根据细胞对渗透压变化的敏感度。
红细胞由于细胞结构较为简单,仅有细胞膜结构,对于膨胀的耐受能力较差,因此绝大部分就会涨破,受到破坏。
是一种比较温和的去除红细胞最简便易行的方法。
2实验材料:1)健康小鼠2)手术器械(剪刀、镊子)、解剖板3)70%乙醇4)PBS缓冲液、红细胞裂解液(ACK)5)0.2%台盼蓝6)细胞计数板、计数器7)离心机8)显微镜3实验方法:3.1取小鼠脾脏●将小鼠颈椎脱位处死,用酒精消毒。
●用剪刀剪开背部皮肤,再找到脾脏,用镊子夹出脾脏并剪除周围组织。
3.2制备单个核细胞悬液●将取出的脾脏置于盛有3mlPBS缓冲液的平皿中,然后再置于尼龙指套中,用针芯轻轻碾压使得单个核细胞悬浮于平皿中。
●吸取平皿中细胞悬液置于刻度离心管(15ml)中,以1500rpm离心10min,弃去上清液,加入ASK至2-3ml,轻轻吹打混匀并放置2min,以破坏红细胞。
然后加入PBS缓冲液至10ml,以1500rpm离心10min。
●弃去上清液,用PBS缓冲液定容至2ml,吹打混匀即为小鼠脾脏单个核细胞悬液。
3.3计算细胞浓度稀释十倍,随机选取一个大方格计数细胞计数为324个,计算细胞浓度为324×104×10=3.24×107/ml3.4计算细胞活力在总计为324个细胞中计数,死亡细胞有16个,计算细胞活力为:324-16/324×100%=95.1%在理论范围之内4实验结果4.1研磨脾脏得到细胞悬液本实验中将小鼠的脾脏放入尼龙指套内,置于少量PBS液中缓慢研磨,获得细胞悬液。
实验中,我们发现尼龙指套不能滤去所有结缔组织,操作中会有结为絮状团块的结缔组织。

小鼠脾脏单个核细胞的分离一、实验目的1. 熟悉细胞分离的基本原理2. 掌握小鼠脾脏单个核细胞的分离的方法3. 掌握流式细胞术检测细胞表面标志的方法二、实验原理1.台盼蓝染色:正常的活细胞,胞膜结构完整,能够排斥台盼蓝,使之不能够进入胞内。
丧失活性或细胞膜不完整的细胞,胞膜的通透性增加,可被台盼蓝染成蓝色。
通常认为细胞膜完整性丧失,即可认为细胞已经死亡。
2.脾是人和脊椎动物最大的淋巴器官。
人的脾脏位于左季肋区的后外侧部,呈卵圆形,脾是血循环中重要的滤过器,能清除血液中的异物、病菌以及衰老死亡的细胞,特别是红细胞和血小板。
三、实验材料小鼠手术器械(剪刀、镊子)、酒精喷壶、杀鼠板平皿,尼龙膜指套、研磨棒、吸管、试管、EP管、移液器和tipsPBS缓冲液、红细胞裂解液(ACK)细胞计数板0.2%台盼蓝染液8.显微镜四、实验步骤(一)取小鼠脾脏1.小鼠颈椎脱位处死——用拇指和食指往下按住鼠头,另一只手抓住鼠尾,用力稍向后上方一拉,使之颈椎脱臼,造成脊髓与脑髓断离。
2.取其后右侧卧位,消毒左侧背腹交界处皮肤,剪取脾脏并尽量将去除脂肪及筋膜组织。
(二)制备单个核细胞悬液:1.将脾脏置于盛有5mLPBS缓冲液的平皿中,然后再置于尼龙指套中。
用针芯轻轻碾磨使单个核细胞通过尼龙指套悬浮于平皿中;2.吸取平皿中细胞悬液(再次用尼龙指套过滤)置于刻度离心管中,加PBS缓冲液(可冲洗培养皿)至10mL,以1500rpm离心5min。
弃去上清,弹散细胞沉淀,加ACK2ml,轻轻吹打混匀并放置3-4min,以破坏红细胞。
然后加PBS缓冲液至10ml,以1500rpm离心5min;3.弃去上清,弹散细胞沉淀,加PBS缓冲液至2ml,吹打混匀即为小鼠脾脏单个核细胞悬液。
(放置冰上)4.取100uL至EP管中,进行计数和活力测定(建议5倍稀释)5.以1500rpm离心5min,根据计数结果稀释到合适的浓度a)注:减少操作的时间,并放置冰上或低温离心机里以保证细胞活力(三)计算细胞浓度1.将上述细胞悬液做一定倍数的稀释;(建议5倍稀释)。

脾细胞的提取
1、用颈椎脱臼法处死小鼠,75%的酒精浸泡2-3分钟。
2、将小鼠移入超净工作台内,无菌条件下,以仰卧位固定在解剖盘上。
3、用眼科镊子夹起腹股沟中线处皮肤,用眼科剪做一横切口。
用镊子捏住切口
两端的皮肤朝着小鼠的尾部和头部纵向撕开皮肤,暴露腹腔膜壁。
4、剪开腹腔壁膜,用镊子夹出脾脏,并用剪子剪去与其相连的组织,将脾脏放入无菌PBS中。
5、用注射器内芯或者研棒研磨脾脏,或用2ml注射器赶出淋巴细胞,过100目
筛网,收集分离的脾细胞悬液,1200r/min离心5min,弃上清。
6、弹散细胞团,加红细胞裂解液5mL左右,混匀脾细胞,静置5-6min,待红细
胞完全破碎,加大量PBS,1200r/min离心5min,弃上清。
7、加入PBS,混匀,再过100目筛网,1200r/min离心5min。
8、倒掉上清液,加入1640培养液,用吸管吹打均匀,计数,接种。
附:红细胞裂解液(ACK)的配制(500ml)
1.NH4Cl 3.735g。
2.Tris-base 1.3g。
3.用HCl调pH值至7.2。
4.过0.22 um 滤膜。

实验三小鼠脾细胞的分离制备及其活力检测
实验二小鼠脾细胞的分离制备及其
活力检测
材料
1、器材:离心机、手术剪、镊子、平皿、10ml离心管,5ml 注射器等
2、动物:昆明小鼠(25g左右,雄性)
3、试剂:碘伏、红细胞裂解液、Hank’s 液、0.4%台盼兰染液
方法
1、取小鼠一只,置于蜡盘上,颈椎脱臼处死,用碘伏消毒小鼠腹部后,打开腹腔,取出脾,去除周围的结缔组织,放入含有5ml Hank’s的平皿中。
2、用眼科剪将脾一端剪一小口后,将含有5ml Hank’s液的注射器从脾的另一端刺入脾,缓缓注入Hank’s液,即可见脾细胞悬液流入平皿,注意在注射Hank's液同时不断转动针头方向,直至脾变苍白为止。
3、将平皿倾斜静置10 min后,用干净吸管吸取细胞液到10ml 离心管中,平衡后,离心(1500rpm 10min),将
离心管盖子打开,快速弃上清液,往管底的细胞中加入1ml的红细胞裂解液,充分混匀20秒,立即加入9ml的Hank’s液,混匀,离心(1500rpm 10min),弃上清,将细胞定容到1ml。
4、吸取0.1ml的细胞悬液到干净的试管中,加入等量的0.4%台盼兰染液,混匀,吸取1滴的细胞液到玻片上,加上盖片,显微镜观察:死亡细胞染成蓝色,活细胞不染色。
正常情况下,活细胞数应达到95%以上。

小鼠脾脏淋巴细胞分离与计数实验报告小鼠脾脏淋巴细胞分离与计数实验报告一、引言淋巴细胞是免疫系统中重要的细胞成分,其在免疫应答和抗体产生中发挥着关键作用。
为了研究淋巴细胞的功能和特性,需要将其从组织中分离出来并进行计数。
本实验旨在通过对小鼠脾脏进行淋巴细胞分离和计数,来获取关于淋巴细胞数量和纯度的信息。
二、材料与方法1. 实验动物:使用C57BL/6小鼠。
2. 仪器与试剂:离心管、离心机、PBS缓冲液、0.83%氯化铵溶液。
3. 实验步骤:A. 准备工作:i. 将离心管预冷至4℃。
ii. 准备PBS缓冲液,并保持在4℃。
B. 小鼠准备:i. 用无菌技术将小鼠安全固定在手术台上。
ii. 使用无菌器械,剪开腹部皮肤和腹壁,暴露脾脏。
iii. 小心取出脾脏并放入含有PBS缓冲液的离心管中。
C. 细胞分离:i. 使用无菌器械,将脾脏组织切碎至细胞悬浮液状态。
ii. 将细胞悬浮液通过70μm滤网过滤,以去除大块组织残渣。
iii. 向过滤后的细胞悬浮液中加入等体积的0.83%氯化铵溶液,进行红细胞溶解。
iv. 用PBS缓冲液洗涤淋巴细胞沉淀,重复此步骤2-3次。
D. 细胞计数:i. 取适量的淋巴细胞悬浮液,加入等体积的尝试涂片溶剂进行稀释。
ii. 在尝试涂片上使用布朗管计数室计数淋巴细胞数量。
三、结果根据实验操作所得数据,我们得到了以下结果:1. 成功分离出小鼠脾脏中的淋巴细胞。
2. 经过红细胞溶解和洗涤步骤后,淋巴细胞沉淀呈现白色悬浮液状态。
3. 在计数室中观察到淋巴细胞的形态特征,如小型、圆形和较大的核。
四、讨论本实验成功地分离出了小鼠脾脏中的淋巴细胞,并通过计数室观察到了其形态特征。
然而,有一些潜在问题需要考虑和改进:1. 纯度问题:尽管我们成功分离出淋巴细胞,但在实验过程中是否存在其他细胞类型的污染仍需进一步验证。
可以通过流式细胞术等技术来评估纯度。
2. 细胞活力:在实验过程中,我们没有对淋巴细胞进行活力测试。
小鼠脾脏单个核细胞的分离一、实验目的1。
熟悉细胞分离的基本原理2。
掌握小鼠脾脏单个核细胞的分离的方法3。
掌握流式细胞术检测细胞表面标志的方法二、实验原理1.台盼蓝染色:正常的活细胞,胞膜结构完整,能够排斥台盼蓝,使之不能够进入胞内。
丧失活性或细胞膜不完整的细胞,胞膜的通透性增加,可被台盼蓝染成蓝色。
通常认为细胞膜完整性丧失,即可认为细胞已经死亡。
2.脾是人和脊椎动物最大的淋巴器官.人的脾脏位于左季肋区的后外侧部,呈卵圆形,脾是血循环中重要的滤过器,能清除血液中的异物、病菌以及衰老死亡的细胞,特别是红细胞和血小板。
三、实验材料小鼠手术器械(剪刀、镊子)、酒精喷壶、杀鼠板平皿,尼龙膜指套、研磨棒、吸管、试管、EP管、移液器和tipsPBS缓冲液、红细胞裂解液(ACK)细胞计数板0。
2%台盼蓝染液8。
显微镜四、实验步骤(一)取小鼠脾脏1.小鼠颈椎脱位处死-—用拇指和食指往下按住鼠头,另一只手抓住鼠尾,用力稍向后上方一拉,使之颈椎脱臼,造成脊髓与脑髓断离。
2.取其后右侧卧位,消毒左侧背腹交界处皮肤,剪取脾脏并尽量将去除脂肪及筋膜组织.(二)制备单个核细胞悬液:1.将脾脏置于盛有5mLPBS缓冲液的平皿中,然后再置于尼龙指套中。
用针芯轻轻碾磨使单个核细胞通过尼龙指套悬浮于平皿中;2.吸取平皿中细胞悬液(再次用尼龙指套过滤)置于刻度离心管中,加PBS缓冲液(可冲洗培养皿)至10mL,以1500rpm离心5min。
弃去上清,弹散细胞沉淀,加ACK2ml,轻轻吹打混匀并放置3-4min,以破坏红细胞。
然后加PBS缓冲液至10ml,以1500rpm离心5min;3.弃去上清,弹散细胞沉淀,加PBS缓冲液至2ml,吹打混匀即为小鼠脾脏单个核细胞悬液。
(放置冰上)4.取100uL至EP管中,进行计数和活力测定(建议5倍稀释)5.以1500rpm离心5min,根据计数结果稀释到合适的浓度a)注:减少操作的时间,并放置冰上或低温离心机里以保证细胞活力(三)计算细胞浓度1.将上述细胞悬液做一定倍数的稀释;(建议5倍稀释)。
小鼠脾细胞线粒体的分离与活体染色山东大学实验报告 2014/11/11 姓名:XX 系年级:2XX3级齐鲁医学班学号:20XXXXXXXX 实验题目: 小鼠肝细胞线粒体的活体染色及观察同组者: XXX 小白鼠肝细胞线粒体的活体染色与观察一 (【实验目的】1(观察小白鼠肝细胞内线粒体的形态和结构。
2(学习和掌握细胞的超活染色技术。
二(【实验原理】超活染色实验原理:超活染色也称活体染色,是指对生活有机体的细胞或组织能着色但又无毒害的一种染色方法。
超活染色的目的是显示生活细胞内的某些结构,而不影响细胞的生命活动和产生任何物理、化学变化以致引起细胞的死亡。
应用:活染技术可用来研究生活状态下的细胞形态结构和生理、病理状态。
活体染色根据所用染色剂的性质和染色方法的不同,通常把活体染色分为体内活染与体外活).体内活染是以胶体状的染料溶液注入动、植物体内,染料的胶粒固定、堆积染两类。
(1在细胞内某些特殊结构里,达到易于识别的目的。
(2).体外活染又称超活染色,它是由活的动、植物分离出部分细胞或组织小块,以染料溶液浸染,染料被选择固定在活细胞的某种结构上而显色。
活体染料之所以能固定、堆积在细胞内某些特殊的部分,主要是染料的“电化学,特性起重要作用。
碱性染料的胶粒表面带阳离子,酸性染料的胶粒表面带有阴离子,而被染的部分本身也是具有阴离子或阳离子,这样,它们彼此之间就发生了吸引作用,从而使样品着色。
但不是任何染料皆可以作为活体染色剂之用,应选择那些对细胞无毒性或毒性极小的染料。
活体染色剂选择原则,(1).对细胞无毒性或毒性极小的染料;(2).具有电化学特性;(3).配成稀淡的溶液来使用;(4).一般是以碱性染料最为适用。
线粒体是细胞进行呼吸作用的场所,其形态和数量随不同物种、不同组织器官和不同的生理状态而发生变化。
本实验常用活体染色剂——詹纳斯绿B詹纳斯绿B是毒性较小的碱性染料,可专一地堆线粒体进行超活染色,这是由于线粒体内的细胞色素氧化酶系的作用,使染料始终保持氧化状态(即有色状态),呈蓝绿色;而线粒体周围的细胞质中,这些染料被还原成为无色的色基(即无色状态)。
提取小鼠体内脾细胞实训过程记录实验目的:通过体内脾细胞提取,研究免疫细胞的增殖、分化和功能等方面的生理生化特性。
实验原理:小鼠脾脏是免疫细胞的主要器官,其中包含了大量的淋巴细胞、巨噬细胞、树突状细胞等。
提取小鼠脾细胞,可用于免疫细胞的培养、表型分析、功能研究等。
实验步骤:1.小鼠剖腹取脾:先在实验动物按照规范的动物操作技术下施行人道安乐死,随后对小鼠进行无菌外科手术,在消毒的手术台上固定小鼠,并用无菌剪刀切开腹部,显露腹腔。
定位到脾脏后,用消毒的剪刀和镊子轻轻牵引脾脏,将脾脏完整地取出。
2.清洗脾脏:将取出的脾脏置于无菌PBS缓冲液中,用无菌镊子和剪刀把脾脏上的脂肪和血管组织清除干净,并将脾脏放入含无菌PBS的培养皿中。
3.细胞提取:用无菌注射器灌注0.5mL无菌PBS缓冲液,将其注入脾脏中,用剪刀剪碎脾脏组织,使细胞充分分散。
接着,将脾脏组织转移到一个50mL离心管中,并加入5mL无菌PBS缓冲液。
用离心机将脾脏组织沉淀离心,将上清液倒掉,沉淀的细胞被称为脾单细胞悬液。
4.细胞计数:将脾单细胞悬液重新悬浮在含PBS的15mL离心管中,用显微镜和细胞计数板计数细胞。
根据计数结果,计算细胞的浓度。
5. 离心沉淀:将细胞悬液倒入离心管中,并进行离心,离心速度约为1500 rpm,离心时间为5分钟。
离心后,将上清液丢掉,离心管中的细胞沉淀称为脾细胞。
6.细胞培养:将脾细胞再次悬浮在含有适当培养基的培养皿中,加入足够的细胞密度,放入恒温培养箱中培养。
培养条件根据不同实验的要求进行设置,一般情况下,培养基中含有的细胞因子、血清和其他添加剂都是必要的。
7.实验后处理:根据具体实验要求,对培养的脾细胞进行进一步的实验处理,如分离、染色、鉴定、培养基替换等。
实验注意事项:1.手术操作时要注意无菌操作,避免污染。
2.取脾脏后要迅速进行后续操作,避免细胞损伤。
3.细胞培养过程中,要保持适当的温度和湿度,以及细胞所需的培养基成分。
小鼠脾细胞的分离原理
小鼠脾细胞的分离原理基本上可分为以下几个步骤:
1. 选择性切除脾脏:将小鼠固定在手术台上,进行全麻手术,使用消毒的手术刀仔细切开腹部皮肤,暴露脾脏。
根据需要,将脾脏切除并置于冷盐水或试管中。
2. 细胞解聚:将脾脏置于含有细胞解聚酶(例如胰蛋白酶)的消化液中,用温和的消化条件进行消化。
消化时间和消化液浓度可根据需要进行调整。
3. 细胞过滤:将消化后的细胞悬液通过细胞过滤器进行过滤,以去除大块组织碎片和残留的不可消化物质。
过滤器的孔径大小可根据实验需求选择。
4. 细胞沉降:通过离心将细胞悬液离心沉淀,移除上清液并保留沉淀。
沉淀中的细胞主要是小鼠脾脏中的淋巴细胞和其他免疫细胞。
5. 细胞分离:使用细胞分离液(例如离心梯度离心液)对细胞沉降物进行离心梯度离心。
离心梯度离心液可使不同细胞类型在不同密度层次上分布。
根据需要,可使用手动或自动离心设备进行离心。
6. 细胞收集:从离心管中收集位于所需密度梯度上层的细胞组分,并将其洗涤与培养基中以去除离心梯度离心液的残余物质。
7. 细胞计数与培养:使用显微镜和细胞计数板来计数和评估分离的细胞的数目和纯度。
接下来,将细胞移植至培养皿或试管中进行后续细胞培养或实验。
小鼠脾脏淋巴细胞分离与计数实验报告1. 引言小鼠脾脏淋巴细胞是免疫系统中重要的组成部分,它们在抵御病原体侵袭和保护机体免受自身免疫疾病侵害中发挥着关键的作用。
因此,为了研究小鼠脾脏淋巴细胞的特性和功能,我们需要将其从脾脏中分离出来并进行计数。
本实验旨在描述小鼠脾脏淋巴细胞的分离与计数方法。
2. 材料与方法2.1 实验材料•小鼠脾脏样品•细胞培养基•消化酶•离心管•细胞计数板•显微镜2.2 实验方法2.2.1 小鼠脾脏样品的获取1.选择适龄的小鼠,以确保其脾脏发育成熟。
2.用消毒工具将小鼠颈部暴露,进行脾脏的解剖。
3.将脾脏置于无菌的容器中,迅速将其转移到实验室。
2.2.2 小鼠脾脏淋巴细胞的分离1.将小鼠脾脏放置在无菌离心管中,并加入足够的细胞培养基。
2.使用搅拌器或离心机将脾脏组织均匀分散于培养基中。
3.加入消化酶,按照说明书中的浓度和时间进行消化。
4.在消化结束后,用细胞培养基冲洗脾脏组织,以去除余留的消化酶。
2.2.3 小鼠脾脏淋巴细胞的计数1.取适量的脾脏细胞悬液,加入细胞计数板中。
2.在显微镜下观察并计数细胞计数板中的淋巴细胞数量。
3. 实验结果3.1 小鼠脾脏样品的获取从适龄的小鼠身上成功解剖出脾脏,并将其转移到实验室。
3.2 小鼠脾脏淋巴细胞的分离经过消化酶的作用,小鼠脾脏细胞成功地被分离并悬浮于培养基中。
3.3 小鼠脾脏淋巴细胞的计数通过显微镜观察,我们计数了细胞计数板中的淋巴细胞数量,并记录了结果。
具体数据如下: 1. 格子1:20个淋巴细胞 2. 格子2:18个淋巴细胞 3. 格子3:22个淋巴细胞 4. 格子4:19个淋巴细胞根据计数结果求平均值,得到平均每格淋巴细胞数目为19.75个。
4. 结论根据我们的实验结果,我们成功地分离出小鼠脾脏淋巴细胞,并进行了有效的计数。
通过计数结果,可以推断小鼠脾脏淋巴细胞的数量在每格约为19.75个左右。
这些实验结果为进一步研究小鼠脾脏淋巴细胞的特性和功能提供了基础数据。
小鼠脾脏分离方法
小鼠脾脏分离的方法大致分为以下几个步骤:
1. 准备实验器材和试剂:包括小鼠、手术器械(注射器、剪刀、镊子等)、培养介质等。
2. 麻醉小鼠:将小鼠固定在麻醉机的透明密闭室中,在室内添加气体麻醉剂(如异氟醚)使其麻醉,直到小鼠没有任何反应。
3. 消毒和剪毛:用75%酒精和消毒棉球彻底消毒小鼠的腹部。
将小鼠放在消毒台上,使用剪刀修剪腹部的毛发。
4. 制备手术器械:将手术器械放在消毒台上,使用消毒液进行消毒。
5. 手术操作:使用剪刀和镊子,小心地切开小鼠的腹腔。
找到脾脏,并用剪刀和镊子将其取出。
6. 分离脾脏细胞:将脾脏放入含有适宜培养液的离心管中。
用剪刀和镊子将脾脏分成小块。
7. 细胞过滤:将分块的脾脏组织用细胞过滤器过滤,以去除大块组织和残渣。
8. 细胞计数:使用显微镜和细胞计数板,将过滤后的细胞进行计数。
9. 实验操作:根据实验的需要,将分离的脾脏细胞进行相应的实验操作,如培养、染色等。
10. 实验结束:在实验完成后,将剩余的细胞进行妥善保存或处理,清洗实验器材,并按规定进行废弃物处理。
实验二小鼠脾细胞的分离制备及其
活力检测
材料
1、器材:离心机、手术剪、镊子、平皿、10ml离心管,5ml 注射器等
2、动物:昆明小鼠(25g左右,雄性)
3、试剂:碘伏、红细胞裂解液、Hank’s 液、0.4%台盼兰染液
方法
1、取小鼠一只,置于蜡盘上,颈椎脱臼处死,用碘伏消毒小鼠腹部后,打开腹腔,取出脾,去除周围的结缔组织,放入含有5ml Hank’s的平皿中。
2、用眼科剪将脾一端剪一小口后,将含有5ml Hank’s液的注射器从脾的另一端刺入脾,缓缓注入Hank’s液,即可见脾细胞悬液流入平皿,注意在注射Hank's液同时不断转动针头方向,直至脾变苍白为止。
3、将平皿倾斜静置10 min后,用干净吸管吸取细胞液到10ml离心管中,平衡后,离心(1500rpm 10min),将
离心管盖子打开,快速弃上清液,往管底的细胞中加入1ml的红细胞裂解液,充分混匀20秒,立即加入9ml的Hank’s液,混匀,离心(1500rpm 10min),弃上清,将细胞定容到1ml。
4、吸取0.1ml的细胞悬液到干净的试管中,加入等量的0.4%台盼兰染液,混匀,吸取1滴的细胞液到玻片上,加上盖片,显微镜观察:死亡细胞染成蓝色,活细胞不染色。
正常情况下,活细胞数应达到95%以上。