【精准解析】2021新高考化学鲁科版:第8章+专题突破26+滴定曲线(pH曲线)分析
- 格式:pdf
- 大小:808.69 KB
- 文档页数:4
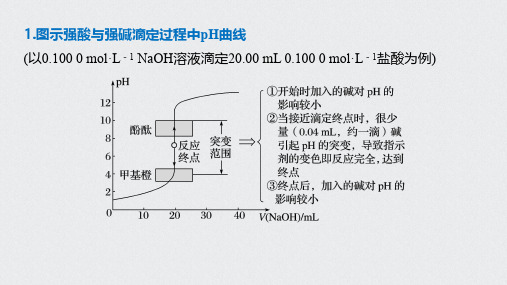
1.图示强酸与强碱滴定过程中pH曲线(以0.100 0 mol·L-1 NaOH溶液滴定20.00 mL 0.100 0 mol·L-1盐酸为例)2.强酸(碱)滴定弱碱(酸)pH曲线比较氢氧化钠滴定等浓度等体积的盐酸、醋酸的滴定曲线盐酸滴定等浓度等体积的氢氧化钠、氨水的滴定曲线曲线起点不同:强碱滴定强酸、弱酸的曲线,强酸起点低;强酸滴定强碱、弱碱的曲线,强碱起点高突跃点变化范围不同:强碱与强酸反应(强酸与强碱反应)的突跃点变化范围大于强碱与弱酸反应(强酸与弱碱反应)特别提醒 恰好中和=酸碱恰好完全反应≠滴定终点≠溶液呈中性。
1.(2019·山西大同模拟)常温下,用0.10 mol·L -1 NaOH 溶液分别滴定20.00 mL 0.10 mol·L -1 HCl 溶液和20.00 mL 0.10 mol·L -1 CH 3COOH 溶液,得到两条滴定曲线,如图所示,则下列说法正确的是A.图2是滴定盐酸的曲线B.a 与b 的关系是a <b专题精练C.E 点对应离子浓度由大到小的 顺序可能为c (CH 3COO -)> c (Na +)>c (H +)>c (OH -)D.这两次滴定都可以用甲基橙作为指示剂√解析 如果酸为强酸,则0.10 mol·L-1酸的pH为1,根据酸的初始pH知,图1为盐酸的滴定曲线,故A错误;根据图1知,a点氢氧化钠溶液的体积是20.00 mL,酸和碱的物质的量相等,二者恰好反应生成强酸强碱盐,其溶液呈中性;醋酸溶液中滴入氢氧化钠溶液,醋酸钠溶液呈碱性,所以氢氧化钠溶液的体积小于20.00 mL,a>b,故B错误;E点溶液的成分为醋酸钠和醋酸,溶液呈酸性,说明醋酸的电离程度大于醋酸钠的水解程度,盐类水解程度较小,则溶液中离子浓度可能为c(CH3COO-)>c(Na+)>c(H+)>c(OH-),故C正确;氢氧化钠和盐酸恰好反应呈中性,可以选择甲基橙或酚酞;氢氧化钠和醋酸恰好反应生成醋酸钠溶液呈碱性,只能选择酚酞,故D错误。

酸碱滴定的滴定曲线解析酸碱滴定是化学实验中常见的一种分析方法,用以确定溶液中酸碱的浓度。
在酸碱滴定实验中,滴定曲线是一个十分重要的参数,通过对滴定曲线的解析,我们可以更好地理解滴定过程,获得更准确的分析结果。
本文将对酸碱滴定的滴定曲线进行详细解析。
1. 滴定曲线的定义和特征在酸碱滴定实验中,我们将一定浓度的酸或碱溶液滴加到待测溶液中,直至达到等量点,即溶液的酸碱物质完全中和。
我们可以通过记录滴定过程中溶液的pH值,绘制出滴定曲线。
滴定曲线通常呈现出S形状,分为以下几个阶段:(1) 初始平台阶段:在滴定开始时,待测溶液的pH值处于初始平台阶段,此时已滴加的酸碱溶液对溶液的酸碱性并没有明显改变。
(2) 斜坡阶段:随着滴定酸碱溶液的不断滴加,待测溶液的pH值逐渐发生变化。
在斜坡阶段,溶液的pH值会迅速发生变化。
(3) 等量点阶段:滴定过程中存在一个等量点,即酸碱滴定溶液的化学计量反应达到平衡,酸和碱的摩尔比为1:1。
等量点阶段的pH值最为明显,达到最大或最小值。
(4) 下降曲线阶段:在等量点之后,滴加酸碱溶液会使溶液的pH值迅速下降,直至达到最终的中和点。
2. 滴定曲线的解析和应用(1) 初始平台阶段的解析:在初始平台阶段,滴定溶液的pH值处于一个相对稳定的水平。
根据初始平台的位置,我们可以初步判断待测溶液是酸性还是碱性。
若初始平台位于较低的pH值处,说明待测溶液是酸性的;若初始平台位于较高的pH值处,说明待测溶液是碱性的。
(2) 斜坡阶段的解析:斜坡阶段的斜率反映了滴定速度,斜率较大则说明在滴加少量的滴定液后溶液酸碱性立即发生变化,反之则说明酸碱中和的速率较慢。
(3) 等量点阶段的解析:等量点对应着滴定溶液的化学计量反应达到平衡状态,该点处的pH值最为明显。
根据等量点的位置,我们可以确定待测溶液的浓度。
(4) 终点和终点误差的解析:终点是指滴定溶液中指示剂的颜色发生明显变化的点,一般与等量点相近。
若终点比等量点稍微滴加多一点酸碱溶液,会导致误差的产生,因此需要掌握适当的滴定体积,以减小误差。

滴定曲线(ph曲线)分析1.图示强酸与强碱滴定过程中pH曲线(以0.100 0 mol·L-1 NaOH溶液滴定20.00 mL 0.100 0 mol·L-1盐酸为例) 2.强酸(碱)滴定弱碱(酸)pH曲线比较氢氧化钠滴定等浓度等体积的盐酸、醋酸的滴定曲线盐酸滴定等浓度等体积的氢氧化钠、氨水的滴定曲线曲线起点不同:强碱滴定强酸、弱酸的曲线,强酸起点低;强酸滴定强碱、弱碱的曲线,强碱起点高突跃点变化范围不同:强碱与强酸反应(强酸与强碱反应)的突跃点变化范围大于强碱与弱酸反应(强酸与弱碱反应)特别提醒恰好中和=酸碱恰好完全反应≠滴定终点≠溶液呈中性。
典例分析1.常温下,用0.10 mol·L-1 NaOH溶液分别滴定20.00 mL 0.10 mol·L-1 HCl溶液和20.00 mL 0.10 mol·L-1 CH3COOH溶液,得到两条滴定曲线,如图所示,则下列说法正确的是()A.图2是滴定盐酸的曲线B.a与b的关系是a<bC.E点对应离子浓度由大到小的顺序可能为[CH3COO-]>[Na+]>[H+]>[OH-]D.这两次滴定都可以用甲基橙作为指示剂答案C解析如果酸为强酸,则0.10 mol·L-1酸的pH为1,根据酸的初始pH知,图1为盐酸的滴定曲线,故A错误;根据图1知,a点氢氧化钠溶液的体积是20.00 mL,酸和碱的物质的量相等,二者恰好反应生成强酸强碱盐,其溶液呈中性;醋酸溶液中滴入氢氧化钠溶液,醋酸钠溶液呈碱性,所以氢氧化钠溶液的体积小于20.00 mL,a>b,故B错误;E点溶液的成分为醋酸钠和醋酸,溶液呈酸性,说明醋酸的电离程度大于醋酸钠的水解程度,盐类水解程度较小,则溶液中离子浓度可能为[CH3COO-]>[Na+]>[H+]>[OH-],故C正确;氢氧化钠和盐酸恰好反应呈中性,可以选择甲基橙或酚酞;氢氧化钠和醋酸恰好反应生成醋酸钠溶液呈碱性,只能选择酚酞,故D错误。

基础知识训练一、选择题:每小题只有一个选项符合题意。
1.25℃时,水中存在电离平衡:H2O H++OH-ΔH>0。
下列叙述正确的是()A.将水加热,K w增大,pH不变B.向水中加入少量NaHSO4固体,[H+]增大,K w不变C.向水中加入少量NaOH固体,平衡逆向移动,[OH-]减小D.向水中加入少量NH4Cl固体,平衡正向移动,[OH-]增大答案B解析加热促进水的电离,K w增大,pH减小,但水仍呈中性,A项错误;加入NaOH固体,[OH-]增大,C项错误;加入NH4Cl固体,NH+4水解促进水的电离,但[OH-]减小,D项错误。
2.(2019·成都质检)常温下,下列溶液的pH最大的是()A.0.02mol·L-1氨水与水等体积混合后的溶液B.pH=2的盐酸与pH=12的NaOH溶液等体积混合后的溶液C.0.02mol·L-1盐酸与0.02mol·L-1氨水等体积混合后的溶液D.0.01mol·L-1盐酸与0.03mol·L-1氨水等体积混合后的溶液答案A解析D项混合后得到0.01mol·L-1氨水和0.005mol·L-1NH4Cl的混合溶液,相当于往A项溶液中加入NH4Cl,因而D的pH比A的小。
3.常温下,0.1mol·L-1醋酸溶液的pH=a,下列能使溶液pH=a+1的措施是()A.将溶液稀释到原体积的10倍B.加入适量的醋酸钠固体C.加入等体积的0.2mol·L-1盐酸D.提高溶液的温度答案B解析醋酸是弱酸,电离方程式是CH3COOH H++CH3COO-,故稀释10倍,pH增加不到一个单位,A项错误;加入适量的醋酸钠固体,抑制醋酸的电离,使其pH增大,可以使其pH由a变成a+1,B项正确;加入等体积的0.2mol·L-1盐酸,虽然抑制了醋酸的电离,但增大了[H+],溶液的pH减小,C项错误;提高溶液的温度,促进了醋酸的电离,[H+]增大,溶液的pH减小,D项错误。


什么是酸碱滴定曲线如何解读曲线酸碱滴定曲线是一种实验手段,用于测定溶液中酸碱物质的浓度。
滴定曲线可以通过测量溶液的pH值随滴定剂滴加量的变化来记录。
在酸碱滴定实验中,酸碱滴定曲线通常以滴加剂的体积(毫升)为横坐标,pH值为纵坐标。
这种曲线通常呈现特定的形状,对于不同的滴定反应有不同的特征。
下面将介绍一些常见的酸碱滴定曲线形状以及它们的解读。
1. 酸滴定强碱曲线(例如:硫酸与氢氧化钠滴定)这种曲线的特点是起始pH值较低,随着酸溶液中碱的滴加,pH值迅速上升。
当酸溶液与碱溶液完全反应时,pH值会稳定在一个较高的水平,接近中性。
这个稳定的pH值称为滴定终点,标志着酸与碱反应已经发生完全。
酸滴定强碱曲线的起点和终点对于酸碱指示剂的选择至关重要,以确保终点的准确测定。
2. 弱酸滴定强碱曲线(例如:乙酸与氢氧化钠滴定)这种曲线的特点是起始pH值较高,在滴加碱的过程中,pH值缓慢上升。
在滴定终点之前,pH值会迅速上升,然后趋于平缓。
这是因为弱酸的离子化程度较低,所以pH值的变化在滴定终点附近较为剧烈。
对于弱酸滴定强碱曲线的解读,需要注意终点前的pH值变化较为缓慢。
3. 强酸滴定弱碱曲线(例如:盐酸与氨水滴定)这种曲线的特点与弱酸滴定强碱曲线相似,但是反应终点的pH值较低。
在反应终点之前,pH值的变化会较为平缓,而终点之后则会迅速上升。
在滴定强酸与弱碱的反应中,最重要的是确保终点的准确测定,以便确定滴定终点和等当点的位置。
酸碱滴定曲线的解读可以提供以下信息:1. 酸或碱的初始浓度:通过起始pH值可以初步判断酸或碱的浓度范围;2. 滴定终点和等当点:滴定终点是酸碱反应完全发生的标志,而等当点是滴定剂与被滴定物质化学计量比例相等的点。
这两个点的位置对于滴定结果的准确性非常重要;3. 滴定反应的性质:根据滴定曲线的形状,可以初步判断滴定反应是强酸强碱、强酸弱碱还是弱酸强碱。
总之,酸碱滴定曲线作为一种重要的实验手段,可以提供关于溶液中酸碱物质浓度和反应特性的信息。
高二化学知识点酸碱中和反应的滴定曲线解析酸碱中和反应是化学中常见的反应类型之一,它涉及到酸和碱之间的中和反应,而滴定曲线则是研究这类反应的重要工具。
本文将对高二化学中酸碱中和反应的滴定曲线进行详细解析,以帮助读者更好地理解和掌握这一知识点。
一、滴定曲线的基本概念滴定曲线是指在滴定过程中,酸碱溶液体积的变化与酸碱反应进程的关系所绘制出的曲线。
它通常是通过将一种已知浓度的溶液(称为滴定液)滴加到待测溶液中,使两者发生中和反应,观察并记录酸碱溶液体积变化的过程。
根据反应的性质不同,滴定曲线可以分为强酸与强碱的滴定曲线、弱酸与强碱的滴定曲线以及弱酸与弱碱的滴定曲线。
在本文中,我们将主要讨论强酸与强碱的滴定曲线。
二、滴定曲线的特点及解析1. 初始阶段滴定反应开始时,滴定液以小滴加入待测溶液中,此时待测溶液的pH值较低。
滴定曲线的第一段通常表现为水平直线或轻微的上升趋势,并在该段上方有一个较大的峰值,这是由于待测溶液的酸性较强,滴定液与其反应后,pH值上升较慢。
2. 中间阶段当滴定液继续滴加进入待测溶液时,酸和碱的等浓度点逐渐接近,滴定曲线会出现一个非常陡峭的区域,称为“垂直区”。
在这个区域内,pH值变化很快,对应的体积变化也非常明显。
这是由于滴定液与待测溶液中酸碱反应达到接近等当点(酸碱滴度相等)。
3. 终点阶段滴定曲线的终点处于“垂直区”的最后部分,即pH值随着滴定液的加入呈现急剧上升趋势。
此时,滴定液与待测溶液中的酸性物质完全中和,达到了反应的终点。
可以通过加入指示剂来辅助判断滴定曲线的终点位置,常用的指示剂有酚酞、溴酸亚铁等。
三、滴定曲线中的重要参数1. 滴定终点滴定终点是指滴定反应达到完成的时刻,通常是指观察到滴定溶液的颜色突变或者指示剂的溶色变化。
在滴定曲线中,滴定终点对应于曲线的最陡峭点,也就是pH值变化最为显著的位置。
2. 等当点等当点是指当酸和碱摩尔数相等时,滴定反应的中和点。
对于强酸与强碱的滴定曲线而言,等当点的pH值为7。
酸碱滴定曲线知识点总结酸碱滴定曲线的知识点主要包括滴定曲线的特点、影响滴定曲线的因素、酸碱指示剂的选择、酸碱滴定反应的原理和个步骤以及利用滴定曲线进行酸碱测定的方法和技巧。
接下来就对这些知识点进行详细的介绍。
一、酸碱滴定曲线的特点酸碱滴定曲线通常是以滴定剂的用量为横坐标,PH值为纵坐标绘制的曲线图。
在曲线图中,通常会出现以下几个特点:1. 曲线的形状:在酸碱滴定曲线中,通常会出现“S”形状的曲线,这是由于酸碱滴定过程中,溶液中酸碱度的变化导致PH值迅速变化的结果。
曲线的“S”形状反映了滴定过程中PH值的急剧变化。
2. 等当量点:在酸碱滴定曲线中,通常会出现PH值迅速改变的区域,这就是等当量点。
在等当量点附近,PH值的变化最为剧烈,此时滴定液与被滴定液的摩尔比为1:1,也就是当量点。
3. 弱酸弱碱滴定曲线的特点:对于弱酸和弱碱来说,滴定曲线的S形状会更加平缓,因为它们的离子化程度较低,滴定过程中PH值变化不会那么剧烈。
二、影响滴定曲线的因素酸碱滴定曲线受到多种因素的影响,主要包括以下几个方面:1. 滴定物质的性质:不同的酸碱物质,在滴定曲线上的表现也是有差异的。
比如,强酸、强碱的滴定曲线会比弱酸、弱碱的曲线更为陡峭。
2. 滴定剂的浓度:滴定剂的浓度越高,滴定曲线的变化也会越为剧烈。
3. 温度:温度也会对滴定曲线产生一定的影响。
一般来说,温度越高,离子化作用也越强,滴定曲线的形状也会发生变化。
4. 溶液的缓冲能力:当溶液具有一定的缓冲性能时,滴定曲线的形状会发生变化,PH值的变化会相对较为平缓。
5. 滴定速度:快速滴定和缓慢滴定会导致滴定曲线的形状发生变化,也会影响等当量点的位置。
三、酸碱指示剂的选择在进行酸碱滴定实验时,常常需要选用酸碱指示剂来标示溶液的中和点。
酸碱指示剂是一种可以根据PH值的变化显示不同颜色的化合物,选择合适的酸碱指示剂是非常重要的。
常见的酸碱指示剂包括:1. 甲基橙:甲基橙是一种弱酸性指示剂,通常在PH4.4-6.2范围内呈现红色至橙黄色。
专题突破26滴定曲线(pH 曲线)分析
1.图示强酸与强碱滴定过程中pH 曲线
(以0.1000mol·L -1NaOH 溶液滴定20.00mL 0.1000mol·L -
1盐酸为例
)2.强酸(碱)滴定弱碱(酸)pH 曲线比较
氢氧化钠滴定等浓度等体积的盐酸、醋
酸的滴定曲线盐酸滴定等浓度等体积的氢氧化钠、氨水的滴定曲线
曲线起点不同:强碱滴定强酸、弱酸的曲线,强酸起点低;强酸滴定强碱、弱碱的曲线,强碱起点高
突跃点变化范围不同:强碱与强酸反应(强酸与强碱反应)的突跃点变化范围大于强碱与弱酸反应(强酸与弱碱反应)
特别提醒恰好中和=酸碱恰好完全反应≠滴定终点≠溶液呈中性。
每小题有一个或两个选项符合题意。
1.(2020·咸阳模拟)常温下,用0.10mol·L
-1NaOH 溶液分别滴定20.00mL 0.10mol·L -1HCl 溶液和20.00mL 0.10mol·L
-1CH 3COOH 溶液,得到两条滴定曲线,如图所示,则下列说法
正确的是()
A.图2是滴定盐酸的曲线
B.a与b的关系是a>b
C.E点对应离子浓度由大到小的顺序可能为[CH3COO-]>[Na+]>[H+]>[OH-]
D.这两次滴定都可以用甲基橙作为指示剂
答案BC
解析如果酸为强酸,则0.10mol·L-1酸的pH为1,根据酸的初始pH知,图1为盐酸的滴定曲线,故A错误;根据图1知,a点氢氧化钠溶液的体积是20.00mL,酸和碱的物质的量相等,二者恰好反应生成强酸强碱盐,其溶液呈中性;醋酸溶液中滴入氢氧化钠溶液,醋酸钠溶液呈碱性,所以氢氧化钠溶液的体积小于20.00mL,a>b,故B正确;E点溶液的成分为醋酸钠和醋酸,溶液呈酸性,说明醋酸的电离程度大于醋酸钠的水解程度,盐类水解程度较小,则溶液中离子浓度可能为[CH3COO-]>[Na+]>[H+]>[OH-],故C正确;氢氧化钠和盐酸恰好反应呈中性,可以选择甲基橙或酚酞;氢氧化钠和醋酸恰好反应生成醋酸钠溶液呈碱性,只能选择酚酞,故D错误。
2.(2020·郑州模拟)如图曲线a和b是盐酸与氢氧化钠溶液相互滴定的滴定曲线,下列叙述正确的是()
A.盐酸的物质的量浓度为1mol·L-1
B.P点时反应恰好完全,溶液呈中性
C.曲线a是盐酸滴定氢氧化钠的滴定曲线
D.酚酞不能用作本实验的指示剂
答案B
解析依据曲线的起点可判断盐酸和NaOH的浓度均为0.1mol·L-1,曲线a为NaOH滴盐酸的滴定曲线,曲线b为盐酸滴NaOH的滴定曲线,强酸与强碱的中和滴定既可用甲基橙也可用酚酞作指示剂。
3.用0.1000mol·L-1的标准盐酸分别滴定20.00mL的0.1000mol·L-1氨水和20.00mL的0.1000mol·L-1氢氧化钠溶液的滴定曲线如图所示,横坐标为滴定百分数(滴定用量/总滴定用量),纵坐标为滴定过程中溶液pH,甲基红是一种酸碱指示剂,变色范围为4.4~6.2,下列
有关滴定过程说法正确的是()
A.滴定氨水,当滴定分数为50%时,各离子浓度间存在关系:[NH+4]+[H+]=[OH-]
B.滴定分数为100%时,即为滴定过程中反应恰好完全的时刻
C.从滴定曲线可以判断,使用甲基橙作为滴定过程中的指示剂准确性更佳
D.滴定氨水,当滴定分数为150%时,所得溶液中离子浓度有大小关系[Cl-]>[H+]>[NH+4]>[OH-]答案B
解析溶液中存在的电荷守恒应为[NH+4]+[H+]=[OH-]+[Cl-],故A错误;滴定分数为100%时,酸与碱的物质的量相等,即为滴定过程中反应恰好完全的时刻,故B正确;从滴定曲线
看甲基红变色范围更接近于滴定终点,使用甲基橙显示偏晚,故C错误;滴定分数为150%
时,即加入盐酸30.00mL,此时溶质是NH4Cl和HCl,物质的量之比为2∶1,故[NH+4]>[H+],故D错误。
4.298K时,向20.0mL0.10mol·L-1H2A溶液中滴加0.10mol·L-1NaOH溶液,滴定曲线如图所示。
下列说法正确的是()
A.该滴定过程应该选择石蕊溶液作指示剂
B.W点到X点发生的主要反应的离子方程式为H2A+OH-===HA-+H2O
C.Y点对应的溶液中[Na+]+[H+]=[OH-]+2[A2-]
D .反应H 2A +A 2
-2HA -的平衡常数K =1.0×107.4答案
BD 解析石蕊不能用作酸碱中和滴定的指示剂,根据图示滴定终点的pH ,可知第二反应终点应用酚酞作指示剂,A 项错误;X 点对应的溶液中溶质主要是NaHA ,W 点到X 点发生的主要反应的离子方程式为H 2A +OH -===HA -+H 2O ,B 项正确;根据电荷守恒,[Na +]+[H +]=[OH -]+[HA -]+2[A 2-],因为Y 点对应的溶液中[HA -]=[A 2-],所以[Na +]+[H +]=[OH -]+3[A 2-],C 项错误;H 2A
HA -+H +,K a1=[H +][HA -][H 2A],由于W 点[HA -]=[H 2A],故K a1=[H +]=1.0×10-2.3mol·L -1;HA -A 2-+H +
,K a2=[H +][A 2-][HA -],由于Y 点对应的溶液中[HA -]=[A 2-],故K a2=[H +
]=1.0×10-9.7mol·L -1;H 2A HA -+H +与HA -A 2-+H +相减即得H 2A +A 2-2HA -,此时的平衡常数K =K a1K a2=1.0×10-2.31.0×10
-9.7=1.0×107.4,D 项正确。
图像题的分析步骤
首先看纵坐标,搞清楚是酸加入碱中,还是碱加入酸中;
其次看起点,起点可以看出酸性或碱性的强弱,这在判断滴定终点时至关重要;
再次找滴定终点和pH =7的中性点,判断滴定终点的酸碱性,然后确定中性点(pH =7)的位置;
最后分析其他的特殊点(如滴定一半点,过量一半点等),分析酸、碱过量情况。