第5讲-药物化学修饰-1
- 格式:pdf
- 大小:12.46 MB
- 文档页数:95

药物的化学结构修饰大纲要求:1.总体掌握药物化学结构的修饰对药效的影响,并能熟悉所举药物的修饰目的;2. 药物化学结构修饰的常用方法重点:药物化学结构修饰的常用方法第一节药物的化学结构修饰的作用一、改善药物的吸收性能例:氨苄西林口服吸收差,羧基成酯制成匹氨西林二、延长药物的作用时间例:氟奋乃静羟基制成庚酸酯或癸酸酯三、增加药物对特定部位作用的选择性例:氮芥引入苯丙氨酸制成美法仑,使其较多地富集于肿瘤组织中美法仑氟尿嘧啶制成去氧氟尿苷四、降低药物的毒副作用例:阿司匹林制成贝诺酯五、提高药物的稳定性六、改善药物的溶解性能双氢青蒿素制成青蒿琥酯七、消除不适宜的制剂性质苦味、不良气味例:克林霉素制成磷酸酯,解决疼痛,棕榈酸酯解决味苦第二节药物化学结构修饰的基本方法常用的修饰方法有:酯化和酰胺化、成盐修饰、成环和开环修饰酯化和酰胺化修饰:具有羧基药物的修饰;具有羟基药物的修饰;具有氨基药物的修饰成盐修饰:酸性药物的成盐修饰;碱性药物的成盐修饰一、酯化和酰胺化1、具有羧酸基(-cooh)的药物的修饰:例:贝诺酯(阿司匹林+对乙酰氨基酚)2、含羟基(-oh)药物,修饰方法,以羧酸化合物进行酯化例:维生素a(e)做成维生素a(e)醋酸酯3、含氨基(-nh2)药物的修饰以含羧基的化合物进行酰胺化例:对氨基水杨酸氨基的酰化二、成盐修饰修饰的作用:降低刺激,增加溶解度酸性药物成盐:羧酸类、磺酸类、磺酰胺类、磺酰亚胺类、酰亚胺类、酰脲类、酚类、烯醇类碱性药物成盐:碱性的可制成盐酸盐、硫酸盐三、成环和开环维生素b1季铵口服吸收差,开环修饰得到丙舒硫胺和呋喃硫胺总结:1. 分配系数的概念,官能团对分配系数的影响:烃基、卤素、脂环使药物的脂溶性增大,p 增大;而羟基、羧基、胺可使水溶性增大,p减小。
p过高过低对药效产生不理影响,只有适宜的分配系数才有利于药效的发挥。
2. 基团对药物理化性质的影响,烃基、卤素、羟基和巯基、醚类和硫醚、磺酸、羧酸、酯基、酰胺对药物解离度及药效的影响。





2016年执业药师药物化学第五讲考点四第五讲考点四手性药物的立体化学结构、构型和生物活性特点。
一、手性药物的基本知识:(非考点)1.含手性中心的药物,称手性药物。
最常见是C原子,还有N或S,具有对映异构体(光学异构体)2.一个手性中心有两个异构体,(N个有2N)3.手性中心的构型常用R和S表示(糖和氨基酸习惯用L和D表示)4.具有对映异构体,具旋光性。
可使偏振光向左旋转的为左旋体(-),向右旋转的为右旋体(+)5.消旋体(±):一对对映体等量的混合物称外消旋体分子中本身存在对称面的称内消旋体6.手性药物的异构体在活性、毒性和代谢方面有时有一定差异。
二、考纲的要求:1.哪些药物具手性原子,属于手性药物,具有对映异构体。
2.手性药物的立体化学结构、构型和生物活性特点。
3.手性药物的不同异构体在活性、代谢和毒性方面有什么差异。
某些手性药物在代谢上可能有立体选择性。
很多药物均有手性碳,但不需要都掌握,下面总结的是考纲明确提到手性药物及其在活性、毒性、代谢等方面有特点的。
三、手性药物不同异构体在活性差异分五种情况①对映体之间具有等同的药理活性和强度一般不会出题②具有相同的药理活性,但强弱不同会出少量的题,如氯苯那敏,右旋体活性高于左旋体③一个有活性,一个没有活性,如萘普生仅(S+)有活性④具有相反的活性,如:多巴酚丁胺左旋体激动α受体,右旋体拮抗α受体,⑤具有不同类型的药理活性,如:丙氧芬,右旋体镇痛,左旋体镇咳四、总结含一个手性中心,临床使用外消旋体的药物(考纲明确提到有手性碳的)(省略盐)(注:+为右旋体,-为左旋体,后同)1章阿米卡星(注:本身有多个手性碳,所引入的侧链2-羟基丁酰胺含1个手性碳);7章磷酸氯喹(活性相同,d-异构体比L体毒性低);9章奥沙西泮(右旋体作用比左强)、佐匹克隆S-(+);11章舒必利(S左旋有活性)、氟西汀(S-体选择性强,R+体长效);西酞普兰和艾司西酞普兰(S);受体强);米氮平(S结合α受体强,R抑制5HT313章美沙酮(左旋体镇痛活性大于右);14章氯贝胆碱(S活性高)15章异丙肾上腺素(R-大于S+)、沙丁胺醇(R-大于S+,后者代谢慢)、多巴酚丁胺(左旋体激动α受体,右旋体拮抗α受体,故用消旋体可减少不良反应)、氯丙那林、克仑特罗、普萘洛尔(S-构型强)、阿替洛尔;16章普罗帕酮(R和S异构体药效和药代动力学存在立体选择性);18章尼群地平、尼莫地平、氨氯地平(左旋活性大)、盐酸尼卡地平、维拉帕米(右旋体作用强);21章华法林钠(S强);27章奥美拉唑(S原子)(分离出S异构体埃索美拉唑,清除率低);泮妥拉唑(体内可发生右旋体向左旋体的单方向构型转化)29章盐酸昂丹司琼(R活性大)30章布洛芬(作用来自S+)、酮洛芬;31章氯苯那敏(S+对映体活性强);五、总结含有一个手性中心,临床使用有活性的对映异构体的:(省略盐)2章左氧氟沙星(S-);7章左旋咪唑(S-);9章氨己烯酸(S);15章去甲肾上腺素(R-)、肾上腺素(R-);马来酸噻吗洛尔(S-)、21章硫酸氯吡格雷(S)、27章右美沙芬(右镇咳,左镇痛);28章埃索美拉唑(S-药物代谢选择性);30章萘普生(S+);34章瑞格列奈(S+);那格列奈(R—)最佳选择题1.不属于手性药物的是A.尼群地平B.氨氯地平C.盐酸尼卡地平D.硝苯地平E.尼莫地平【正确答案】D考点解析:均为二氢吡啶类钙拮抗剂抗高血压药,D硝苯地平3,5位的酯相同,4位无手性碳,其余4个药均含1个手性碳最佳选择题2.那个是为数不多的以活性异构体S-左旋体作为药用的β受体拮抗剂A.卡维地洛B.比索洛尔C.马来酸噻吗洛尔D.艾司洛尔E.美托洛尔【正确答案】C考点解析:β受体拮抗剂多用外消旋体,C马来酸噻吗洛尔用S异构体,结构式如下配伍选择题[3-4]A.氯诺昔康B.布洛芬C.萘普生D.帕瑞昔布E.双氯芬酸钠3.临床使用消旋体,体内代谢R型体内可转化成S型【正确答案】B4.临床使用S-构型右旋光学活性异构体【正确答案】C考点解析:B布洛芬体内代谢可使无活性的R型体转化成有活性的S型,使用消旋体,而C萘普生不能发生上述代谢,故使用S-构型右旋体最佳选择题5.下列哪项与盐酸多巴酚丁胺不符A.具儿茶酚胺结构B.1个手性碳,两个异构体,均激动β受体1C.临床用消旋体D.左旋体激动α1受体,右旋体拮抗α1受体E.1个手性碳,两个异构体,均激动α1受体【正确答案】E考点解析:E多巴酚丁胺的两个异构体对α1受体具有相反的活性,故使用消旋体,以减少不良反应。


药物分子结构修饰药物在应用的过程中,常会出现一些影响药物发挥应有作用或影响对药物应用的因素。
例如,由于化学结构的特点引起代谢速度过快或过慢;化学的不稳定性、溶解性能差、有不良的气味或味道、对机体产生刺激性或疼痛;等等。
将药物的化学结构进行修饰,可以克服上述缺点,提高药物的活性和增强疗效。
保持药物分子原有的基本化学结构,仅对其中的某些官能团作一定的化学结构改变称为化学结构修饰。
例如,使用克林霉素时,注射会引起疼痛,而在口服时味道又比较苦。
为了改变这些不良反应,可以对克林霉素分子结构进行修饰。
若将克林霉素形成磷酸酯,可以解决注射后产生疼痛问题;若将克林霉素制备成棕榈酸酯,则可解决口服时味苦的缺陷(如图2-22)。
这两个修饰后的克林霉素酯进入体内后,会经过水解生成克林霉素而发挥作用。
图2-22 克林霉素分子结构修饰药物化学结构修饰的方法有很多,主要根据药物结构中存在的活性基团进行适当的修饰。
常用的修饰方法有:酯化、酰胺化、成盐修饰等。
酯化和酰胺化修饰是药物化学结构修饰中最常用的修饰方法,主要用于含有羟基、羧酸基、氨基等基团药物的修饰。
分子中含羟基或羧基的药物,可选择成酯修饰的方法。
羟基成酯后常可延长药物的半衰期,增加脂溶性,提高生物利用度。
羧基成酯后可降低药物的极性,减少对胃肠道及皮肤的刺激性,改善生物利用度。
含氨基药物常常被修饰成酰胺。
成酰胺修饰后,可增加药物的化学稳定性,降低毒副作用,延长药物作用时间。
具有酸、碱性的药物,可以转变成适当形式的盐。
下面再介绍两种药物分子的结构修饰。
(1)阿司匹林阿司匹林是第一个人工合成的药物。
阿司匹林又称乙酰水杨酸,化学名为2-乙酰氧基苯甲酸,是一种常用的解热、抗炎药物。
早在公元前3 000年,人们发现柳树皮具有解热镇痛功效。
1838年,意大利化学家拉菲勒·皮里亚以柳树皮为原料制得水杨酸。
但是水杨酸酸性很强,对人的肠胃有刺激性。
1897年,德国化学家费利克斯·霍夫曼将水杨酸的羟基乙酰化,成功合成乙酰水杨酸这一“明星药物”。
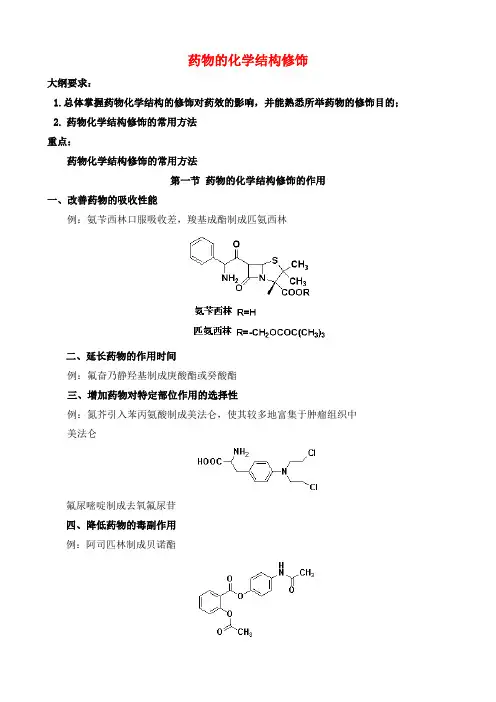
药物的化学结构修饰大纲要求:1.总体掌握药物化学结构的修饰对药效的影响,并能熟悉所举药物的修饰目的;2.药物化学结构修饰的常用方法重点:药物化学结构修饰的常用方法第一节药物的化学结构修饰的作用一、改善药物的吸收性能例:氨苄西林口服吸收差,羧基成酯制成匹氨西林二、延长药物的作用时间例:氟奋乃静羟基制成庚酸酯或癸酸酯三、增加药物对特定部位作用的选择性例:氮芥引入苯丙氨酸制成美法仑,使其较多地富集于肿瘤组织中美法仑氟尿嘧啶制成去氧氟尿苷四、降低药物的毒副作用例:阿司匹林制成贝诺酯五、提高药物的稳定性六、改善药物的溶解性能双氢青蒿素制成青蒿琥酯七、消除不适宜的制剂性质苦味、不良气味例:克林霉素制成磷酸酯,解决疼痛,棕榈酸酯解决味苦第二节药物化学结构修饰的基本方法常用的修饰方法有:酯化和酰胺化、成盐修饰、成环和开环修饰酯化和酰胺化修饰:具有羧基药物的修饰;具有羟基药物的修饰;具有氨基药物的修饰成盐修饰:酸性药物的成盐修饰;碱性药物的成盐修饰一、酯化和酰胺化1、具有羧酸基(-cooh)的药物的修饰:例:贝诺酯(阿司匹林+对乙酰氨基酚)2、含羟基(-oh)药物,修饰方法,以羧酸化合物进行酯化例:维生素a(e)做成维生素a(e)醋酸酯3、含氨基(-nh2)药物的修饰以含羧基的化合物进行酰胺化例:对氨基水杨酸氨基的酰化二、成盐修饰修饰的作用:降低刺激,增加溶解度酸性药物成盐:羧酸类、磺酸类、磺酰胺类、磺酰亚胺类、酰亚胺类、酰脲类、酚类、烯醇类碱性药物成盐:碱性的可制成盐酸盐、硫酸盐三、成环和开环维生素b1季铵口服吸收差,开环修饰得到丙舒硫胺和呋喃硫胺总结:1.分配系数的概念,官能团对分配系数的影响:烃基、卤素、脂环使药物的脂溶性增大,p增大;而羟基、羧基、胺可使水溶性增大,p减小。
p过高过低对药效产生不理影响,只有适宜的分配系数才有利于药效的发挥。
2.基团对药物理化性质的影响,烃基、卤素、羟基和巯基、醚类和硫醚、磺酸、羧酸、酯基、酰胺对药物解离度及药效的影响。

有机药物的化学结构修饰有机药物的化学结构修饰是指通过对药物分子结构进行修改和改造,以提高药物的药效、药代动力学、药物稳定性等性能的方法。
这些修饰可以包括改变药物的活性基团、构建药物的立体结构、调整药物的溶解性和分配系数等。
以下将介绍几种常见的有机药物结构修饰方法。
1.活性基团的修饰:活性基团是药物分子中参与药物分子与靶标结合和药物代谢的部分。
通过修改活性基团,可以改变药物的生物活性和选择性。
例如,药物分子中的酸碱性基团可以通过改变pKa值调整药物的溶解度和吸收性;可通过引入电子给体或电子受体基团来改变药物的电子结构,从而影响药物的活性和氧化还原性质。
2.立体结构的修饰:通过合理设计和改变药物分子的立体结构,可以调整药物与靶标的空间结合和药物与酶的识别作用。
通过合成不对称碳原子,引入手性中心,可以合成对映异构体,提高药物的选择性。
此外,立体选择性修饰还可以通过采用光化学反应、合成辅助手段等方法来实现。
3. 溶解性和分配系数的修饰:药物的溶解度和分配系数(Solubility and Partition Coefficient, LogP)是决定药物吸收和持续时间的重要因素。
通过改变药物分子的亲水性或疏水性部分,可以调整药物的溶解度和分配系数。
例如,引入磺酰基、酯基、羧酸酯基等官能团,可以提高药物的水溶性;引入脂肪酸链、芳香基团等可以提高药物的脂溶性。
4.药物分子的磺酸化和磷酸化修饰:通过在药物分子中引入磺酸基或磷酸基,可以改变药物的物化性质,增加药物的水溶性和极性,从而提高药物的药代动力学特性,如增加药物的代谢和排泄速度。
5.药物分子的骨架修饰:通过合理设计和改变药物分子的骨架结构,可以影响药物的活性、选择性和生物可用性。
例如,合成药物的脱氢结构和酮糖环,可以提高药物的活性和生物可用性;通过改变药物分子的链长和环的数量,可以有效改变药物的生物利用度和药物代谢速度。
总之,有机药物的化学结构修饰是一种重要的方法,可以通过调整药物分子的结构和功能团,改善药物的药物性能,以实现药物的高效性、低毒性和良好的生物利用度。

尤启东《药物化学》讲义第一节 药物的名称药物可分为非专有名和商标名两大类,学术性期刊上都用非专有名,但医生处方往往用商标名为多。
非专有名源自化学名(1)非专有名(Nonproprietary name)或称通用名称(Genetic name)。
1953年世界卫生组织WHO 公布国际非专有药名(International nonproprietary names for pharmaceutical substances),简称INN 的命名原则: (1) 发音拼法清晰明了,名词不宜太长(2) 同属一类药理作用的相似药物,适当表明其关系(3) 应避免可能给患者有关解剖学.生理学.病理学.治疗学的暗示 举例如下2-Chloro -10-(3-dimethylaminopropyl) phenothiazine 取部分字母成为Chlorpromazine 氯丙嗪,治疗精神病1-Hydrrazinophthalazine 取部分字母成为 Hydralazine 肼屈嗪(过去译为肼苯哒嗪),降低血压S N(CH 2)3N(CH 3)2ClNN NHNH 23,4-dihydroxyphenylalanine 取名Dopa 多巴,治疗震颤麻痹症5-(4-Chloropheyl)-6-ethyl-2,4-pyrimidinediamine 称Pyrimethamine 乙胺嘧啶,治疗疟疾药理作用相似药物Cimetidine 西咪替丁 Ranitidine 雷尼替丁 Famotidine 法莫替丁 局部麻醉药Cocaine 可卡因 Procaine 普鲁卡因 Lidocaine 利多卡因 头孢类抗生素Cefaclor 头孢龙罗 Cefradine 头孢柱定 Ceftizoxime 头孢唑肟商标名称 各公司注册商标的名称,不能冒用非专有名称 译 名 商标名称 Pyrimethamine 乙胺嘧啶 DaraprimO H OH C H 2CH 2COOH NNClC 2H 52NH 2Chlorpromazine 氯丙嗪 Prozil Chloramphenicol 氯霉素 Chlormycetin Hydralazine 肼屈嗪 Apresoline Methadone 美沙酮 Dolophine中文译名要求贯彻药政条理,名称要简洁.明确.科学.不准用代号,可以音译,也可意译,也可音意合译。
绪论听课目的:应掌握执业必备的药物化学知识和技能,其中以药物的名称、结构、理化性质和构效关系为主,强调药物作用的化学本质,注重药物体内代谢引发的化学变化,药物应用过程中的相互作用,理解这些变化和相互作用对药物活性的影响,熟悉特殊管理药物的药物化学知识。
什么是药物?什么是药物化学?一、药物化学及其研究内容药物通常是指对疾病具有预防、治疗或诊断作用的物质,以及对调节人体功能、提高生活质量、保持身体健康具有功效的物质。
化学药物是以化合物作为其物质基础,以药物发挥的功效(生物效应)作为其应用基础,可以是无机的矿物质或合成的有机化合物,或从天然药物中提取得到的有效单体,以及通过发酵方法得到的抗生素等等。
药物化学(药物、化学)所研究的对象就是这类既具有药物的功效,同时又有确切化学组成的药物,即化学药物。
是融合化学学科和生命科学学科知识的一门交叉学科药物化学是研究药物的化学性质、合成、药物与生物体的相互作用,以及在学科发展中所形成的新药设计原理和方法的一门综合性学科。
药物化学的研究任务大致为:①为合理利用已知的化学药物提供理论基础。
②为生产化学药物提供先进、经济的方法和工艺。
③寻找和发现新药。
创制和发现新药已成为药物化学的一项重要的任务。
二、药物化学的发展1.人们对药物的应用是源于天然产物,特别是植物。
2.天然药物中所含的化学物质是天然药物产生治疗作用的物质基础。
3.从有机化合物中寻找对疾病有治疗作用的化合物,提出了药效团的概念,指导人们开始有目的的药物合成研究。
4.实验药理学推动了药物化学的发展。
5.30年代磺胺药物的发现,发展了利用体内代谢产物进行新药设计和研究,创立了药物的抗代谢作用机制学说;6.40年代青霉素用于临床,开创了从微生物代谢产物中寻找抗生素的思路。
7.20世纪50年代以后,人们对体内的代谢过程,身体的调节系统,疾病的病理过程有了更多的了解,对蛋白质、酶、受体、离子通道等有了更深入的研究。
8.60年代对受体的深人研究促进了对受体激动剂和拮抗剂的发展。
第⼗⼋章药物的化学结构修饰
化学结构修饰:不改变药物的基本结构和基团。
化学结构改造:利⽤各种化学原理改变药物的基本结构和基团。
⼀、药物化学结构修饰的⽬的:
1、提⾼药物对靶部位的选择性:抗肿瘤药物磷雌酚-⼰烯雌酚 SMZ--N-酰基- -⾕氨酰衍⽣物
2、提⾼药物的稳定性:羧苄青霉素-茚满酯(成酯)
3、延长药物的作⽤时间:⽤油剂给药睾酮制成前药氟奋乃静
4、改善药物的吸收:提⾼⽣物利⽤度增⼤脂溶性
5、改善药物的溶解性:阿昔洛韦制成前药苯妥英成酯
6、降低药物的毒副作⽤:增加选择性、延长半衰期、提⾼⽣物利⽤度
7、发挥药物配伍作⽤:
⼆、成盐修饰:适于具酸性和碱性基团的药物
1、酸性药物的成盐修饰:
2、碱性药物的成盐修饰:脂肪氨基碱性强成⽆机酸盐,芳⾹氨基碱性弱作有机酸盐,降低毒性。
三、成酯及成酰胺:
1、具羧基成酯:布洛芬萘普⽣
2、具羟基成酯:可延长药物的半衰期甲硝唑红霉素
3、具氨基成酰胺:增加药物的组织选择性溶⾁瘤素氨基甲酰化成氮甲别嘌醇丝裂霉素
四、具羰基药物、开环(阿普唑仑、VB1)、成环修饰。